Запишите выражение для константы устойчивости данного комплекса. Предложите эксперимент, доказывающий, что хлорид-ионы входят в состав внутренней сферы комплекса.
Геометрическая изомерия (цис-транс изомерия) состоит в различном пространственном расположениии лигандов вокруг центрального атома. Так, [PtCl2(NH3)2] существует в виде двух изомерных форм, отличающихся друг от друга рядом свойств. 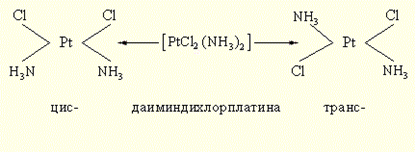
- координационная полимерия- для данного типа изомерии соединения с одинаковым элементным составом отличаются молекулярной массой: [Pt(NH3)4][PtCl4] и [Pt(NH3)2Cl2] характеризуются одинаковым элементным составом, но разной молекулярной массой.
[Pt(NH3)2Cl2] не диссоциирует, т.к. является комплексным неэлектролитом.
диссоциации комплексного иона:[PtCl2(NH3)2]=Pt2++2 Cl- +2NH3
Куст.=
PtCl4-6NH3PtCl4-2NH3, PtCl4-2KCl.
Если подействовать на раствор первого соединения раствором AgNO3, то весь содержащийся в нем хлор осаждается в виде хлорида серебра. Очевидно, что все четыре хлорид-иона находятся во внешней сфере и, следовательно, внутренняя сфера состоит только из молекул аммиака. Таким образом, координационная формула соединения будет [Pt(NH3)6]Cl4. Раствор соединения PtCl42NH3 не дает осадка с AgNO3, это соединение изображается формулой [Pt(NH3)2Cl4]. Наконец, из раствора» соединения Р1С142КС1 нитрат серебра тоже не осаждает! AgCl, но путем обменных реакций можно установить, что в растворе имеются ионы калия. На этом основании строение его изображается формулой Кг2[Р1С15].
2.Как по-вашему, почему кислота H2SiF6гораздо сильнее, чем H2SiO3?
Сила кислот определяется по степени их диссоциации. В этом отношении кремниевая кислота - очень слабая, к тому же почти не растворимая в воде. Кремнефтористоводородная - сильная кислота, сравнима азотной, но может существовать только в растворе. Почему сильнее? Потому, что фтор самый электроотрицательный элемент, а это сказывается на прочности связи Si-H
3.Что Вы знаете о влиянии комплексообразующей среды на химическую активность металлов подгруппы меди? Какова роль этого эффекта в технологических процессах выделения золота и серебра из рудных образований?
Известно, что медь и её аналоги (серебро и золото) растворяются в растворах основных цианидов в присутствии кислорода:
4Au + O2 +8NaCN +2H2O= 4Na[Au(CN)2] +4NaOH
Медь, кроме того, в присутствии кислорода растворяется в водных растворах аммиака:
4Cu +O2 +8NH3 +2H2O= 4[Cu(NH3)](OH)
Сделать вывод о роли комплексообразующей среде в усилении химической активности металлов, образованных элементами подгруппы меди."
Высокая устойчивость комплексов приводит к понижению электрохимического потенциала металла. Плюс к тому - образование растворимого соединения облегчает протекание реакции.
Медь(I), например, образует прочный комплекс с ацетонитрилом. В результате - HCl в ацетонитриле реагирует с медью с выделением водорода:
Cu + HCl --(An)--> [Cu(An)2]Cl + H2
Т.е. потенциал меди оказывается ниже потенциала водорода. В водной среде ситуация обратная, и медь в солянке не растворяется.
Для отделения самородного золота от пустой породы применяют промывку водой, растворение Аu в жидкой ртути с последующей разгонкой амальгамы. Лучшим методом отделения золота от пустой породы является цианидный метод. Этот метод основан на растворении Аu в растворе NаСN за счет окисления кислородом воздуха и перехода в анионный комплекс Nа[Аu(СN)2] с последующим вытеснением из цианоаурата (I) цинком:
2Nа[Аu(СN)2] + Zn = Nа2[Zn(СN)4] + 2Аu
4.На основе теории кристаллического поля объясните, почему водные растворы MnSO4,ZnSO4и К4[FeF6] бесцветны.
Окраска ионов в одных растворах зависит не только от собственной природы, но и от наличия в растворе других веществ, а также от концентрации и температуры.
ТКП даёт простое объяснение факту наличия или отсутствия окраски у комплекса. Если возможны электронные переходы между орбиталями T2g и Eg (а это возможно при электронной конфигурации центрального иона от d1 до d9) комплексные соединения окрашены. Если же такие переходы невозможны (а это будет при электронных конфигурациях центрального иона d0 или d10) комплексные соединения бесцветны. Бесцветны комплексы серебра, меди (I), золота (I), цинка, кадмия, ртути (во всех случаях d10), алюминия, магния, скандия, лантана (во всех случаях d0). А комплексы меди (II), золота (III) уже окрашены; окрашены комплексные соединения железа (II) и (III), никеля, кобальта и т.д. В этих случаях центральные ионы имеют электронную конфигурацию dn (n=1–9).
5. Что Вам известно об озоне? Расскажите, в чем суть проблемы «озоновых дыр».
Озо́н — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой газ. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, практически чёрные кристаллы.Обе связи O-O в молекуле озона имеют одинаковую длину 1,272 Å. Угол между связями составляет 116,78°. Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов.Термин озон был предложен немецким химиком X. Ф. Шёнбейном в 1840 году за его пахучесть, вошёл в словари в конце XIX века.
В лаборатории озон можно получить взаимодействием охлаждённой концентрированной серной кислоты с пероксидом бария[5]:
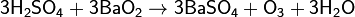
Озоновый слой, «оберегающий» наше с вами благополучие – разрушается. Длиться это, примерно 30 лет, исходя из докладов ученых. Бреши, образующиеся в озоновом слое «обозвали» озоновыми дырами. Самая большая расположена над Антарктидой. Понятие озоновая дыра, не означает в буквальном смысле отсутствия на этом участке атмосферы озона, но концентрация его меньше на 30-50 процентов нормы.Ученые считают, что причиной разрушения этого слоя – являются оксиды азота, которыми мы активно загрязняем атмосферу в последние несколько десятилетий.
6. Что Вы знаете о борной кислоте и специфике ее взаимодействия с водой?
Бо́рная кислота́ (ортоборная кислота) — слабая кислота, имеющая химическую формулу H3BO3.
Бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решетку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями (d= 0,318 нм).
Борная кислота токсична.Борная кислота применяется в медицине с 60-х годов XIX века как антисептическое средство не раздражающее ран и не имеющее вкуса, запаха и цвета. В современной медицине противомикробная эффективность борной кислоты считается низкой.
В природе свободная борная кислота встречается в виде минерала сассолина, в горячих источниках и минеральных водах.
Борная кислота проявляет очень слабые кислотные свойства. Она сравнительно мало растворима в воде. Ее кислотные свойства обусловлены не отщеплением протона Н+, а присоединением гидроксильного аниона:
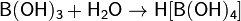
Ka = 5.8·10−10 моль/л; pKa = 9.24.
7. Какие химические процессы лежат в основе промышленного получения алюминия? В каких регионах России сосредоточены предприятия по производству алюминия?
Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия ? электролитом.
Электрометаллургический способ.Это способы получения металлов с помощью электрического тока (электролиза). Просмотр фрагмента медиалекции. (CD)Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
Юг Сибири – это крупный район производства алюминия, как из своего собственного сырья, так и привозного из Урала и Казахстана. Здесь располагаются крупные металлургические заводы в Братске, Красноярске, Усть-Илимске, Саяногорске, Шелехове. Основным фактором размещения в этом районе является не столько добыча сырья, сколько производство дешевой электроэнергии, так как выплавка алюминия очень энергоёмкий процесс.
8. Сопоставьте химические свойства оксидов серы SO2 и SO3. Какова их роль в природе и технологических процессах?
SO2 - диоксид серы или сернистый газ
Проявляет свойства восстановителя и окислителя
Бесцветный газ с удушливым запахом, устойчив с водой превращается в сернистую кислоту:
SO2 + H2O = H2SO3
SO3 - триоксид серы или серный ангидрид
- типичный кислотный оксид
Проявляет свойства сильного окислителя.
Бесцветная жидкость, растворяется хорошо в воде с образованием серной кислоты:
SO3 + H2O = H2SO4
9)Дайте сравнительный анализ свойств: а) H2S и H2O; б) H2O2 и H2S2. Что Вам известно о серном колчедане (FeS2)?
Химическое строение молекул H2S аналогично строению молекул H2O (угловая форма).
Но, в отличие от воды, молекулы H2S малополярны; водородные связи между ними не образуются; прочность молекул значительно ниже.
Физические свойства.
H2S -бесцветный газ с чрезвычайно неприятным удушливым запахом, очень ядовитый.
Сероводород в природе.
H2S присутствует в вулканических и подземных газах, в воде серных источников. Он образуется при гниении белков, содержащих серу, а также выделяется в процессе жизнедеятельности многочисленных микроорганизмов.
Химические свойства H2S
H2S- сильный восстановитель.
H2O может быть в 3-х агрегатных состояниях - жидком, твердом, газообразном.
температура кипения при ну. +100 градусов по Цельсию. замерзание при 0 градусах.
вода универсальный растворитель.
не имеет цвета, вкуса, запаха.
также вода хорошо тепло проводит.
но не проводит электричество.Перокси́д водоро́да H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.Пирит - FeS2 - от греч. "пиро" - огонь. Искрит при ударе. Цвет - светло-латунно-желтый, часто золотистый. Блек металлический. Непрозрачный. Твердость 6 -6,5. Хрупкий. Спайности нет. Происхождение магматическое, гидротермальное, осадочное. Сопутствующие минералы - грейгит, сидерит, галенит, барит и т. д. Используется для получение серной кислоты.
10) Что Вы знаете о структуре и химических свойствах гидразина и его производных ? Сформулируйте основные принципы подбора компонентов ракетного топлива.
Гидразин (NH2NH2) - это сильно гигроскопическая жидкость, обладающая заметной способностью поглощать из воздуха углекислоту и кислород. Замерзает гидразин при температуре плюс 1,5, кипит при температуре 113,5 (давление 760 мм рт. ст.)На воздухе горит синим пламенем. При этом выделяется значительное количество энергии.. Гидразин хорошо растворяется в воде, спиртах, аммиаке, аминах. Он нерастворим в углеводородах и их галоидоироизводных. Водные растворы обладают основными свойствами. Гидразин является сильным восстановителем. Благодаря этому он термодинамически неустойчив и легко разлагается под влиянием катализаторов, при нагревании до высоких температур, при действии излучений.Ракетными топливами называют вещества, способные в процессе химических превращений /горение/ выделять значительное количество тепла и использоваться в качестве источников энергии в авиации, ракетной технике и других областях энергетики. Ракетные /реактивные/ топлива делят на две основные категории — твердые и жидкие. В зависимости от этого различают и два типа ракетных двигателей — двигатели твердого топлива /РДТТ/ и жидкостные двигатели /ЖРД/. Последние в настоящее время являются наиболее распространенными и используются для запуска межконтинентальных и космических ракет.
По способу применения все топлива, используемые в жидкостных ракетных двигателях, делятся на однокомпонентные и двухкомпонентные. В ЖРД почти исключительно применяются последние. Унитарные топлива служат главным образом для приведения в действие топливных насосных агрегатов и некоторых двигателей малых тяг /например, для ориентации космических кораблей/.
В состав двухкомпонентного топлива входят: горючее /15-25%/ и окислитель /75-85%/, хранящиеся в двигателе в различных баках. Отсюда они подаются в камеру сгорания, где за счет продуктов их химического взаимодей ствия, вытекающих из сопла, создается реактивная тяга двигателя.
11)Расскажите о химических свойствах азотной кислоты. Какие взрывчатые вещества на основе соединений азота Вам известны ?
Химические свойства азотной кислоты

3) Азотная кислота по-разному реагирует с металлами. В этих реакциях в зависимости от концентрации кислоты и восстановительной способности металла выделяются различные оксиды азота, иногад азот и даже аммиак.
Азот входит в состав взрывчатых веществ (см. приложение), отравляющих веществ – ОВ (табун. VX-газы, азотистые иприты, синильная кислота, хлорциан, хлорпикрин и т.д.), ракетного топлива (гидразин), окислителей ракетного топлива (диоксид азота, азотная кислота).
12) Охарактеризуйте основные химические свойства пероксида водорода Н2О2. Как Вы считаете, в чем причина высокой реакционной способности соединений с пероксидной группой?
Основные Химические свойства пероксида водорода:
Разлагается на кислород и воду при нагревании, под действием ультрафиолетового излучения, а также в присутствии ионов переходных металлов и серебра:
2Н2O2 → 2H2O + O2
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет очень слабые кислотные свойства (К = 1,4·10–12). При действии концентрированного раствора Н2O2 на гидроксиды в ряде случаев можно выделить пероксиды металлов (Li2O2, MgO2 и др.):
Н2O2 + 2NaOH → Na2O2 + 2H2O
Пероксидная группа -O-O- входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.), которые можно рассматривать как соли пероксида водорода. Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидосерная H2S2O8 кислоты.
Высокий эх-потенциал для ОВР Н2О2 +2е=2ОН или Высокая реакционная способность свободных радикалов объясняется их стремлением достроить внешний электронный уровень до устойчивого октета. Алкильные радикалы - короткоживущие частицы. Их относительная устойчивость соответствует ряду: третичный > вторичный > первичный.
13.Расскажите о химических свойствах азота. Что Вы знаете о нитридах?
Дата добавления: 2016-06-13; просмотров: 1458;
