Распределение радионуклидов между двумя фазами
Ионы радионуклидов находятся в растворах в ультрамалых концентрациях. Поэтому с веществами, способными давать с данным радионуклидом малорастворимые соединения, произведения растворимости никогда не будут достигнуты и самостоятельная твердая фаза не сможет возникнуть. Однако если в растворе присутствуют ионы макроэлемента, сходного с радионуклидом по химическим свойствам, в концентрации, достаточной для осаждения, будет происходить процесс совместного осаждения макро- и микрокомпонента, или процесс соосаждения. Соосаждение с образованием кристаллических осадков, где микрокомпонент распределяется по всему объему кристаллов, называется сокристаллизацией. Процесс осаждения микрокомпонента на поверхности твердой фазы макрокомпонента (включая внутреннюю поверхность) называется адсорбцией.
Макроэлемент при соосаждении называется носителем. Если носителем является нерадиоактивный изотоп того же элемента, что и радионуклид, такой макрокомпонент называют изотопным носителем. Например, макроконцентрации 86Sr или природной смеси изотопов стронция будут изотопным носителем для радионуклида 90Sr. В том случае, когда происходит соосаждение радионуклида с другим элементом, близким ему по химическим свойствам, элемент называется неизотопным носителем. Примером может служить соосаждение 90Sr с Са или 226Ra с Ва. Сокристаллизация описывается законом Гана: «Микроколичества радиоактивного элемента кристаллизуются с макроэлементом, если оба образуют изоморфные или изодиморфные кристаллы с одинаковым противоионом». Уравнение, выражающее сокристаллизацию при термодинамическом равновесии, имеет вид
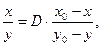
где х и у – количества микро- и макрокомпонентов в твердой фазе; х0 и у0 – начальные количества микро- и макрокомпонентов в растворе; D – коэффициент кристаллизации. Если D > 1, то радионуклид накапливается в кристаллах; если D <1, то радионуклид находится преимущественно в растворе; при D=1отношения микро- и макрокомпонентов в осадке и растворе равны.
Для термодинамически неустойчивых систем справедливо логарифмическое уравнение
 ,
,
где x – коэффициент кристаллизации. При логарифмическом распределении твердая фаза не гомогенна. Концентрация микрокомпонента плавно растет от центра к периферии при x < 1 и падает, если x > 1. В случае установления равновесия коэффициент кристаллизации X достигает своего максимального значения, равного D.
Изотопный обмен
Изотопным обменом называется перераспределение атомов изотопов данного элемента внутри молекулы, между различными молекулами или фазами, которое не ведет к другим изменениям качественного и количественного молекулярного состава системы.
На возможность протекания подобных реакций еще в 1886 г. указал Д.И.Менделеев:"В состоянии химической неизменности уже существует обмен между однородными атомами разнородных частиц... Если даны две частицы АВ и АВ1, то А из первой может переходить во вторую частицу и обратно". Наблюдение за процессом изотопного обмена стало возможным лишь с открытием радиоактивных изотопов.
Различают гомогенный и гетерогенный обмен. Первый протекает в одной фазе, второй связан с наличием нескольких фаз. Гомогенный обмен представляет собой химическую реакцию. По механизму он делится на обмен, протекающий посредством диссоциации, ассоциации, других физико-химических процессов и электронных переходов.
Гетерогенный обмен связан с движением вещества внутри фаз и через границы раздела фаз. Он может быть чисто физическим процессом обмена изотопными атомами или молекулами между фазами или протекать по механизму, аналогичному механизму гомогенного обмена. Гетерогенный обмен целесообразно разделить на два вида: обмен, протекающий при непосредственном контакте обменивающихся фаз, и обмен, протекающий при отсутствии непосредственного контакта обменивающихся фаз через промежуточное пространство - третью фазу.
Примером реакции гомогенного изотопного обмена может служить обмен атомами йода между йодистым алкилом и йодистым калием в спиртовом растворе:
R127I + K131I = R131I + K127I
Примером гетерогенного обмена является обмен серебром между металлическим серебром и его ионами в растворе:
110Ag + 107,109Ag(тв) = 107,109Ag + 110Ag(тв).
Изотопный обмен может быть простым и сложным. При простом обмене все атомы данного элемента вступают в обмен с одинаковой скоростью. В сложном обмене участвуют атомы данного элемента, находящиеся в различном энергетическом состоянии или положении в молекуле, в результате чего скорость обмена не одинакова для таких атомов.
Дата добавления: 2016-06-02; просмотров: 1170;
