Металлов с агрессивными средами
Нефтепроводы, резервуары, оборудование в процессе эксплуатации подвергаются процессу коррозии. Под коррозией (от позднелат. corrosio – разъединение) металла понимают процесс самопроизвольного окисления, приводящий к разрушению металла под воздействием окружающей среды. Коррозия металла труб происходит как снаружи под воздействием почвенного электролита (в почве всегда находится влага и растворенные в ней соли), так и внутри, вследствие примесей влаги, сероводорода и солей, содержащихся в транспортируемом газе. Коррозия металлических сооружений наносит большой материальный и экономический ущерб народному хозяйству. Она приводит к преждевременному износу агрегатов, установок, линейной части трубопроводов, сокращает межремонтные сроки оборудования, вызывает дополнительные потери транспортируемого продукта. Коррозия в зависимости от механизма реакций, протекающих на поверхности металла, подразделяются на химическую и электрохимическую (рис. 6.17).
         |
Химическая коррозия представляет собой процесс разрушения металла при взаимодействии с сухими газами (газовая коррозия) или жидкими неэлектролитами (коррозия в неэлектролитах) по законам химических реакций и не сопровождается возникновением электрического тока. Продукты коррозии в этом случае образуются непосредственно на всем участке контакта металла с агрессивной средой.
Кинетика химических реакций при окислении металлов выглядит следующим образом:
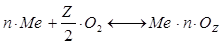 , (6.103)
, (6.103)
где n – число атомов металла в реакции; Z – валентность металла.
Электрохимическая коррозия является гетерогенной электрохимической реакцией. Она подразделяется на коррозию в электролитах, почвенную, электрокоррозию, атмосферную, биокоррозию, контактную. Во всех случаях окисление металлов происходит за счет возникновения электрического тока, протекают анодные и катодные процессы на различных участках поверхности и продукты коррозии образуются на анодных участках.
Существующие виды коррозии металлов представлены на рис. 6.17.
При электрохимической коррозии одновременно протекают два процесса – окислительный (аноидный), вызывающий растворение металла на одном участке, и восстановительный (катодный), связанный с выделением катиона из раствора, восстановлением кислорода и других окислителей на другом. В результате возникают микрогальванические элементы, и появляется электрический ток, обусловленный электронной проводимостью металла и ионной проводимостью раствора электролита. Анодные и катодные процессы локализуются на тех участках, где их протекание облегчено. Причины, вызывающие электрохимическую неоднородность поверхности, весьма многочисленны: макро- и микронеоднородности металла; фазовая и структурная неоднородность сплавов; неоднородность и несплошность поверхностных пленок; неоднородность деформаций и напряжений. Кроме того, неоднородны и жидкие фазы, контактирующие с поверхностью.
Энергетическая характеристика перехода ионов в раствор при взаимодействии металла с электролитом или обратно – электродный потенциал. При взаимодействии металла с водой происходит его растворение или разрушение, т.к. атомы кислорода и водорода воды образуют полярные молекулы с двумя полюсами («+» и «–»), что приводит к возникновению силового электрического поля в воде. Молекулы воды внедряются в кристаллическую решетку металла на его поверхности (происходит гидратация), и переходя в воду с образованием ион-атома несущего положительный заряд. При этом оставшиеся в металле электроны носят отрицательный заряд. Ион-атом окружается молекулами воды, происходит образование у поверхности металла двойного электрического слоя и возникает разность потенциалов между поверхностью металла и слоями раствора, прилегающими к нему. При насыщении слоя ион-атомами переход их с поверхности металла в раствор прекращается. В этом случае устанавливается равновесие между разностью потенциалов в слое и разностью между свободными энергиями ионов металла в металле и в растворе. Это состояние соответствует равновесному электродному потенциалу. Он зависит от свойств ионов, их концентрации в растворе. Электродный потенциал платинового электрода в растворе HC, содержащий ионы водорода, продуваемого через раствор, условно принимается равным нулю, и называется нормальным водородным электродом. Равновесные потенциалы различных электродов % в растворах собственных солей, в которых концентрация равна единице, измеренные относительно нормального водородного электрода, называется нормальными потенциалами. Они образуют нормальный электрохимический ряд напряжений, по которому можно определить какой из пары взятых металлов будет разрушаться (служить анодом), и степень опасности коррозийного процесса.
Согласно теории электрохимической коррозии разрушение металла обусловлено работой множества короткозамкнутых гальванических элементов, образующихся вследствие неоднородности среды и металла. При работе коррозийного элемента уменьшается разность начальных потенциалов, что сопровождается уменьшением коррозийного тока. Этот процесс называется поляризацией. Различают анодную и катодную поляризацию. При анодной поляризации в случае усиленного растворения металла ионы металла медленнее переходят в раствор, чем электроны отводятся в катодную область, и у поверхности электрода накапливаются положительные ионы металла, потенциал анода смещается в сторону положительных значений. Катодная поляризация сопровождается смещением потенциала электрода в отрицательную сторону и вызывается в основном малой скоростью электрохимической реакции соединения деполяризаторов с электронами. Участки, на которых растворяется металл, называются анодными, на них ион-атомы железа переходят в раствор, а на катодных – ток выводит в грунт. Электрохимические процессы на аноде и катоде различны, но взаимосвязаны, и, как правило, самостоятельно не протекают. Такая связанная система называется коррозионным микроэлементом. На анодных участках осуществляется окисление с образованием ионов металла Fe+2, а на катодных под влиянием кислорода образуется гидроокись (в результате кислородной деполяризации).
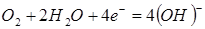 (6.104)
(6.104)
Ионы железа и гидроксила взаимодействуют и образуют нерастворимый осадок Fe(OH)2,который разлагается на окись железа и воду: 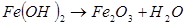 . Высвобождающиеся при окислении электроны от анодного участка по металлу изделия протекают к катоду и участвуют в реакции восстановления.
. Высвобождающиеся при окислении электроны от анодного участка по металлу изделия протекают к катоду и участвуют в реакции восстановления.
В некоторых случаях возможны сложные процессы коррозии при одновременном воздействии двух или более факторов. К ним относятся коррозия под напряжением, щелевая, коррозионная эрозия, коррозионная кавитация. Скорость коррозионных процессов зависит от многих факторов, связанных как со свойствами, составом и строением металлического материала, так и со свойствами среды и внешними воздействиями. Для стальных трубопроводов, уложенных в грунт, скорость разрушения зависит во многом от коррозионности грунта, в частности, от типа грунта, состава и концентрации веществ, содержания влаги, проникновения воздуха в грунт, структуры грунта, температуры и удельного сопротивления грунта, наличия в грунте бактерий, активизирующих коррозионные процессы. Оценивается коррозионная активность грунта по величине его удельного электросопротивления (чем меньше ρ, тем больше возможность коррозии). Важной характеристикой грунта является и водородный показатель pH среды (увеличение скорости коррозии при уменьшении pH).
На интенсивность коррозии оказывает влияние неоднородность металла, механические напряжения, температуры и т.д. Неоднородность металла приводит к появлению коррозионных микроэлементов (микропар) в местах соприкосновения с грунтом, или в месте изменения физических свойств грунта. Коррозия может произойти и при образовании макропары из-за наличия макровключений – окалины, царапины, вмятины, наклепа, поперечных, продольных сварных швов, макроструктурной неоднородности физико-химических свойств почв, (например, при неоднородном поступлении кислорода к поверхности трубопровода, расположенном под полотном дороги). Существенное влияние на скорость коррозии оказывает жизнедеятельность анаэробных бактерий, особенно в почвах, содержащих большое количество сульфатных солей. В этом случае происходит образование серной кислоты и усиление коррозионных процессов.
Дата добавления: 2016-04-19; просмотров: 3141;
