Некоторые молекулярные механизмы свёртывания крови.
Тема 2. МЕТАБОЛИЗМ ЭРИТРОЦИТА. СВЁРТЫВАНИЕ КРОВИ. КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ (КОС) И ЕГО РЕГУЛЯЦИЯ
Практическая значимость темы. Эритроциты составляют основную массу форменных элементов крови. Метаболизм эритроцита максимально приспособлен для выполнения главной функции этих клеток - транспорта кислорода к тканям. Врождённые дефекты гемоглобина, ферментов гликолиза и пентозофосфатного пути в эритроцитах приводят к нарушениям структуры и функции этих клеток, развитию гемолитической анемии.
Цель занятия. После изучения данной темы студент должен знать: особенности строения и функции молекулярных форм гемоглобина; пути обмена глюкозы в эритроцитах и их биологическую роль; молекулярные основы процессов общего пути свёртывания крови; основные механизмы поддержания КОС крови и лабораторные показатели, используемые для его оценки и их изменение при нарушениях КОС; уметь применять полученные знания при решении теоретических и практических задач.
Исходный уровень знаний.
- Строение и биологические функции аминокислот и белков.
- Кислотно-основные свойства биологических макромолекул.
- Строение и свойства ферментов, обусловленные их белковой природой.
- Механизмы регуляции активности ферментов.
- Механизмы транспорта веществ через биологические мембраны.
- Окислительно-восстановительные реакции и реакции с участием макроэргических соединений в биологических системах.
- Принципы диагностики врождённых дефектов ферментов.
Эритроциты.
Эритроциты - высокоспециализированные клетки, основной функцией которых является транспорт кислорода из лёгких в ткани. Продолжительность жизни эритроцитов составляет в среднем 120 суток; разрушение их происходит в клетках ретикуло-эндотелиальной системы. В отличие от большинства клеток организма, у эритроцита отсутствуют клеточное ядро, рибосомы и митохондрии.
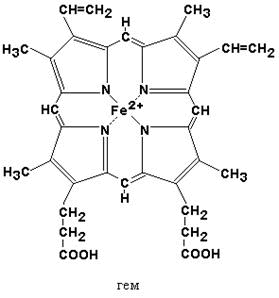
2.1.1. Гемоглобин. Важнейшим белком эритроцитов, выполняющим функцию переноса кислорода и углекислоты, является гемоглобин. Это сложный белок, хромопротеин, состоящий из четырёх полипептидных цепей (2 α и 2 β), каждая из которых в качестве простетической группы содержит гем.
Содержание гемоглобина в крови в норме - 140-160 г/л. Снижение содержания гемоглобина наблюдается при кровопотерях, недостатке в организме железа, витамина B12, фолиевой кислоты.
Гемоглобин - аллостерический белок, его сродство к кислороду может регулироваться. Повышение сродства гемоглобина к кислороду происходит при увеличении концентрации O2, снижении концентрации H+, CO2, 2,3-дифосфоглицерата. Понижение сродства гемоглобина к кислороду происходит при уменьшении концентрации О2, повышении концентрации Н+, СО2, 2,3-дифосфоглицерата.
Известны различные молекулярные формы гемоглобина. Так, в крови плода и новорождённого ребёнка присутствует гемоглобин f (фетальный), который отличается от гемоглобина А (взрослого человека) заменой β-цепей глобина на γ-цепи. Эта замена приводит к тому, что HbF менее эффективно связывает 2,3-дифосфоглицерат. Поэтому эритроциты плода обладают более высоким сродством к кислороду, чем эритроциты матери.
Гемоглобин S отличается от гемоглобина А аминокислотным составом β-цепей глобина (заменой глутаминовой кислоты на валин). При этом снижается растворимость дезоксиформы гемоглобина S в воде и сродство его к кислороду, снижается резистентность (устойчивость) эритроцитов к гемолизу, развивается серповидно-клеточная анемия.
Гликозилированный гемоглобин - продукт неферментативного взаимодействия гемоглобина с глюкозой. Отличается пониженной способностью отдавать кислород в тканях. Содержание гликозилированного гемоглобина повышается в крови при сахарном диабете. Этот показатель отражает уровень глюкозы в крови пациента на протяжении 2-3 предшествовавших месяцев. Поэтому определение гликозилированного гемоглобина в крови используют для контроля эффективности лечения больных диабетом.
От молекулярных форм гемоглобина следует отличать его производные,примером которого является метгемоглобин. Это производное гемоглобина содержит в составе гема трёхвалентное железо. Метгемоглобин образуется под действием окислителей и не способен транспортировать О2. Содержание метгемоглобина в крови возрастает также при дефиците фермента метгемоглобинредуктазы, в эритроцитах (см. 2.1.2). При накоплении метгемоглобина развивается кислородное голодание.
2.1.2. Особенности энергетического обмена в эритроцитах. Основным энергетическим субстратом эритроцита является глюкоза, которая поступает из плазмы крови путём облегчённой диффузии. Около 90% используемой эритроцитом глюкозы подвергается гликолизу (анаэробному окислению) с образованием конечного продукта - молочной кислоты (лактата). Запомните функции, которые выполняет гликолиз в зрелых эритроцитах:
1) в реакциях гликолиза образуется АТФпутём субстратного фосфорилирования. Основное направление использования АТФ в эритроцитах - обеспечение работы Na+,K+-АТФазы. Этот фермент осуществляет транспорт ионов Nа+ из эритроцитов в плазму крови, препятствует накоплению Na+ в эритроцитах и способствует сохранению геометрической формы этих клеток крови (двояковогнутый диск).
2) в реакции дегидрирования глицеральдегид-3-фосфата в гликолизе образуется НАДН. Этот кофермент является кофактором фермента метгемоглобинредуктазы, участвующей в восстановлении метгемоглобина в гемоглобин по следующей схеме:

Эта реакция препятствует накоплению метгемоглобина в эритроцитах.
3) метаболит гликолиза 1,3-дифосфоглицерат способен при участии фермента дифосфоглицератмутазы в присутствии 3-фосфоглицерата превращаться в 2,3-дифосфоглицерат:

2,3-Дифосфоглицерат принимает участие в регуляции сродства гемоглобина к кислороду (см. 2.1.1). Его содержание в эритроцитах повышается при гипоксии. Гидролиз 2,3-дифосфоглицерата катализирует фермент дифосфоглицератфосфатаза.
Приблизительно 10% глюкозы, потребляемой эритроцитом, используется в пентозофосфатном пути окисления. Реакции этого пути служат основным источником НАДФН для эритроцита. Данный кофермент необходим для перевода окисленного глутатиона (см. 2.1.3) в восстановленную форму. Дефицит ключевого фермента пентозофосфатного пути - глюкозо-6-фосфатдегидрогеназы - сопровождается уменьшением в эритроцитах отношения НАДФН/НАДФ+, увеличением содержания окисленной формы глутатиона и снижением резиcтентности клеток (гемолитическая анемия).
2.1.3. Механизмы обезвреживания активных форм кислорода в эритроцитах. Молекулярный кислород в определённых условиях может превращаться в активные формы, к которым относятся супероксидный анион О2-, пероксид водорода Н2О2, гидроксильный радикал ОН. и синглетный кислород 1О2. Эти формы кислорода обладают высокой реакционной способностью, могут оказывать повреждающее действие на белки и липиды биологических мембран, вызывать разрушение клеток. Чем выше содержание О2, тем больше образуется его активных форм. Поэтому эритроциты, постоянно взаимодействующие с кислородом, содержат эффективные антиоксидантные системы, способные обезвреживать активные метаболиты кислорода.
Важным компонентом антиоксидантных систем является трипептид глутатион, образующийся в эритроцитах в результате взаимодействия γ-глутамилцистеина и глицина:
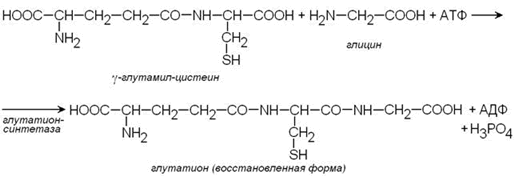
Восстановленная форма глутатиона (сокращённое обозначение Г-SH) участвует в реакциях обезвреживания пероксида водорода и органических пероксидов (R-O-OH). При этом образуются вода и окисленный глутатион (сокращённое обозначение Г-S-S-Г).

Превращение окисленного глутатиона в восстановленный катализирует фермент глутатионредуктаза. Источник водорода - НАДФН (из пентозофосфатного пути, см. 2.1.2):

В эритроцитах имеются также ферменты супероксиддисмутаза и каталаза, осуществляющие следующие превращения:

Антиоксидантные системы имеют для эритроцитов особое значение, так как в эритроцитах не происходит обновления белков путём синтеза.
Некоторые молекулярные механизмы свёртывания крови.
Свёртывание крови - совокупность молекулярных процессов, приводящих к прекращению кровотечения из повреждённого сосуда в результате образования кровяного сгустка (тромба). Общая схема процесса свёртывания крови представлена на рисунке 7.
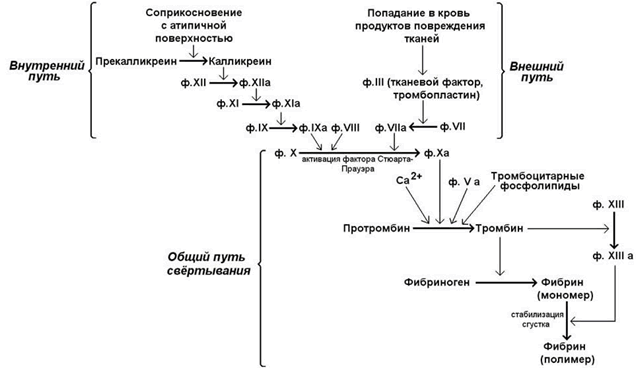
Рисунок 7.Общая схема свёртывания крови.
Большинство факторов свёртывания присутствует в крови в виде неактивных предшественников - проферментов, активация которых осуществляется путём частичного протеолиза. Ряд факторов свёртывания крови являются витамин К-зависимыми: протромбин (фактор II), проконвертин (фактор VII), факторы Кристмаса (IX) и Стюарта-Прауэра (Х). Роль витамина К определяется участием в карбоксилировании остатков глутамата в N-концевом участке этих белков с образованием γ-карбоксиглутамата.
Свёртывание крови представляет собой каскад реакций, в котором активированная форма одного фактора свёртывания катализирует активацию следующего до тех пор, пока конечный фактор, который является структурной основой тромба, не будет активирован.
Особенности каскадного механизма заключаются в следующем:
1) в отсутствие фактора, инициирующего процесс тромбообразования, реакция не может произойти. Поэтому процесс свёртывания крови будет ограничен только тем участком кровяного русла, где появляется такой инициатор;
2) факторы, действующие на начальных этапах свёртывания крови, требуются в очень малых количествах. На каждом звене каскада их эффект многократно усиливается (амплифицируется), что обеспечивает в итоге быструю ответную реакцию на повреждение.
В обычных условиях существуют внутренний и внешний пути свёртывания крови. Внутренний путь инициируется соприкосновением с атипичной поверхностью, что приводит к активации факторов, исходно присутствовавших в крови. Внешний путь свёртывания инициируется соединениями, в обычных условиях в крови не присутствующими, но поступающими туда в результате повреждения тканей. Для нормального протекания процесса свёртывания крови необходимы оба эти механизма; они различаются только на начальных этапах, а затем объединяются в общий путь, приводящий к образованию фибринового сгустка.
Далее рассматриваются только молекулярные механизмы общего пути свёртывания – активация протромбина и превращение фибриногена в фибрин-мономер и фибрин-полимер.
2.2.1. Механизм активации протромбина. Неактивный предшественник тромбина – протромбин – синтезируется в печени. В его синтезе участвует витамин К. Протромбин содержит остатки редкой аминокислоты – γ-карбоксиглутамата сокращённое обозначение – Gla). В процессе активации протромбина участвуют тромбоцитарные фосфолипиды, ионы Са2+ и факторы свёртывания Va и Хa. Механизм активации представляется следующим образом (рисунок 8).
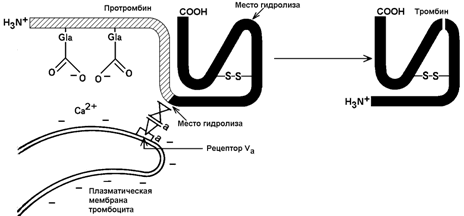
Рисунок 8. Схема активации протромбина на тромбоцитах (Р.Марри и соавт., 1993).
Повреждение кровеносного сосуда приводит к взаимодействию тромбоцитов крови с коллагеновыми волокнами сосудистой стенки. Это вызывает разрушение тромбоцитов и способствует выходу наружу отрицательно заряженных молекул фосфолипидов внутренней стороны плазматической мембраны тромбоцитов. Отрицательно заряженные группировки фосфолипидов связывают ионы Са2+. Ионы Са2+ в свою очередь взаимодействуют с остатками γ-карбоксиглутамата в молекуле протромбина. Эта молекула фиксируется на мембране тромбоцита в нужной ориентации.
Тромбоцитарная мембрана содержит также рецепторы для фактора Va. Этот фактор связывается с мембраной и присоединяет фактор Хa. Фактор Хa является протеазой; он расщепляет молекулу протромбина в определённых местах, в результате образуется активный тромбин.
2.2.2. Превращение фибриногена в фибрин. Фибриноген (фактор I) - растворимый гликопротеин плазмы с молекулярной массой около 340 000. Он синтезируется в печени. Молекула фибриногена состоит из шести полипептидных цепей: две А α-цепи, две В β-цепи, и две γ-цепи (см. рисунок 9). Концы полипептидных цепей фибриногена несут отрицательный заряд. Это обусловлено присутствием большого количества остатков глутамата и аспартата в N-концевых областях цепей Аa и Вb. Кроме того, В-области цепей Вb содержат остатки редкой аминокислоты тирозин-О-сульфата, также заряженные отрицательно:
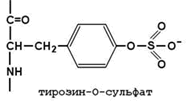
Это способствует растворимости белка в воде и препятствует агрегации его молекул.
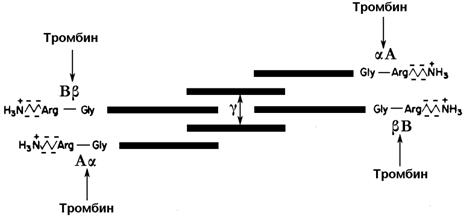
Рисунок 9.Схема строения фибриногена; стрелками показаны связи, гидролизуемые тромбином. Р.Марри и соавт., 1993).
Превращение фибриногена в фибрин катализирует тромбин (фактор IIa). Тромбин гидролизует четыре пептидные связи в фибриногене: две связи в цепях А α и две связи в цепях В β. От молекулы фибриногена отщепляются фибринопептиды А и В и образуется фибрин-мономер (его состав α2 β2 γ2). Мономеры фибрина нерастворимы в воде и легко ассоциируют друг с другом, образуя фибриновый сгусток.
Стабилизация фибринового сгустка происходит под действием фермента трансглутаминазы (фактор XIIIa). Этот фактор также активируется тромбином. Трансглутаминаза образует поперечные сшивки между мономерами фибрина при помощи ковалентных изопептидных связей.
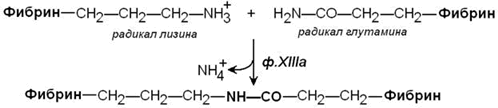
Образуется фибрин-полимер.
Дата добавления: 2016-04-14; просмотров: 1610;
