И молекулами-мишенями организма
| Вид связи | Пример | Энергия связи (кДж/мол) |
| Ионная | 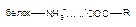
| |
| Ковалентная | 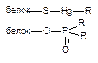
| 40 – 600 |
| Донорно-акцепторная | 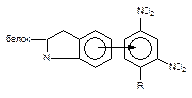
| 4 - 20 |
| Ион-дипольная | 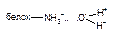
| 8 - 20 |
| Диполь-дипольная | 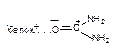
| 4 - 12 |
| Водородная | 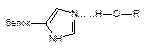
| 4 - 28 |
| Ван-дер-Ваальса | 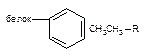
| 1 - 4 |
| Гидрофобная | 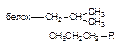
| 1 - 6 |
Как следует из приведенных данных, наиболее прочной является ковалентная связь между токсикантом и молекулой-мишенью. Именно этот тип взаимодействия, как правило, приводит к необратимому повреждению рецептора.
5.1.2. Взаимодействие токсикантов с белками
Основными функциями белков являются: транспортная, структурная, энзиматическая. Токсический эффект может развиваться при нарушении каждой из этих функций. Особое значение имеет ингибиторное действие токсикантов на энзимы.
Угнетение активности энзимов происходит различными путями, зависящими от строения токсиканта. Возможны:
- денатурация (изменение конформации) белковой части фермента;
- блокада активных центров ферментов;
- конкуренция с коэнзимом (его связывание, истощение запасов);
- взаимодействие с аллостерическим центром;
- взаимодействие с субстратом.
- связывание активаторов ферментативной активности;
К числу веществ, денатурирующих белки, относятся крепкие щелочи, кислоты, окислители, ионы тяжелых металлов. В основе денатурации лежит нарушение внутрибелковых связей, стабилизирующих вторичную, третичную, четвертичную структуру апофермента. Наиболее часто токсиканты взаимодействуют с СООН-, NH-, OH-, SH-группами белков. Многочисленные токсиканты, взаимодействующие с SH-группами, называются тиоловыми ядами (мышьяк, ртуть, люизит).
Целый ряд высокотоксичных соединений, структурно напоминая субстрат, способны взаимодействовать с активными “центрами” энзимов, угнетая их активность. К таким веществам относятся ингибиторы холинэстеразы (ФОС, карбаматы и т.д.), ингибиторы аконитазы (метаболиты фтор-, хлоруксусной кислоты). Многие токсиканты, взаимодействуя с простетической группой энзимов, блокируют их активность. Таким способом, например, сульфиды и цианиды ингибирует цитохромоксидазу, ряд других энзимов, простетической группой которых являются железо-содержащие порфириновые структуры.
Примерами токсикантов, взаимодействующих с субстратами с образованием продуктов, ингибирующих активность энзимов, являются гидразин (взаимодействие с пиридоксалем, образование пиридоксальгидразонов, ингибиторов пиридоксалькиназы), мышьяковистая кислота (взаимодействует с фосфоглицероальдегидом - продукт ингибирует гликолиз).
Известно, что целый ряд ферментов “работает” лишь в присутствии активаторов. К числу последних часто относятся ионы металлов: Mg, Mn, Co, Zn, Cu, Ca и т.д. Удаление указанных ионов из среды сопровождается существенным снижением активности ферментов. Представителями веществ, реализующих токсическое действие по этому механизму, являются хелатирующие агенты. Наиболее токсичные представители - производные гидроксиизохинолина и дитиокарбаматы. Дитиокарбаматы связывают ион Cu, активизирующего важнейший энзим метаболизма спиртов - альдегид-дегидрогеназу. Некоторые производные дитиокарбаматов, образующие комплексы с Mn, Co, используются в качестве фунгицидов.
Поскольку подавляющее большинство процессов, протекающих в организме, имеет ферментативную природу, угнетение активности ферментов - наиболее частая причина развития интоксикаций, имеющих самые разнообразные проявления.
5.1.3. Взаимодействие токсикантов с нуклеиновыми кислотами
Дезоксирибонуклеиновые кислоты - основной компонент хромосомного аппарата клеток. Рибонуклеиновые кислоты в клетках образуют три пула - информационной, транспортной, рибосомальной РНК. Их функция - участие в синтезе белка.
К числу веществ, вступающих в химическое взаимодействие с нуклеиновыми кислотами, относятся нитриты, сернистый, азотистый, кислородный иприты, этиленоксид, этиленимин, гидразин и его производные, гидроксиламин, нитрозамины, аренокисды, полициклические углеводороды, метаболиты афлатоксинов, соединения мышьяка, золота и многие другие вещества. Эти токсиканты, образуют ковалентные связи с аминогруппами пуриновых и пиримидиновых оснований и с углеводно-фосфатной основой молекулы нуклеиновых кислот. При этом происходит нарушение их свойств.
Многие ксенобиотики образуют нековалентные связи с ДНК. При этом меняется конформация макромолекул. Так, известно высокое сродство к нуклеиновым кислотам производных акридина, которые, встраиваясь в молекулу ДНК между соседними парами оснований (интеркалация), изменяют её структуру. Таков же, вероятно, механизм действия этидиумбромида, профлавина и др. Антрациклин, хлорахин, актиномицин и некоторые другие антибиотики также изменяют конформацию нуклеиновых кислот, не образуя с ними ковалентных связей.
Последствия повреждения ДНК и РНК зависят от дозы токсиканта и сопровождаются нарушениями процессов синтеза белка, клеточного деления и передачи наследственной информации.
Дата добавления: 2016-04-14; просмотров: 871;
