Методы разделения белков по электрическому заряду
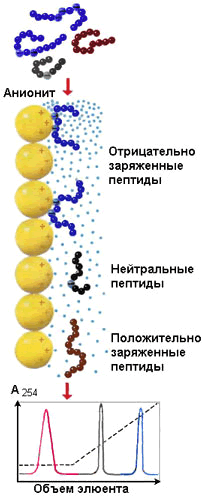 Рисунок 4.6. Разделение пептидов методом ионообменной хроматографии
Рисунок 4.6. Разделение пептидов методом ионообменной хроматографии
|
На различии белков по электрическому заряду основаны методы высаливания, ионообменной хроматографии, электрофореза, изоэлектрического фокусирования.
Высаливание – процесс осаждения белков из раствора при добавлении сульфата аммония, а также солей щелочных и щелочноземельных металлов. Чем больше величина заряда белка, тем более высокая концентрация соли требуется для его осаждения.
Ионообменная хроматография – метод, основанный на взаимодействии заряженных групп белка с ионными группами полимеров-ионообменников. При разделении смеси белков на анионите (например, диэтиламиноэтилцеллюлозе) в первую очередь элюируются положительно заряженные белки, затем – нейтральные и, наконец, отрицательно заряженные белки (рисунок 4.6). При разделении смеси белков на катионообменнике (например, карбоксиметилцеллюлозе) элюция происходит в обратном порядке.
Электрофорез – метод, основанный на различной скорости движения белков в электрическом поле на различных носителях (бумага, полиакриламидный и крахмальный гели и т.д.). Эта скорость зависит от величины заряда белка при данном значении рН.
Изоэлектрическое фокусирование – методика проведения электрофореза на колонке или в тонком слое с градиентом рН, создаваемом при помощи синтетических полиаминокарбоновых кислот – амфолинов. Каждый белок разделяемой смеси будет располагаться на колонке в участке со значением рН, соответствующем его изоэлектрической точке (см. 1.4.2).
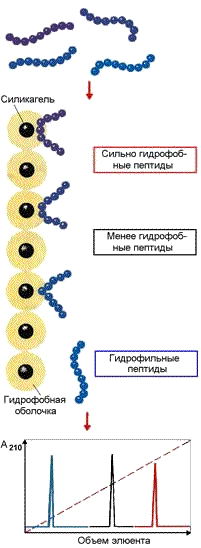 Рисунок 4.7. Разделение пептидов методом гидрофобной хроматографии
Рисунок 4.7. Разделение пептидов методом гидрофобной хроматографии
|
Дата добавления: 2016-04-14; просмотров: 2449;
