Методы исследования электрических свойств бислойных липидных мембран и липосом
структура мембран см 6.1
Явление электропорации основано на том, что мембраны обладают способностью концентрировать электрическое поле. Пусть между двумя плоскими параллельными электродами, находящимися на расстоянии L приложена разность потенциалов U и промежуток между ними заполнен слабо проводящим электролитом, тогда напряженность поля равномерно распределена по всему пространству между ними. А теперь поместим в центре ячейки бислойную липидную мембрану, которая обладает настолько высоким сопротивлением, что ее можно рассматривать как непроводящий диэлектрик. Тогда вся разность потенциалов U окажется сконцентрирована на мембране.
Коэффициент усиления электрического поля, очевидно, будет равен L/h ~ 10^6, если выбрать L ~ 1 см, h ~ 5 нм. Таким образом, в согласии с экспериментальными результатами, достаточно приложить к электродам разность потенциалов порядка сотен милливольт, чтобы вызвать электропорацию бислоя. Если теперь между электродами находятся клетки с диаметром порядка 10 микрон, и мы хотим вызвать их электропорацию, придется приложить значительно более высокие напряжения. Действительно, в силу высокого сопротивления мембраны, раствор в клетке будет эквипотенциальным, то есть внешнее поле будет экранировано подвижными ионами, которые образуют диффузные обкладки двойных электрических слоев. Таким образом, на клетке скачок напряжения составит 2UR/L, которое будет сконцентрировано на мембране в области двух полюсов клетки. Если принять, что надо иметь, скажем 0.5 В, то приложить к электродам надо будет U ~L/R*0.5 В. Тем самым, имея L ~ 1 см, R ~ 5∙10^-4 см, получим U ~ (1∙0.5)/(5∙10^(-4)) ~ 1 кВ. Поэтому в экспериментах с суспензиями клеток и липосом, приходится использовать специальные электропораторы, которые способны генерировать короткие импульсы амплитудой до 1-10 кВ.
При приложении к суспензии клеток импульсов электрического поля с напряженностью от нескольких сотен до нескольких тысяч вольт на см и длительностью от десятков микросекунд до десятков миллисекунд удается вызвать резкий рост проводимости клеточных мембран. После умеренной электрообработки проводимость клеток снижается до нормальных значений за времена от нескольких секунд до нескольких минут. Более интенсивная электрообработка приводит к необратимому разрушению части клеток.
В экспериментах с клетками сложно контролировать напряжение, прикладываемое непосредственно к клеточной мембране. Кроме того, клеточная мембрана является чрезвычайно сложной системой. Основные барьерные функции мембраны выполняются фосфолипидным бислоем, который пронизан белками, выполняющими роль селективных каналов или активных насосов для ионов и метаболитов. Возможными причинами роста электропроводности могли бы быть изменения как в липидном бислое, так и в белках.
Эксперименты c искусственной бислойной липидной мембраной (БЛМ) показали возможность ее электрического пробоя при напряжениях близких к тем, при которых пробой наблюдается в клеточной мембране. Было показано, что электрический пробой БЛМ определенного состава может быть обратимым. Это указывает на то, что именно пробой по липидной компоненте ответственен за повышение проницаемости клеток. Эксперименты с БЛМ показали, что электрический пробой возникает стохастично, и среднее время жизни мембраны нелинейно зависит от напряжения. Эти наблюдения привели к разработке теории образования и развития пор в жидких липидных бислоях в электрическом поле. В конце 1990х годов удалось с помощью высокоточных измерений проводимости мембран зарегистрировать появление одиночных электропор в БЛМ. Их средний диаметр составляет примерно 0.5 нм. В клеточных мембранах они были обнаружены с помощью электронной микроскопии.
Теория электропорации БЛМ предполагает, что в бислойной липидной мембране возникает локальная перестройка структуры, приводящая к появлению сквозного водного канала. Возможны две основных конфигурации поры — гидрофильная и гидрофобная. В гидрофобной поре стенки поры выстланы липидными «хвостами», а в гидрофильной поре — фосфолипидными головами. При малых радиусах энергетически выгодной является гидрофобная пора, при больших радиусах — гидрофильная пора. Вода обладает большей диэлектрической проницаемостью, чем липиды. Поэтому мембрана, содержащая поры, обладает меньшей энергией во внешнем электрическом поле. Этот выигрыш энергии пропорционален площади поры и квадратичен по ее радиусу. При радиусе поры r* энергии гидрофобной и гидрофильной пор становятся равными. На энергетической кривой существует локальный минимум, отвечающий метастабильному проводящему состоянию бислоя, из которого он, с определенной частотой переходит в начальное невозмущенное состояние с низкой проводимость системы, или претерпевает разрыв.
Предполагается, что скорость зарастания пор не зависит от приложенного электрического поля и от плотности пор на бислое. Данное предположение хорошо согласуется с экспериментально наблюдаемыми фактами.
Опыты фактически сводились к измерению электрического тока, переносимого малыми ионами через поры. Наряду с этим было установлено, что электрообработка способствует переносу через мембраны и макромолекул, размер которых превышает диаметр электропор. Более того, отмечалась корреляция между электропорацией и переносом крупных молекул. Эта загадка была решена в работах, когда на примере транспорта молекул ДНК было доказано, что они способны расширять поры, которые затем медленно (~ 100 сек.) релаксируют к исходному состоянию. Кроме того, прямыми опытами там же было показано, что электрофорез ДНК играет важнейшую роль не только на стадии переноса этих молекул к клетке, но и при прохождении через мембрану. Электрическое поле буквально вдавливает плазмидную ДНК в малую пору, при этом расширяя ее. Можно сказать, что сами молекулы плазмидной ДНК играют роль золотых микроскопических пуль, которые используются в методе «gene gun». Только движущие силы имеют разную природу — электрическую в первом случае, механическую во втором. Еще одно важное новшество состоит в применении 2х-импульсной методики электрообработки, которая позволила разделить во времени две функции поля — электропорационную и электрофоретическую. Первый импульс был мощным, но коротким; затем следовал интервал переменной длительности и, наконец, включалось слабое постоянное поле. Введение ДНК перед первым импульсом приводило к высокой трансфекции и переносу крупных молекул декстранов, тогда как введение ДНК во время межимпульсного интервала не давало практически никакого эффекта.
Больше я не нашла(
Просто по теме
Мультиламеллярные липосомы - при энергичном встряхивании образуют замкнутые сферические частицы. Этот процесс энергетически выгоден, так как в этом случае достигается минимум площади контакта гидрофобных поверхностей с водой. При простых механических воздействиях образуются в основном многослойные частицы (диаметром в несколько микрометров) с концентрической организацией слоев - мультиламеллярные липосомы или везикулы (мешочки). В этих частицах липидные бислои отделяют внутреннюю водную фазу от внешнего раствора. Такая организация по-зволяет использовать мультиламеллярные липосомы для исследования барьерных свойств липидного. Мультиламеллярные липосомы осмотически активны: они изменяются в объеме при изменении осмотических свойств внешней среды.
Моноламеллярные липосомы. Более энергичное воздействие на грубые фосфолипидные дисперсии, например с помощью ультразвукового излучения, вызывает образование моноламеллярных (однослойных) везикул. (d=20-40 нм). Моноламеллярные липосомы используют в исследованиях биологического и медико-биологического характера. Тем не менее, малый внутренний объем и осмотическая неактивность липосом существенно сужают круг этих исследований. В последнее время разработаны методики получения больших (100 нм в диаметре и более) моноламеллярных липосом, которые лишены этих недостатков.
Протеолипосомы. Многие мембранные белки и мелкие фрагменты биологических мембран сравнительно легко могут быть включены в состав искусственных везикулярных мембран. Такие комбинированные системы называются протеолипосомами. Эффективность встраивания большинства белков компонентов в искусственные мембранные системы резко зависит от липидного состава мембран, pH, солевого состава, температуры и т. д. Как правило, эффективность встраивания белков или липопротеиновых фрагментов мембраны возрастает в присутствии небольших количеств детергентов. Полагают, что мелкие молекулы детергентов заполняют дефекты на границе белковой молекулы в мембране, экранируя гидрофобные участки мембраны от воды.
Плоские бислоиные липидные мембраны. Липиды, спонтанно образующие ла-меллярные слои, обычно способны формировать бислоиные структуры (БЛМ или «черные» пленки) на небольших отверстиях в тонких гидрофобных материалах. Относительная простота получения БЛМ, широкий спектр применения разнообразных электроизмерительных методов исследования, возможность изменять в широких пределах липидный состав БЛМ и состав омывающих растворов, включать в БЛМ разнообразные модификаторы барьерных свойств мембран, функционально активные элементы биологических мембран - все это быстро обеспечило этим искусственным мембранным системам центральное место в современной экспериментальной мембранологии.
Общая схема ячейки для формирования БЛМ и несколько последовательных этапов формирования бислойной структуры:
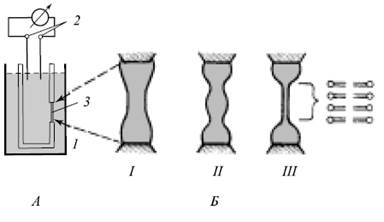
Образование БЛМ: А – ячейка для получения БЛМ и изучения ее электрических св-в
Б - этапы формирования БЛМ (Ш = БЛМ)
1 - тефлоновый стакан
2 - электроды
3 - отверстие в стенке стакана
Процесс образования БЛМ начинается с нанесения небольшого количества подходящего липида, растворенного обычно в жидких углеводородах (гексан, октан, декан), на отверстие в тефлоновом стаканчике. Далее эта толстая пленка самопроизвольно утоньшается вплоть до образования бислойной структуры. Главными силами, определяющими поведение пленки, являются межфазное (поверхностное) натяжение и ван-дер-ваальсовы силы притяжения водных фаз по обе стороны пленки, сжимающие пленку в поперечном направлении, - расклинивающее давление.
По своим электрическим характеристикам бислойные липидные пленки, приготовленные из природных липидов, близки к биологическим мембранам. Немодифицированные искусственные БЛМ отличаются низкой проводимостью. Они лишены метаболической активности и не обладают столь высокой селективностью, как биологические мембраны. Однако многие из этих свойств могут быть приданы искусственным мембранам путем введения в их состав разнообразных мембранноактивных соединений и отдельных функционально важных элементов биологических мембран. В присутствии всех этих модификаторов проводимость бислойных мембран обычно возрастает. Все это свидетельствует о том, что бислойная липидная структура выполняет роль естественной матрицы для многих молекулярных компонентов биологических мембран и что липидный бислой в той или иной мере свойственен природным мембранам.
Основные закономерности транспорта ионов через мембраны изучены в опытах с различными моделями, из которых самой близкой к биомембранам оказалась бислойная липидная мембрана.
Затраты энергии, необходимые для проникновения иона в неполярную фазу, можно оценить по формуле Борна:
Энергия заряда иона раиусом r в среде с диэлектрической проницаемостью эпсилон=z^2*e^2/ (8пи*r*эпсилон*эпсилон0), где эпсилон0-абсолютная диэлэлектрическая проницаемость вакуума, т е
энергия, затрачиваемая на перемещение иона из воды в мембрану, зависит от его радиуса r и диэлектрических проницаемостей воды ев и мембраны ем.
В системе СГС эта формула имеет наиболее простую и наглядную запись:
Энегрия заряда иона раиусом r в среде с диэлектрической проницаемостью эпсилон=z^2*e^2/(2r) (1/ эпсилонм - 1/ эпсилонB )
где z- валентность иона, е - элементарный заряд.
Рассчитанные по данному уравнению значения свободной энергии для перехода K + и K + из воды в неполярный растворитель с эпсилонм = 2 составляют большую величину (250 - 350 кДж/моль). Именно это создает барьер, препятствующий прохождению ионов щелочных металлов через гидрофобную часть липидного бислоя в негидратированной форме.
Энергия перехода иона в мембрану снижается с увеличением радиуса иона. Поэтому крупные органические ионы проникают через БЛМ легче, чем катионы щелочных металлов. Для таких крупных липофильных ионов, как дипикриламин и тетрафенилбор, возможно прямое прохождение через мембрану. При изменении градиента концентрации в случае одного проникающего иона разность электрических потенциалов на БЛМ изменяется в соответствии с уравнением Нернста. Этим методом было продемонстрировано пассивное движение проникающих ионов через мембраны митохондий, субмитохондриальных частиц, бактериальных хроматофоров при энергозависимой генерации мембранного потенциала.
Как видно из, величина энергетического барьера в мембране уменьшается, а следовательно, проницаемость мембраны для иона возрастает не только при увеличении его радиуса, но и при приближении значений эпсилонм к эпсилонв. На этих физических принципах и основан перенос ионов ионофорами. Ионофоры могут образовывать с ионом комплекс большого размера – переносчики - либо формировать пору в мембране, заполненную водой, - каналы. Это механизмы переноса - с участием переносчиков и через ионные каналы - изучены наиболее подробно в опытах с БЛМ.
| <== предыдущая лекция | | | следующая лекция ==> |
| Законы термодинамики | | | Фотосенсибилизаторы. Фотодинамическое действие |
Дата добавления: 2016-04-11; просмотров: 2336;
