Газообмен в легких и перенос газов кровью. 3 страница
На газообмен в тканях влияют не только градиенты напряжения дыхательных газов между кровью и интерстициальной жидкостью, но также площадь обменной поверхности, величина диффузионного расстояния и коэффициенты диффузии тех сред, через которые осуществляется перенос газов. Диффузионный путь газов тем короче, чем больше плотность капиллярной сети. В расчете на 1 мм3 суммарная поверхность капиллярного русла достигает, например, в скелетной мышце 60 м2, а в миокарде — 100 м2. Площадь диффузии определяет также количество эритроцитов, протекающих по капиллярам в единицу времени в зависимости от распределения крово-
360




 тока в микроциркуляторном русле. На выход О2 из крови в ткань влияет конвекция плазмы и интерстициальной жидкости, а также цитоплазмы в эритроцитах и клетках ткани. Диффундирующий в ткани О2 потребляется клетками в процессе тканевого дыхания, поэтому разность его напряжения между кровью, интерстициальной жидкостью и клетками существует постоянно, обеспечивая диффузию в этом направлении. При увеличении потребления тканью кислорода его напряжение в крови уменьшается, что облегчает диссоциацию оксигемоглобина.
тока в микроциркуляторном русле. На выход О2 из крови в ткань влияет конвекция плазмы и интерстициальной жидкости, а также цитоплазмы в эритроцитах и клетках ткани. Диффундирующий в ткани О2 потребляется клетками в процессе тканевого дыхания, поэтому разность его напряжения между кровью, интерстициальной жидкостью и клетками существует постоянно, обеспечивая диффузию в этом направлении. При увеличении потребления тканью кислорода его напряжение в крови уменьшается, что облегчает диссоциацию оксигемоглобина.
Количество кислорода, которое потребляют ткани, в процентах от общего содержания его в артериальной крови называется коэффициентом утилизации кислорода. В покое для всего организма коэффициент утилизации кислорода равен примерно 30-40%. Однако, при этом потребление кислорода в различных тканях существенно отличается, и коэффициент его утилизации, например, в миокарде, сером веществе мозга, печени, составляет 40-60%. В состоянии покоя серым веществом головного мозга (в частности, корой больших полушарий) потребляется в минуту от 0.08 до 0.1 мл О2 на 1 г ткани, а в белом веществе мозга — в 8-10 раз меньше. В корковом веществе почки среднее потребление О2 примерно в 20 раз больше, чем во внутренних участках мозгового вещества почки. При тяжелой физической нагрузке коэффициент утилизации О2 работающими скелетными мышцами и миокардом достигает 90%.
Кислород, поступающий в ткани, используется в клеточных окислительных процессах, которые протекают на субклеточном уровне с участием специфических ферментов, расположенных группами в строгой последовательности на внутренней стороне мембран митохондрий. Для нормального хода окислительных обменных процессов в клетках необходимо, чтобы напряжение О2 в области митохондрий было не меньше 0.1-1 мм рт.ст. (13.3-133.3 кПа). Эта величина называется критическим напряжением кислорода в митохондриях. Поскольку единственных резервом О2 в большинстве тканей служит его физически растворенная фракция, снижение поступления О2 из крови приводит к тому, что потребности тканей в О2 перестают удовлетворяться, развивается кислородное голодание и окислительные обменные процессы замедляются.
Единственной тканью, в которой имеется депо О2, является мышечная. Роль депо О2 в мышечной ткани играет пигмент миоглобин, близкий по строению к гемоглобину и способный обратимо связывать О2. Однако, содержание миоглобина в мышцах человека невелико, и поэтому количество запасенного О, не может обеспечить их нормальное функционирование в течение длительного промежутка времени. Сродство миоглобина к кислороду выше, чем у гемоглобина: уже при напряжении О, 3-4 мм рт.ст. 50% миоглобина переходит в оксимиоглобин, а при 40 мм рт.ст. миоглобин насыщен О2 до 95%. Во время сокращения мышцы, с одной стороны, увеличиваются потребности клеток в энергии и усиливаются окислительные процессы, с другой — резко ухудшаются условия доставки кислорода, поскольку при сокращении мышца сдавливает капилляры и
361


 доступ крови по ним может прекращаться. Во время сокращения расходуется О2, запасенный в миоглобине за время расслабления мышцы. Особое значение это имеет для постоянно активно работающей мышцы сердца, поскольку ее снабжение кислородом из крови носит периодический характер. Во время систолы в результате повышения интрамурального давления кровоток в бассейне левой коронарной артерии снижается и во внутренних слоях миокарда левого желудочка может на короткое время полностью прекратиться. Когда напряжение О2 в мышечных клетках падает ниже 10-15 мм рт.ст. (1.3-2.0 кПа), миоглобин начинает отдавать О,, запасенный в виде оксимиоглобина за время диастолы. Среднее содержание мио глобина в сердце составляет 4 мг/г. Поскольку 1 г миоглобина может связать примерно до 1.34 мл кислорода, в физиологических условиях запасы кислорода в миокарде составляют около 0.005 мл на 1 г ткани. Этого количества кислорода достаточного для того, чтобы в условиях полного прекращения его доставки кровью поддерживать в миокарде окислительные процессы лишь в течение 3-4 с. Однако, длительность систолы намного короче, поэтому миоглобин, выполняющий функцию кратковременного депо О2, предохраняет миокард от кислородного голодания.
доступ крови по ним может прекращаться. Во время сокращения расходуется О2, запасенный в миоглобине за время расслабления мышцы. Особое значение это имеет для постоянно активно работающей мышцы сердца, поскольку ее снабжение кислородом из крови носит периодический характер. Во время систолы в результате повышения интрамурального давления кровоток в бассейне левой коронарной артерии снижается и во внутренних слоях миокарда левого желудочка может на короткое время полностью прекратиться. Когда напряжение О2 в мышечных клетках падает ниже 10-15 мм рт.ст. (1.3-2.0 кПа), миоглобин начинает отдавать О,, запасенный в виде оксимиоглобина за время диастолы. Среднее содержание мио глобина в сердце составляет 4 мг/г. Поскольку 1 г миоглобина может связать примерно до 1.34 мл кислорода, в физиологических условиях запасы кислорода в миокарде составляют около 0.005 мл на 1 г ткани. Этого количества кислорода достаточного для того, чтобы в условиях полного прекращения его доставки кровью поддерживать в миокарде окислительные процессы лишь в течение 3-4 с. Однако, длительность систолы намного короче, поэтому миоглобин, выполняющий функцию кратковременного депо О2, предохраняет миокард от кислородного голодания.
Регуляция дыхания.
Физиологическая роль легочного дыхания состоит в обеспечении оптимального газового состава артериальной крови. Для нормальной интенсивности процессов тканевого дыхания необходимо, чтобы кровь, поступающая в тканевые капилляры, всегда была насыщена кислородом и не содержала СО, в количествах, препятствующих отдаче его из тканей. Поскольку при прохождении крови через капилляры легких между плазмой и альвеолярным воздухом устанавливается практически почти полное газовое равновесие, то оптимальное содержание газов в артериальной крови определяет соответствующий состав альвеолярного воздуха. Оптимальное содержание газов в альвеолярном воздухе достигается путем изменения объема легочной вентиляции в зависимости от условий, существующих в данный момент в организме.
Регуляция внешнего дыхания представляет собой физиологический процесс управления легочной вентиляцией, который направлен на достижение конечного приспособительного результата —обеспечение оптимального газового состава внутренней среды организма (крови, интерстициальной жидкости, ликвора) в постоянно меняющихся условиях его жизнедеятельности. Управление дыханием осуществляется по принципу обратной связи: при отклонении от оптимальных величин регулируемых параметров (рН, напряжение О, и СО,) изменение вентиляции направлено на их нормализацию. Избыток, например, водородных ионов во внутренней среде организма {ацидоз) приводит к усилению вентиляции, а их недостаток {алкалоз) — к уменьшению интенсивности дыхания. В обоих случаях изменение вентиляции является средством достижения главной цели регуляции
362


 дыхания — оптимизации газового состава внутренней среды (прежде всего, артериальной крови).
дыхания — оптимизации газового состава внутренней среды (прежде всего, артериальной крови).
Регуляция внешнего дыхания осуществляется путем рефлекторных реакций, возникающих в результате возбуждения специфических рецепторов, заложенных в легочной ткани и сосудистых рефлексогенных зонах. Центральный аппарат регуляции дыхания представляют нервные образования спинного мозга, продолговатого мозга и вышележащих отделов нервной системы. Основная функция управления дыханием осуществляется дыхательными нейронами ствола головного мозга, которые передают ритмические сигналы в спинной мозг к мотонейронам дыхательных мышц.
Дыхательный центр.Дыхательным центром называют совокупность взаимно связанных нейронов центральной нервной системы, обеспечивающих координированную ритмическую деятельность дыхательных мышц и постоянное приспособление внешнего дыхания к изменяющимся условиям внутри организма и в окружающей среде.
Еще в начале XIX века было показано, что в продолговатом мозге на дне IV желудочка в каудальной его части (в области так называемого писчего пера) расположены структуры, разрушение которых уколом иглы ведет к прекращению дыхания и гибели организма. Этот небольшой участок мозга в нижнем углу ромбовидной ямки, жизненно необходимый для поддержания ритмического дыхания, был назван "дыхательным центром". В дальнейшем было показано, что дыхательный центр расположен в медиальной части ретикулярной формации продолговатого мозга, в области obex, вблизи stria acusticae, и состоит из двух отделов: инспираторного ("центра вдоха") и экспираторного ("центра выдоха").
В ретикулярной формации продолговатого мозга обнаружены так называемые дыхательные нейроны, одни из которых разряжаются серией импульсов в фазу вдоха, другие — в фазу выдоха. В зависимости от того, каким образом активность дыхательных нейронов коррелирует с фазами дыхательного цикла, их называют инспира-торными или экспираторными. В продолговатом мозге не найдено строго обособленных областей, которые содержали бы только ин-спиратерные или только экспираторные дыхательные нейроны. Тем не менее, инспираторные и экспираторные нейроны рассматривают как две функционально различные популяции, внутри которых нейроны связаны между собой сетью аксонов и синапсов. Исследования активности одиночных нейронов ретикулярной формации продолговатого мозга привели к заключению, что область расположения дыхательного центра не может быть очерчена строго и однозначно. Так называемые дыхательные нейроны обнаружены почти на всем протяжении продолговатого мозга. Однако, в каждой половине продолговатого мозга есть участки ретикулярной формации, где дыхательные нейроны сгруппированы с более высокой плотностью.
Дорсальная группа дыхательных нейронов продолговатого мозга находится вентролатеральнее ядра одиночного пучка и состоит, главным образом, из инспираторных нейронов. Часть этих кле-
363

 ток дает нисходящие пути, идущие, в основном, в составе солитар-ного тракта и образующие у человека моносинаптические контакты с мотонейронами диафрагмального нерва в передних рогах 3-6 шейных сегментов спинного мозга. Нейроны диафрагмального ядра спинного мозга разряжаются или непрерывно (с учащением, в фазу вдоха) или залпами, подобно активности дыхательных нейронов продолговатого мозга. Движения диафрагмы, обеспечивающие от 70 до 90% дыхательного объема, связаны именно с нисходящими влияниями дорсальной группы инспираторных нейронов продолговатого мозга.
ток дает нисходящие пути, идущие, в основном, в составе солитар-ного тракта и образующие у человека моносинаптические контакты с мотонейронами диафрагмального нерва в передних рогах 3-6 шейных сегментов спинного мозга. Нейроны диафрагмального ядра спинного мозга разряжаются или непрерывно (с учащением, в фазу вдоха) или залпами, подобно активности дыхательных нейронов продолговатого мозга. Движения диафрагмы, обеспечивающие от 70 до 90% дыхательного объема, связаны именно с нисходящими влияниями дорсальной группы инспираторных нейронов продолговатого мозга.
Вентральная группа дыхательных нейронов расположена в области обоюдного и ретроамбигуального ядер. Нейроны этой группы посылают нисходящие волокна к мотонейронам межреберных и брюшных мышц. Инспираторные мотонейроны спинного мозга концентрируются, главным образом, во 2- 6, а экспираторные - в 8- 10 грудных сегментах. В вентральной группе нейронов продолговатого мозга находятся также эфферентные преганглионарные нейроны блуждающего нерва, обеспечивающие синхронные с фазами дыхания изменения просвета дыхательных путей. Максимум активности нейронов блуждающего нерва, вызывающей повышение тонуса гладких мышц воздухоносных путей, наблюдается в конце выдоха, а минимум — в конце вдоха.
В продолговатом мозге обнаружены дыхательные нейроны с различным характером ритмической активности. Только у части инспираторных и экспираторных нейронов начало разряда и длительность серии импульсов строго совпадают с периодом соответствующей фазы дыхательного цикла, Однако, при всем разнообразии видов возбуждения разных дыхательных нейронов продолговатого мозга у каждого из них характер ритмической активности остается, как правило, постоянным. На этом основании различают: а) "полные" инспираторные и экспираторные нейроны, ритмическое возбуждение которых по времени точно совпадает с соответствующей фазой дыхания; б) "ранние" инспираторные и экспираторные нейроны, дающие короткую серию импульсов до начала вдоха или выдоха; в) "поздние", проявляющие залповую активность уже после начала инспирации или экспирации: г) "инспираторно- экспираторные", начинающие возбуждаться в фазе вдоха и остающиеся активными в начале выдоха; я) "экспираторно-инспираторные", активность которых начинается во время вдоха и захватывает начало выдоха; е) "непрерывные", работающие без пауз, но с увеличением частоты импульсов во время вдоха или выдоха (рис.8.9).
Нейроны каждой разновидности не разбросаны по отдельности и нередко находятся друг от друга на расстояние не более 100 мкм. Полагают, что различные виды дыхательных нейронов образуют своеобразные микрокомплексы, которые служат теми очагами, где формируется автоматизм дыхательного центра. Типичным ритмообразующим комплексом является система из четырех нейронов ("ранних" и "поздних" инспираторных и экспираторных), объединенных возвратными связями и способных в совокупности генерировать залповую актив-
%4




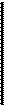

Рис.8.9. Активность различных групп дыхательный нейронов продолговатого мозга в связи с фазами дыхательного цикла.
I — вдох, II — выдох. Нейроны: 1 — полные; 2 — ранние; 3 — поздние инспираторные; 4,5,6 — аналогичные экспираторные; 7 — инспираторно-экспира-торные; 8 —экспираторно-инспи-раторные; 9,10 — нейроны, обладающие непрерывной активностью с усилением в различные фазы цикла.
ность. Каждый цикл начинается с активности "раннего" инспираторного нейрона. Затем возбуждение переходит последовательно на "поздний" инспираторный нейрон, "ранний" и "поздний" экспираторные нейро -ны и снова на "ранний" инспираторный. Благодаря наличию возвратных связей, нейрон каждой ритмообра-зующей группы, возбуждаясь, оказывает тормозное воздействие на два предшествующих ему в цикле нейрона. Так называемые "полные" инспираторные и экспираторные нейроны обеспечивают передачу возбуждения по нисходящим путям спинного мозга к мотонейронам, иннервирующим дыхательные мышцы.
После перерезки у экспериментальных животных ствола мозга ниже варолие-ва моста дыхательные движения сохраняются. Однако,- изолированный от нисходящих влияний дыхательный центр способен обеспечить лишь примитивное дыхание, при котором длительный выдох периодически прерывается короткими вдохами. Для стабильности и координации дыхательного ритма, обуславливающей дыхание с плавным характером перехода от вдоха к выдоху, необходимо, в первую очередь, участие нервных образований варолиева моста.
В передней части варолиева моста обнаружена область, названная пневмо-таксическим центром, раз-
365





 рушение которой приводит к удлинению фаз вдоха и выдоха, а электрическая стимуляция различных ее зон — к досрочному переключению фаз дыхания. При перерезке ствола мозга на границе между верхней и средней третью варолиева моста и одновременном пересечении обоих блуждающих нервов дыхание останавливается на фазе вдоха, лишь иногда прерываемой экспираторными движениями (так называемый апнейзис). На основании этого был сделан вывод, что дыхательный ритм возникает в результате периодического торможения тонической активности нейронов продолговатого мозга афферентной импульсацией, приходящей по блуждающему нерву и действующей через экспираторные нейроны, а после перерезки блуждающего нерва — вследствие ритмического торможения, поступающего из пневмотаксического центра варолиева моста.
рушение которой приводит к удлинению фаз вдоха и выдоха, а электрическая стимуляция различных ее зон — к досрочному переключению фаз дыхания. При перерезке ствола мозга на границе между верхней и средней третью варолиева моста и одновременном пересечении обоих блуждающих нервов дыхание останавливается на фазе вдоха, лишь иногда прерываемой экспираторными движениями (так называемый апнейзис). На основании этого был сделан вывод, что дыхательный ритм возникает в результате периодического торможения тонической активности нейронов продолговатого мозга афферентной импульсацией, приходящей по блуждающему нерву и действующей через экспираторные нейроны, а после перерезки блуждающего нерва — вследствие ритмического торможения, поступающего из пневмотаксического центра варолиева моста.
В ростральных отделах варолиева моста, в медиальном парабра-хиальном ядре, в участках мозговой ткани вентральнее его, а также в структурах, относящихся к управлению дополнительными дыхательными мышцами, т.е. в том месте, которое идентифицируют как пневмотаксический центр, найдено наибольшее количество дыхательных нейронов моста. В отличие от нейронов продолговатого мозга, стабильно сохраняющих характер залповой активности, в варолиевом мосту один и тот же дыхательный нейрон может изменить характер своей деятельности. Дыхательные нейроны варолиева моста организованы в группы, состоящие из 10-12 нейронов разного вида. Среди них много так называемых переходных (фазово-охватывающих) нейронов, проявляющих с максимумом частоты при смене фаз дыхательного цикла. Этим нейронам приписывают функцию связывания различных фаз дыхательного цикла, подготовки условий для прекращения фазы вдоха и перехода к выдоху. Пневмотаксический центр варолиева моста связан с дыхательным центром продолговатого мозга восходящими и нисходящими проводящими путями. К медиальному парабронхиальному ядру и ядру Келликера-Фузе из продолговатого мозга поступают аксоны нейронов одиночного пучка и ретроамбигуального ядра. Эти аксоны являются основным входом в пневмотаксического центра. Отличительной чертой активности дыхательных нейронов варолиева моста является то, что при нарушении связи с продолговатым мозгом они теряют залповый характер импульсации и модуляцию частоты импульсов в ритме дыхания.
Считается, что пневмотаксический центр получает импульсы от инспираторной части дыхательного центра продолговатого мозга и посылает импульсы обратно к дыхательному центру в продолговатый мозг, где они возбуждают экспираторные и тормозят инспираторные нейроны. Дыхательные нейроны варолиева моста первыми получают сведения о необходимости приспособления дыхания к изменяющимся условиям и соответствующим образом меняют активность нейронов дыхательного центра, а переходные нейроны обеспечивают плавную смену вдоха на выдох. Таким образом, благодаря совместной работе с пневмотаксическим комплексом, дыхательный центр продолговатого мозга может осуществлять ритмическую смену фаз ды-
366
 Функции дыхания
Функции дыхания
 хательного цикла с оптимальным соотношением длительности вдоха, выдоха и дыхательной паузы. Однако, для нормальной жизнедеятельности и поддержания адекватного потребностям организма дыхания необходимо участие не только варолиева моста, но и вышележащих отделов головного мозга.
хательного цикла с оптимальным соотношением длительности вдоха, выдоха и дыхательной паузы. Однако, для нормальной жизнедеятельности и поддержания адекватного потребностям организма дыхания необходимо участие не только варолиева моста, но и вышележащих отделов головного мозга.
Роль механорецепторов легких в регуляции дыхания.Источником информации дыхательного центра о состоянии легких и внеле-гочных бронхов и трахеи являются чувствительные нервные окончания, расположенные в гладких мышцах, в подслизистом слое и в эпителии воздухоносных путей. В зависимости от локализации, вида воспринимаемых раздражений и характера рефлекторных ответов на раздражение различают три типа рецепторов: 1) рецепторы растяжения легких; 2) ирритантные рецепторы; 3) J-рецепторы ("юкстака-пиллярные" рецепторы легких).
Рецепторы растяжения легких находятся, преимущественно, в гладких мышцах воздухоносных путей — в трахее и бронхах всех калибров. Таких рецепторов в каждом легком около 1000 и связаны они с дыхательным центром крупными миелинизированными афферентными волокнами блуждающего нерва с высокой скоростью проведения возбуждения (около 40 м/с). Непосредственным раздражителем этого типа механорецепторов является внутреннее напряжение в тканях стенок воздухоносных путей, которое определяется перепадом давления по обе стороны стенок и изменением их вязкоэлас-тических свойств в зависимости, например, от интенсивности брон-хомоторного тонуса. При умеренном растяжении легких во время вдоха частота импульсов от этих рецепторов линейно зависит от объема легких. Пороги раздражения отдельных механорецепторов существенно различаются. Часть из них имеет высокий порог и генерирует импульсы только при вдохах, когда объем легких увеличивается сверх функциональной остаточной емкости. Другие (низкопороговые) остаются активными и во время пассивного выдоха. Частота импульсов в афферентных волокнах от рецепторов растяжения особенно возрастает во время развития процесса вдоха. Если же достигнутый объем легких длительно удерживается на постоянном уровне, то активность рецепторов растяжения мало изменяется, следовательно, они обладают медленной адаптацией.
Раздувание легких вызывает рефлекторное торможение вдоха и переход к выдоху, а резкое уменьшение объема легких (путем, например, искусственного отсасывания воздуха через интубированный бронх одного легкого) приводит к активации вдоха. При перерезке блуждающих нервов эти реакции исчезают, и дыхание становится резко замедленным и глубоким. Указанные реакции, названные рефлексами Геринга- Брейера, легли в основу представления о рефлекторной саморегуляции дыхания. Суть ее заключается в том, что длительность фаз дыхательного цикла и частота дыхания определяются импульсацией, поступающей к дыхательному центру от механорецепторов легких по афферентным волокнам блуждающего нерва. Рецепторы растяжения обеспечивают обратную связь между легкими






 и дыхательным центром, сигнализируя об объеме легких и скорости его изменения. При достижении легкими определенного критического объема под воздействием импульсации от механорецепторов легких возбуждаются экспираторные нейроны дыхательного центра, активность инспираторных нейронов тормозится, поэтому вдох сменяется выдохом. Считается, что рефлексы с рецепторов растяжения легких играют основную роль в регуляции легочной вентиляции, именно от них зависит глубина и частота дыхания. Однако, показано, что у взрослого человека рефлексы Геринга- Брейера включаются, когда дыхательный объем превосходит 1 л (как, например, при физической нагрузке). Не исключено, что эти рефлексы могут иметь большое значение у новорожденных.
и дыхательным центром, сигнализируя об объеме легких и скорости его изменения. При достижении легкими определенного критического объема под воздействием импульсации от механорецепторов легких возбуждаются экспираторные нейроны дыхательного центра, активность инспираторных нейронов тормозится, поэтому вдох сменяется выдохом. Считается, что рефлексы с рецепторов растяжения легких играют основную роль в регуляции легочной вентиляции, именно от них зависит глубина и частота дыхания. Однако, показано, что у взрослого человека рефлексы Геринга- Брейера включаются, когда дыхательный объем превосходит 1 л (как, например, при физической нагрузке). Не исключено, что эти рефлексы могут иметь большое значение у новорожденных.
На всем протяжении трахеи и бронхов в эпителии и субэпителиальном слое расположены так называемые ирритантные рецепторы (другие названия: быстро адаптирующиеся механорецепторы воздухоносных путей, рецепторы слизистой оболочки трахеи и бронхов). Они реагируют на резкие изменения объема легких, а также при действии на слизистую трахеи и бронхов механических или химических раздражителей: пылевых частиц, накапливающейся в воздухоносных путях слизи, паров едких веществ (аммиака, эфира, табачного дыма). Чрезмерное спадение (пневмоторакс, коллапс, ателектаз) или растяжение легких приводит к изменению напряжения стенок внутрилегочных дыхательных путей и возбуждению ирри-тантных рецепторов. В отличие от легочных рецепторов растяжения ирритантные рецепторы обладают быстрой адаптацией. При попадании мельчайших инородных тел (пыль, частицы дыма) активация ирритантных рецепторов вызывает у человека кашлевой рефлекс, а также неприятные ощущения в груди типа першения и жжения. Возбуждения ирритантных рецепторов бронхов вызывает учащение дыхания, прежде всего, за счет укорочения выдохов, дыхание становится частым и поверхностным. Активация этих рецепторов вызывает также рефлекторную бронхоконстрикцию.
В интерстиции альвеол и дыхательных бронхов, вблизи от капилляров, располагаются J-рецепторы ("юкстакапиллярные" рецепторы легких). Раздражителем для этих рецепторов является повышение давления в малом круге кровообращения, а также увеличение объема интерстициальной жидкости в легких. Сильное и устойчивое во времени возбуждение J-рецепторов происходит при застое крови в малом круге кровообращения, отеке легких, эмболии мелких сосудов легких и других повреждениях легочной ткани, возникающих, например, при пневмониях. J-рецепторы чувствительны к ряду биологически активных веществ (никотину, простагландинам, гистами-ну), проникающих в интерстиции легких либо из воздухоносных путей, либо с кровью малого круга. Импульсы от этих рецепторов направляются к дыхательному центру по медленным немиелинизи-рованным волокнам блуждающего нерва, вызывая проявление частого поверхностного дыхания. При развитии левожелудочковой недостаточности кровообращения и интерстициальном отеке легких возбуждения J-рецепторов у человека вызывает ощущение одышки,
368


 т.е. ощущение затрудненного дыхания. В ответ на раздражение этих рецепторов, кроме учащенного дыхания (тахипное), происходит также рефлекторная бронхоконстрикция. Возбуждение J-рецепторов, вызванное увеличением кровенаполнения легких при чрезмерно тяжелой мышечной работе, может приводит к рефлекторному торможению активности скелетных мышц.
т.е. ощущение затрудненного дыхания. В ответ на раздражение этих рецепторов, кроме учащенного дыхания (тахипное), происходит также рефлекторная бронхоконстрикция. Возбуждение J-рецепторов, вызванное увеличением кровенаполнения легких при чрезмерно тяжелой мышечной работе, может приводит к рефлекторному торможению активности скелетных мышц.
В координации дыхательных движений участвуют рефлексы с про-приорецепторов дыхательных мышц. Межреберные мышцы и мышцы живота имеют специализированные рецепторы растяжения (мышечные веретена и сухожильные рецепторы Гольджи). В диафрагме такие рецепторы содержатся в небольшом количестве. Проприоре-цепторы дыхательной мускулатуры возбуждаются при увеличении длины и степени напряжения мышечных волокон. Импульсация от этих рецепторов распространяется преимущественно к спинальным центрам дыхательных мышц, а также к центрам головного мозга, контролирующим состояние скелетной мускулатуры. Межреберные и брюшные мышцы обладают рефлексами растяжения, которые находятся под контролем супрабульбарных структур головного мозга. Значение сегментарных проприорецептивных рефлексов дыхательных мышц заключается в автоматической регуляции силы сокращений в зависимости от исходной длины мышц и сопротивления, которое они встречают при сокращении. Благодаря этим особенностям межреберной мускулатуры, достигается соответствие механических параметров дыхания сопротивлению дыхательной системы, которое возрастает, например, при уменьшении растяжимости легких, сужении бронхов и голосовой щели, набухании слизистой оболочки носа. Во всех случаях сегментарные рефлексы на растяжение усиливают сокращение межреберных мышц и мышц передней брюшной стенки. У человека импульсация с пропри-орецепторов дыхательных мышц участвует в формировании ощущения, возникающих при нарушении дыхания.
Роль хеморецепторов в регуляции дыхания.Основное назначение регуляции внешнего дыхания заключается в поддержании оптимального газового состава артериальной крови — напряжения О2, напряжения СО2 и, тем самым, в значительной мере — концентрации водородных ионов. У человека относительное постоянство напряжения О2 и СО2 артериальной крови сохраняется даже при физической работе, когда потребление О2 и образование СО2 возрастает в несколько раз. Это возможно потому, что при работе вентиляция легких увеличивается пропорционально интенсивности метаболических процессов. Избыток СО2 и недостаток О2 во вдыхаемом воздухе также вызывает увеличение объемной скорости дыхания, благодаря чему парциальное давление О2 и СО2 в альвеолах и в артериальной крови почти не изменяется.
Дата добавления: 2016-03-27; просмотров: 1352;
