Системная гемодинамика
Основными параметрами, характеризующими системную гемодинамику, являются: системное артериальное давление, общее периферическое сопротивление сосудов, сердечный выброс, работа сердца, венозный возврат крови к сердцу, центральное венозное давление, объем циркулирующей крови.
Системное артериальное давление.Внутрисосудистое давление крови является одним из основных параметров, по которому судят о функционировании сердечно-сосудистой системы. Артериальное давление есть интегральная величина, составляющими и определяющими которую являются объемная скорость кровотока (Q) и сопротивление (R) сосудов. Поэтому системное артериальное давление (САД) является результирующей величиной сердечного выброса (СВ) и обшего периферического сопротивления сосудов (ОПСС):
САД = СВ ОПСС
Равным образом давление в крупных ветвях аорты (собственно артериальное) определяется как
АД = Q R
Применительно к артериальному давлению различают систолическое, диастолическое, среднее и пульсовое давления. Систолическое — определяется в период систолы левого желудочка сердца, диастолическое — в период его диастолы, разница между величиной систолического и диастолического давлений характеризует пульсовое давление, а в упрощенном варианте среднее арифметическое между ними — среднее давление (рис.7.2).
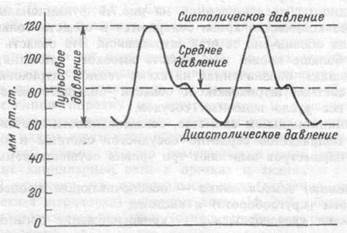
Рис.7.2. Систолическое, диастолическое, среднее и пульсовое давления в сосудах.
242
Величина внутрисосудистого давления при прочих равных условиях определяется расстоянием точки измерения от сердца. Различают, поэтому, аортальное давление, артериальное давление, артериоляр-ное, капиллярное, венозное (в мелких и крупных венах) и центральное венозное (в правом предсердии) давление.
В биологических и медицинских исследованиях общепринятым является измерение артериального давления в миллиметрах ртутного столба (мм рт.ст.), а венозного — в миллиметрах водного столба (мм вод.ст.).
Измерение давления в артериях производится с помощью прямых (кровавых) или косвенных (бескровных) методов. В первом случае, катетер или игла вводятся непосредственно в просвет сосуда, а регистрирующие установки могут быть различные (от ртутного манометра до совершенных электроманометров, отличающихся большой точностью измерения и разверсткой пульсовой кривой). Во втором случае, используются манжеточные способы сдавливания сосуда конечности (звуковой метод Короткова, пальпаторный — Рива-Роччи, осциллографический и др.).
У человека в покое наиболее усредненным из всех средних величин считается систолическое давление — 120-125 мм рт.ст., диа-столическое — 70-75 мм рт.ст. Эти величины зависят от пола, возраста, конституции человека, условий его работы, географического пояса проживания и т.д.
Являясь одним из важных интегральных показателей состояния системы кровообращения, уровень АД, однако, не позволяет судить о состоянии кровоснабжения органов и тканей или объемной скорости кровотока в сосудах. Выраженные перераспределительные сдвиги в системе кровообращения могут происходить при неизменном уровне АД благодаря тому, что изменения ОПСС могут компенсироваться противоположными сдвигами СВ, а сужение сосудов в одних регионах сопровождается их расширением в других. При этом одним из важнейших факторов, определяющих интенсивность кровоснабжения тканей, является величина просвета сосудов, количественно определяемая через их сопротивление кровотоку.
Общее периферическое сопротивление сосудов.Под этим термином понимают общее сопротивление всей сосудистой системы выбрасываемому сердцем потоку крови. Это соотношение описывается уравнением:
ОПСС = САД
СВ '
которое используется в физиологической и клинической практике для расчета величины этого параметра или его изменений. Как следует из этого уравнения, для расчета ОПСС необходимо определить величину системного артериального давления и сердечного выброса.
Прямых бескровных методов измерения общего периферического сопротивления пока не разработано, и его величина определяется из уравнения Пуазейля для гидродинамики:
243
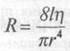
где R — гидравлическое сопротивление, / — длина сосуда, /; — вязкость крови, r — радиус сосудов.
Поскольку при исследовании сосудистой системы животного или человека радиус сосудов, их длина и вязкость крови остаются обычно неизвестными, Франк, используя формальную аналогию между гидравлической и электрической цепями, привел уравнение Пуазейля к следующему виду:
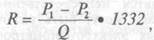
где P1-P2 — разность давлений в начале и в конце участка сосудистой системы, Q — величина кровотока через этот участок, 1332 — коэффициент перевода единиц сопротивления в систему CGS.
Уравнение Франка широко используется на практике для определения сопротивления сосудов, хотя оно во многих случаях не отражает истинных физиологических взаимоотношений между объемным кровотоком, АД и сопротивлением сосудов кровотоку у теплокровных. Другими словами, эти три параметра системы действительно связаны приведенным соотношением, но у разных объектов, в разных гемодинамических ситуациях и в разное время изменения этих параметров могут быть в разной мере взаимозависимыми. Так, в определенных условиях уровень САД может определяться преимущественно величиной ОПСС или СВ.
В обычных физиологических условиях ОПСС может составлять от 1200 до 1600 дин.с.см -5; при гипертонической болезни эта величина может возрастать в два раза против нормы и составлять от 2200 до 3000 дин.с.см"5
Величина ОПСС состоит из сумм (не арифметических) сопротивлений регионарных отделов. При этом в зависимости от большей или меньшей выраженности изменений регионарного сопротивления сосудов в них будет поступать меньший или больший объем крови, выбрасываемый сердцем. На рис.7.3 показана более выраженная степень повышения сопротивления сосудов бассейна нисходящей грудной аорты по сравнению с его изменениями в плече-головной артерии при прессорном рефлексе. В соответствии со степенью повышения сопротивления сосудов этих бассейнов прирост кровотока (по отношению к его исходной величине) в плече-головной артерии будет относительно больше, чем в грудной аорте. На этом механизме построен так называемый эффект "централизации" кровообращения, обеспечивающий в тяжелых или угрожающих организму условиях (шок, кровопотеря и др.) направление крови, прежде всего, к головному мозгу и миокарду.
В практической медицине нередко делаются попытки отождествлять уровень артериального давления (или его изменения) с вели-
244
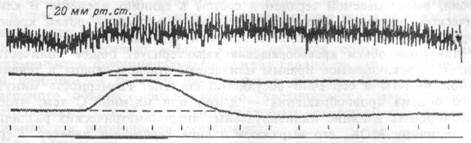
Рис.7.3. Более выраженная величина повышения сопротивления сосудов бассейна грудной аорты по сравнению с его изменениями в бассейне плече-головной артерии при прессорном рефлексе.
Сверху вниз: аортальное давление, перфузионное давление в пле-че-головной артерии, лерфузионное давление в грудной аорте, отметка времени (20 с), отметка стимуляции.
деленным термином "тонус" сосудов). Во-первых, это не следует из уравнения Франка, где показана роль в поддержании и изменении артериального давления и сердечного выброса (Q). Во-вторых, специальные исследования показали, что между изменениями АД и ОПСС не всегда имеет место прямая зависимость. Так, нарастание величин этих параметров при нейрогенных влияниях может идти параллельно, но затем ОПСС возвращается к исходному уровню, а артериальное давление оказывается еще повышенным (рис.7.4), что указывает на роль в его поддержании и сердечного выброса.
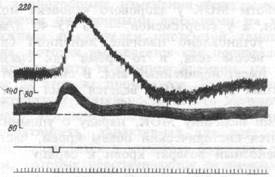
Рис.7.4. Повышение суммарного сопротивления сосудов большого круга кровообращения и аортального давления при прессорном рефлексе.
Сверху вниз: аортальное давление, перфузионное давление в сосудах большого круга (мм рт.ст.), отметка нанесения раздражения, отметка времени (5 с).
245
Сердечный выброс.Под сердечным выбросом понимают количество крови, выбрасываемой сердцем в сосуды в единицу времени. В клинической литературе используют понятия — минутный объем кровообращения (МОК) и систолический, или ударный, объем крови.
Минутный объем кровообращения характеризует общее количество крови, перекачиваемое правым или левым отделом сердца в течение одной минуты в сердечно-сосудистой системе. Размерность минутного объема кровообращения — л/мин или мл/мин. С тем, чтобы нивелировать влияние индивидуальных антропометрических различий на величину МОК, его выражают в виде сердечного индекса. Сердечный индекс — это величина минутного объема кровообращения, деленная на площадь поверхности тела в м2. Размерность сердечного индекса — л/(мин-м2).
В системе транспорта кислорода аппарат кровообращения является лимитирующим звеном, поэтому соотношение максимальной величины МОК, проявляющейся при максимально напряженной мышечной работе, с его значением в условиях основного обмена дает представление о функциональном резерве всей сердечно-сосудистой системы. Это же соотношение отражает и функциональный резерв самого сердца по его гемодинамической функции. Гемодинамичес-кий функциональный резерв сердца у здоровых людей составляет 300-400%. Это означает, что МОК покоя может быть увеличен в 3-4 раза. У физически тренированных лиц функциональный резерв выше — он достигает 500-700%.
Для условий физического покоя и горизонтального положения тела испытуемого нормальные величины МОК соответствуют диапазону 4-6 л/мин (чаще приводятся величины 5-5.5 л/мин). Средние величины сердечного индекса колеблются от 2 до 4 л/(мин.м2) — чаще приводятся величины порядка 3-3.5 л/(мин*м2).
Поскольку объем крови у человека составляет только 5-6 л, полный кругооборот всего объема крови происходит примерно за 1 мин. В период тяжелой работы МОК у здорового человека может увеличиться до 25-30 л/мин, а у спортсменов — до 35-40 л/мин.
Для крупных животных установлено наличие линейной связи между величиной МОК и весом тела, в то время как связь с площадью поверхности тела имеет нелинейный вид. В связи с этим, при исследованиях у животных расчет МОК ведется в мл на 1 кг веса.
Факторами, определяющими величину МОК, наряду с упоминавшимся выше ОПСС, являются систолический объем крови, частота сердечных сокращений и венозный возврат крови к сердцу.
Систолическийобъем крови.Объем крови, нагнетаемый каждым желудочком в магистральный сосуд (аорту или легочную артерию) при одном сокращении сердца, обозначают как систолический, или ударный, объем крови.
В покое объем крови, выбрасываемый из желудочка, составляет в норме от трети до половины общего количества крови, содержащейся в этой камере сердца к концу диастолы. Оставшийся в серд-
246
ue после систолы резервный объем крови является своеобразным депо, обеспечивающим увеличение сердечного выброса при ситуациях, в которых требуется быстрая интенсификация гемодинамики (например, при физической нагрузке, эмоциональном стрессе и др.).
Величина резервного объема крови является одним из главных детерминантов функционального резерва сердца по его специфической функции — перемещению крови в системе. При увеличении резервного объема, соответственно, увеличивается максимальный систолический объем, который может быть выброшен из сердца в условиях его интенсивной деятельности.
При адаптационных реакциях аппарата кровообращения изменения систолического объема достигаются с помощью механизмов саморегуляции под влиянием экстракардиальных нервных механизмов. Регуляторные влияния реализуются в изменения систолического объема путем воздействия на сократительную силу миокарда. При уменьшении мощности сердечного сокращения систолический объем падает.
У человека при горизонтальном положении тела в условиях покоя систолический объем составляет от 70 до 100 мл.
Частота сердечных сокращений (пульса) в покое составляет от 60 до 80 ударов в минуту. Влияния, вызывающие изменения частоты сердечных сокращений, называются хронотропными, вызывающие изменения силы сокращений сердца — инотропными.
Повышение частоты сердечных сокращений является важным адаптационным механизмом увеличения МОК, осуществляющим быстрое приспособление его величины к требованиям организма. При некоторых экстремальных воздействиях на организм сердечный ритм может повышаться в 3-3.5 раза по отношению к исходному. Изменения сердечного ритма осуществляются, главным образом, благодаря хронотропному влиянию на синоатриальный узел сердца симпатических и блуждающих нервов, причем, в естественных условиях хронотропные изменения деятельности сердца обычно сопровождаются инотропными влияниями на миокард.
Важным показателем системной гемодинамики является работа сердца, которая вычисляется как произведение массы крови, выброшенной в аорту за единицу времени, на среднее артериальное давление за этот же промежуток. Рассчитанная, таким образом, работа характеризует деятельность левого желудочка. Считается, что работа правого желудочка составляет 25% от этой величины.
Сократимость, характерная для всех разновидностей мышечной ткани, реализуется в миокарде благодаря трем специфическим свойствам, которые обеспечиваются различными клеточными элементами сердечной мышцы. Этими свойствами являются: автоматизм — способность клеток водителей ритма генерировать импульсы без каких-либо внешних воздействий; проводимость — способность элементов проводящей системы к электротонической передаче возбуждения; возбудимость — способность кардиомиоцитов возбуждаться в естественных условиях под влиянием импульсов, передаваемых по волокнам Пуркине. Важной особенностью возбудимости сердечной
247
мышцы является также длительный рефрактерный период, гарантирующий ритмический характер сокращений.
Автоматизм и проводимость миокарда.Способность сердца сокращаться в течение всей жизни, не обнаруживая признаков утомления, т.е. автоматизм сердца, связывали вначале с влияниями нервной системы. Однако, постепенно накапливались факты в пользу того, что нейрогенная гипотеза автоматизма сердца, справедливая в отношении многих беспозвоночных животных, не объясняет свойств миокарда у позвоночных. Особенности сокращения сердечной мышцы у последних связывали с функциями атипической ткани миокарда. В 50-х годах XIXвека в опытах Станниуса было показано, что перевязка сердца лягушки на границе между венозным синусом и предсердиями приводит к временной остановке сокращений остальных отделов сердца. Через 30-40 минут сокращения восстанавливаются, однако ритм сокращений области венозного синуса и остальных отделов сердца становится рассогласованным. После наложения второй лигатуры по ат-риовентикулярной линии прекращается сокращение желудочков с последующим его восстановлением в ритме, не совпадающим, однако, с ритмом сокращений предсердий. Наложение третьей лигатуры в области нижней трети сердца приводит к необратимой остановке сокращений сердца. В дальнейшем было показано, что охлаждение сравнительно небольшого участка в области устья полых вен приводит к остановке сердца. Результаты этих опытов указывали на то, что в области правого предсердия, а также на границе предсердий и желудочков располагаются участки, ответственные за возбуждение сердечной мышцы. Удалось показать, что сердце человека, извлеченное из трупа и помещенное в теплый физиологический раствор, в результате массажа восстанавливает сократительную активность. Доказано, что автоматизм сердца имеет миогенную природу и обусловлен спонтанной активностью части клеток его атипической ткани. Указанные клетки образуют скопления в определенных участках миокарда. Наиболее важным в функциональном отношении из них является синусный или синоатриальный узел, расположенный между местом впадения верхней полой вены и ушком правого предсердия.
В нижней части межпредсердной перегородки, непосредственно над местом прикрепления септальной створки трехстворчатого клапана, располагается атриовентрикулярный узел. От него отходит пучок атипических мышечных волокон, который пронизывает фиброзную перегородку между предсердиями и переходит в узкий длинный мышечный тяж, заключенный в межжелудочковую перегородку. Он называется атриовентрикулярным пучком или пучком Гиса. Пучок Гиса разветвляется, образуя две ножки, от которых приблизительно на уровне середины перегородки отходят волокна Пуркине, также образованные атипической тканью и формирующие субэндо-кардиальную сеть в стенках обоих желудочков (рис.7.5).
Функция проводимости в сердце имеет электротоническую природу. Она обеспечивается низким электрическим сопротивлением ще-левидных контактов (нексусов) между элементами атипического и
248
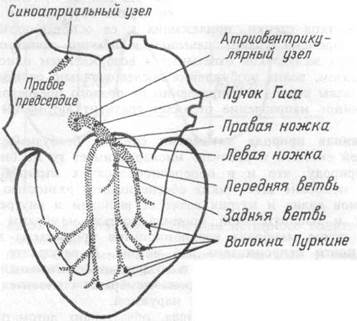
Рис.7.5. Проводящая система сердца.
рабочего миокарда, а также в области вставочных пластинок, разделяющих кардиомиоциты. В результате, сверхпороговое раздражение любого участка вызывает генерализованное возбуждение всего миокарда. Это позволяет считать ткань сердечной мышцы, морфологически разделенную на отдельные клетки, функциональным синцитием. Возбуждение миокарда зарождается в синоатриальном узле, который называют водителем ритма, или пейсмекером первого порядка, и далее распространяется на мускулатуру предсердий с последующим возбуждением атриовентрикулярного узла, который является водителем ритма второго порядка. Скорость распространения возбуждения в предсердиях составляет в среднем 1 м/с. При переходе возбуждения на атриовентрикулярный узел имеет место так называемая атриовентрикулярная задержка, составляющая 0.04-0.06 с. Природа атриовентрикулярной задержки состоит в том, что проводящие ткани синоатриального и атриовентрикулярного узлов контактируют не непосредственно, а через волокна рабочего миокарда, для которых характерна более низкая скорость проведения возбуждения. Последнее распространяется далее по ножкам пучка Гиса и волокнам Пуркине, передаваясь на мускулатуру желудочков, которую оно охватывает со скоростью 0.75-4.0 м/с. В силу особенностей расположения волокон Пуркине, возбуждение сосочковых мышц происходит несколько раньше, чем оно охватывает стенки желудочков. Благодаря этому, нити, удерживающие трехстворчатый и митральный клапаны, оказываются натянутыми раньше, чем на них начинает дей-
249
ствовать сила сокращения желудочков. По той же причине наружная часть стенки желудочков у верхушки сердца возбуждается несколько раньше участков стенки, прилежащих к ее основанию. Указанные сдвиги во времени крайне невелики и обычно принимается, что весь миокард желудочков охватывается возбуждением одновременно. Таким образом, волна возбуждения последовательно охватывает различные отделы сердца в направлении от правого предсердия к верхушке. Данное направление отражает градиент автоматии сердца.
Мембранная природа автоматии сердца.Возбудимость клеток проводящей системы и рабочего миокарда имеет ту же биоэлектрическую тгрироду, что и в поперечнополосатых мышцах. Наличие заряда на мембране здесь также обеспечивается разностью концентраций ионов калия и натрия возле ее внешней и внутренней поверхности и избирательной проницаемостью мембраны для этих ионов. В покое мембрана кардиомиоцитов проницаема для ионов калия и почти непроницаема для натрия. В результате диффузии ионы калия выходят из клетки и создают положительный заряд на ее поверхности. Внутренняя сторона мембраны становится электроотрицательной по отношению к наружной.
В клетках атипического миокарда, обладающих автоматией, мембранный потенциал способен спонтанно уменьшаться до критического уровня, что приводит к генерации потенциала действия. В норме ритм сердечных сокращений задается всего несколькими наиболее возбудимыми клетками синоатриального узла, которые называются истинными водителями ритма или пейсмекерными клетками. В этих клетках во время диастолы мембранный потенциал, достигнув максимального значения, соответствующего величине потенциала покоя (60-70 мВ), начинает постепенно снижаться. Этот процесс называется медленной спонтанной диастолической деполяризацией. Она продолжается до того момента, когда мембранный потенциал достигает критического уровня (40-50 мВ), после чего возникает потенциал действия.
Для потенциала действия пейсмекерных клеток синоатриального узла характерны малая крутизна подъема, отсутствие фазы ранней быстрой реполяризации, а также слабая выраженность "овершута" и фазы "плато". Медленная реполяризация плавно сменяется быстрой. Во время этой фазы мембранный потенциал достигает максимальной величины, после чего вновь возникает фаза медленной спонтанной деполяризации (рис.7.6).
Частота возбуждения пейсмекерных клеток у человека составляет в покое 70- 80 в минуту при амплитуде потенциала действия 70- 80 мВ. Во всех остальных клетках проводящей системы потенциал действия в норме возникает под влиянием возбуждения, приходящего из синоатриального узла. Такие клетки называют латентными водителями ритма. Потенциал действия в них возникает раньше, чем их собственная медленная спонтанная диастолическая деполяризация достигает критического уровня. Латентные водители ритма принимают на себя ведущую функцию только при условии разобщения с синоатриальным узлом. Именно этот эффект наблюдается в упоминавшихся выше
250
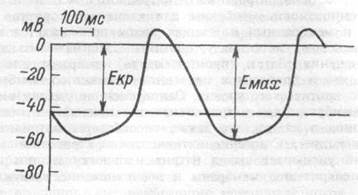
Рис.7.6.Развитие потенциала действия истинного водителя ритма автоматии.
Во время диастолы спонтанная деполяризация уменьшает мембранный потенциал (Е мах) до критического уровня (Е кр) и вызывает потенциал действия.
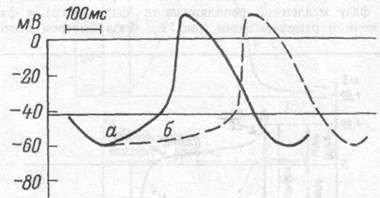
Рис.7.7.Развитие потенциала действия истинного (а) и латентного (б) водителей ритма автоматии.
Скорость медленной диастолической деполяризации истинного водителя ритма (а) больше, чем у латентного (б).
опытах Станниуса. Частота спонтанной деполяризации таких клеток у человека составляет 30-40 в минуту (рис.7.7).
Спонтанная медленная диастолическая деполяризация обусловлена совокупностью ионных процессов, связанных с функциями плазматических мембран. Среди них ведущую роль играют медленное уменьшение калиевой и повышение натриевой и кальциевой проводимости мембраны во время диастолы, параллельно чему происходит
251
падение активности электрогенного натриевого насоса. К началу диастолы проницаемость мембраны для калия на короткое время повышается, и мембранный потенциал покоя приближается к равновесному калиевому потенциалу, достигая максимального диасто-лического значения. Затем, проницаемость мембраны для калия уменьшается, что и приводит к медленному снижению мембранного потенциала до критического уровня. Одновременное увеличение проницаемости мембраны для натрия икальция приводит к поступлению этих ионов в клетку, что также способствует возникновению потенциала действия. Снижение активности электрогенного насоса дополнительно уменьшает выход натрия из клетки и, тем самым, облегчает деполяризацию мембраны и возникновение возбуждения.
Возбудимость сердечной мышцы.Клетки миокарда обладают возбудимостью, но им не присуща автоматия. В период диастолы мембранный потенциал покоя этих клеток стабилен, и его величина выше, чем в клетках водителей ритма (80-90 мВ). Потенциал действия в этих клетках возникает под влиянием возбуждения клеток водителей ритма, которое достигает кардиомиоцитов, вызывая деполяризацию их мембран.
Потенциал действия клеток рабочего миокардасостоит из фазы быстрой деполяризации, начальной быстрой реполяризации, переходящей в фазу медленной реполяризации (фаза плато) и фазы быстрой конечной реполяризации (рис.7.8). Фаза быстрой деполяриза-
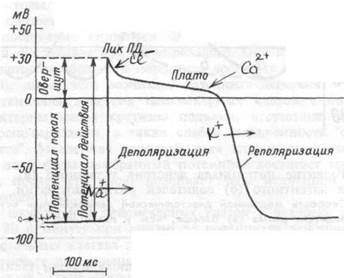
Рис.7.8. Потенциал действия клетки рабочего миокарда.
Быстрое развитие деполяризации и продолжительная реполяризэ-ция. Замедленная реполяризация (плато) переходит в быструю реполяризацию.
252
ции создается резким повышением проницаемости мембраны для ионов натрия, что приводит к возникновению быстрого входящего натриевого тока. Последний, однако, при достижении мембранного потенциала 30-40 мВ, инактивируется и в последующем, вплоть до инверсии потенциала (около +30 мВ) и в фазу "плато", ведущее значение имеют кальциевые ионные токи. Деполяризация мембраны вызывает активацию кальциевых каналов, в результате чего возникает дополнительный деполяризующий входящий кальциевый ток.
Конечная реполяризация в клетках миокарда обусловлена постепенным уменьшением проницаемости мембраны для кальция и повышением проницаемости для калия. В результате входящий ток кальция уменьшается, а выходящий ток калия возрастает, что обеспечивает быстрое восстановление мембранного потенциала покоя. Длительность потенциала действия кардиомиоцитов составляет 300-400 мс, что соответствует длительности сокращения миокарда (рис.7.9).
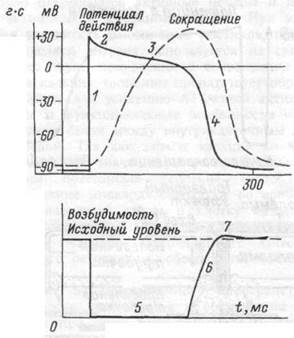
Рис.7.9. Сопоставление потенциала действия и сокращение миокарда с фазами изменения возбудимости при возбуждении.
1 — фаза деполяризации; 2 — фаза начальной быстрой реполя-ризации; 3 — фаза медленной реполяризации (фаза плато); 4 — фаха конечной быстрой репопяризации; 5 — фаза абсолютной рефрактерности; 6 — фаза относительной рефрактерности; 7 — фаза супернормальной возбудимости. Рефрактерность миокарда практически совпадает не только с возбуждением, но и с периодом сокращения.
253
Сопряжение возбуждения и сокращения миокарда.Инициатором сокращения миокарда, как и в скелетной мышце, является потенциал действия, распространяющийся вдоль поверхностной мембраны кардиомиоцита. Поверхностная мембрана волокон миокарда образует впячивания, так называемые поперечные трубочки (Т- система), к которым примыкают продольные трубочки (цистерны) саркоплазма-тического ретикулюма, являющиеся внутриклеточным резервуаром кальция (рис.7.10). Саркоплазматический ретикулюм в миокарде выражен в меньшей степени, чем в скелетной мышце. Нередко к поперечной Т- трубочке примыкают не две продольные трубочки, а одна (система диад, а не триад, как в скелетной мышце). Считается, что потенциал действия распространяется с поверхностной мембраны кардиомиоцита вдоль Т-трубочки в глубь волокна и вызывает деполяризацию цистерны саркоплазматического ретикулюма, что приводит к освобождению из цистерны ионов кальция.
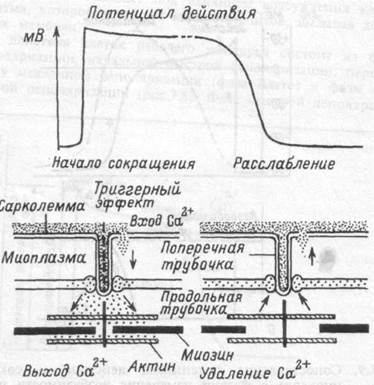
Рис.7.10. Схема соотношений между возбуждением, током Са2+ и активацией сократительного аппарата. Начало сокращения связано с выходом Са2+ из продольных трубочек при деполяризации мембраны. Са2+, входящий через мембраны кардиомиоцита в фазу плато потенциала действия, пополняет запасы Са2+ в продольных трубочках.
254
 Следующим этапом электромеханического сопряжения является перемещение ионов кальция к сократительным протофибриллам. Сократительная система сердца представлена сократительными белками — актином и миозином, и модуляторными белками — тропо-миозином и тропонином. Молекулы миозина формируют толстые нити саркомера, молекулы актина — тонкие нити. В состоянии диастолы тонкие актиновые нити входят своими концами в промежутки между толстыми и более короткими миозиновыми нитями. На толстых нитях миозина располагаются поперечные мостики, содержащие АТФ, а на нитях актина — модуляторные белки — тро-помиозин и тропонин. Эти белки образуют единый комплекс, блокирующий активные центры актина, предназначенные для связывания миозина и стимуляции его АТФазной активности. Сокращение волокон миокарда начинается с того момента, когда тропонин связывает вышедший из саркоплазматического ретикулюма в межфибриллярное пространство кальций. Связывание кальция вызывает изменения конформации тропонин-тропомиозинового комплекса. В результате этого открываются активные центры и происходит взаимодействие актиновых и миозиновых нитей. При этом стимулируется АТФазная активность миозиновых мостиков, происходит распад АТФ и выделяющаяся энергия используется на скольжение нитей друг относительно друга, приводящее к сокращению миофибрилл. В отсутствие ионов кальция тропонин препятствует образованию акто-миозинового комплекса и усилению АТФазной активности миозина. Морфологические и функциональные особенности миокарда свидетельствуют о тесной связи между внутриклеточным депо кальция и внеклеточной средой. Так как запасы кальция во внутриклеточных депо невелики, большое значение имеет вход кальция в клетку во время генерации потенциала действия (рис.7.10)". Потенциал действия и сокращение миокарда совпадают во времени. Поступление кальция из наружной среды в клетку создает условия для регуляции силы сокращения миокарда. Большая часть входящего в клетку кальция, очевидно, пополняет его запасы в цистернах саркоплазматического ретикулюма, обеспечивая последующие сокращения.
Следующим этапом электромеханического сопряжения является перемещение ионов кальция к сократительным протофибриллам. Сократительная система сердца представлена сократительными белками — актином и миозином, и модуляторными белками — тропо-миозином и тропонином. Молекулы миозина формируют толстые нити саркомера, молекулы актина — тонкие нити. В состоянии диастолы тонкие актиновые нити входят своими концами в промежутки между толстыми и более короткими миозиновыми нитями. На толстых нитях миозина располагаются поперечные мостики, содержащие АТФ, а на нитях актина — модуляторные белки — тро-помиозин и тропонин. Эти белки образуют единый комплекс, блокирующий активные центры актина, предназначенные для связывания миозина и стимуляции его АТФазной активности. Сокращение волокон миокарда начинается с того момента, когда тропонин связывает вышедший из саркоплазматического ретикулюма в межфибриллярное пространство кальций. Связывание кальция вызывает изменения конформации тропонин-тропомиозинового комплекса. В результате этого открываются активные центры и происходит взаимодействие актиновых и миозиновых нитей. При этом стимулируется АТФазная активность миозиновых мостиков, происходит распад АТФ и выделяющаяся энергия используется на скольжение нитей друг относительно друга, приводящее к сокращению миофибрилл. В отсутствие ионов кальция тропонин препятствует образованию акто-миозинового комплекса и усилению АТФазной активности миозина. Морфологические и функциональные особенности миокарда свидетельствуют о тесной связи между внутриклеточным депо кальция и внеклеточной средой. Так как запасы кальция во внутриклеточных депо невелики, большое значение имеет вход кальция в клетку во время генерации потенциала действия (рис.7.10)". Потенциал действия и сокращение миокарда совпадают во времени. Поступление кальция из наружной среды в клетку создает условия для регуляции силы сокращения миокарда. Большая часть входящего в клетку кальция, очевидно, пополняет его запасы в цистернах саркоплазматического ретикулюма, обеспечивая последующие сокращения.
Удаление кальция из межклеточного пространства приводит к разобщению процессов возбуждения и сокращения миокарда. Потенциалы действия при этом регистрируются почти в неизменном виде, но сокращения миокарда не происходит. Вещества, блокирующие вход кальция во время генерации потенциала действия, вызывают аналогичный эффект. Вещества, угнетающие кальциевый ток, уменьшают длительность фазы плато и потенциала действия и понижают способность миокарда к сокращению. При повышении содержания кальция в межклеточной среде и при введении вешеств, ивающих вход этого иона в клетку, сила сердечных сокращений увеличивается. Таким образом, потенциал действия выполняет роль звого механизма, вызывая освобождения кальция из цистерн саркоплазматического ретикулюма, регулирует сократимость миокарда, а также пополняет запасы кальция во внутриклеточных депо.
255
Сердечный цикл и его фазовая структура.Работа сердца представляет собой непрерывное чередование периодов сокращения (систола) и расслабления (диастола). Сменяющие друг друга, систола и диастола составляют сердечный цикл. Поскольку в покое частота сокращений сердца составляет 60- 80 циклов в минуту, то каждый из них продолжается около 0.8 с. При этом 0.1 с занимает систола предсердий, 0.3 с — систола желудочков, а остальное время — общая диастола сердца.
К началу систолы миокард расслаблен, а сердечные камеры заполнены кровью, поступающей из вен. Атриовентрикулярные клапаны в это время раскрыты и давление в предсердиях и желудочках практически одинаково. Генерация возбуждения в синоатриальном узле приводит к систоле предсердий, во время которой за счет разности давлений конечнодиастолический объем желудочков возрастает приблизительно на 15%. С окончанием систолы предсердий давление в них понижается.
Поскольку клапаны между магистральными венами и предсердиями отсутствуют, во время систолы предсердий происходит сокращение кольцевой мускулатуры, окружающей устья полых и легочных вен, что препятствует оттоку крови из предсердий обратно в вены. В то же время систола предсердий сопровождается некоторым повышением давления в полых венах. Важное значение в систоле предсердий имеет обеспечение турбулентного характера потока крови, поступающего в желудочки, что способствует захлопыванию атриовентрикулярных клапанов. Максимальное и среднее давление в левом предсердии во время систолы составляют соответственно 8-15 и 5-7 мм рт.ст., в правом предсердии — 3-8 и 2-4 мм рт.ст. (рис.7.11).
С переходом возбуждения на атриовентрикулярный узел и проводящую систему желудочков начинается систола последних. Ее начальный этап (период напряжения) продолжается 0.08 с и состоит из двух фаз. Фаза асинхронного сокращения (0.05 с) представляет собой процесс распространения возбуждения и сокращения по миокарду. Давление в желудочках при этом практически не меняется. В ходе дальнейшего сокращения, когда давление в желудочках возрастает до величины, достаточной для закрытия атриовентрикулярных клапанов, но недостаточной для открытия полулунных, наступает фаза изоволюмического или изометрического сокращения.
Дальнейшее повышение давления приводит к раскрытию полулунных клапанов и началу периода изгнания крови из сердца, общая длительность которого составляет 0.25 с. Этот период состоит из фазы быстрого изгнания (0.13 с), во время которой давление продолжает расти и достигает максимальных значений (200 мм рт.ст. в левом желудочке и 60 мм рт.ст. в правом), и фазы медленного изгнания (0.13 с), во время которой давление в желудочках начинает снижаться (соответственно до 130-140 и 20-30 мм рт.ст.), а после окончания сокращения оно резко падает. В магистральных артериях давление снижается значительно медленнее, что обеспечивает захлопывание полулунных клапанов и предотвращает обратный ток крови. Промежуток времени от начала расслабления желудочков
256
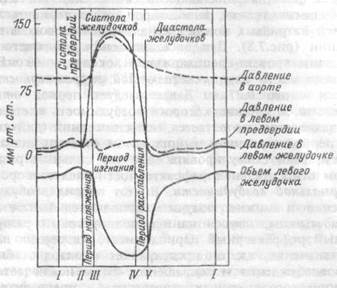
Рис.7.11. Изменения объема левого желудочка и колебания давления в левом предсердии, левом желудочке и аорте в течение сердечного цикла.
I — начало систолы предсердий; II — начало систолы желудочков и момент захлопывания атриовентрикулярных клапанов; III — момент раскрытия полулунных клапанов; IV — конец систолы желудочков и момент закрытия полулунных клапанов; V — раскрытие атриовентрикупярных клапанов. Опускание пинии, показывающей объем желудочков, соответствует динамике их опорожнения.
до закрытия полулунных клапанов называется протодиастолическим периодом.
После окончания систолы желудочков возникает начальный этап диастолы — фаза изоволюмического (изометрического) расслабления, проявляющаяся при закрытых еше клапанах и продолжающаяся примерно 80 мс, т.е. до того момента, когда давление в предсердиях оказывается выше давления в желудочках (2-6 мм рт.ст.), что приводит к открытию атриовентрикулярных клапанов, вслед за которым кровь в течение 0.2-0.13 с переходит в желудочек. Этот период называется фазой быстрого наполнения. Перемещение крови в этот период обусловлено исключительно разностью давлений п предсердиях и желудочках, в то время как его абсолютная величина во всех сердечных камерах продолжает снижаться. Заканчивается диастола фазой медленного наполнения (диастазиса), который продолжается около 0.2 с. В течение этого времени происходит непрерывное поступление крови из магистральных вен как в предсердия, так и в желудочки.
Частота генерации возбуждения клетками проводящей системы и, соответственно, сокращений миокарда определяется длительностью
257
рефрактерной фазы, возникающей после каждой систолы. Как и в других возбудимых тканях, в миокарде рефрактерность обусловлена инактивацией натриевых ионных каналов, возникающей в результате деполяризации (рис.7.8). Для восстановления входящего натриевого тока необходим уровень реполяризации около — 40 мВ. До этого момента имеет место период абсолютной рефрактерности, который продолжается около 0.27 с. Далее следует период относительной рефрактерности, в течение которого возбудимость клетки постепенно восстанавливается, но остается еще сниженной (длительность 0.03 с). В этот период сердечная мышца может ответить дополнительным сокращением, если стимулировать ее очень сильным раздражителем. За периодом относительной рефрактерности следует короткий период супернормальной возбудимости. В этот период возбудимость миокарда высока и можно получить дополнительный ответ в виде сокращения мышцы, нанося на нее подпороговый раздражитель.
Длительный рефрактерный период имеет для сердца важное биологическое значение, т.к. он предохраняет миокард от быстрого или повторного возбуждения и сокращения. Этим исключается возможность тетанического сокращения миокарда и предотвращается возможность нарушения нагнетательной функции сердца.
Частота сердечных сокращений определяется длительностью потенциалов действия и рефрактерных фаз, а также скоростью распространения возбуждения по проводящей системе и временными характеристиками сократительного аппарата кардиомиоцитов. К те-таническому сокращению и утомлению, в физиологическом понимании этого термина, миокард не способен. При сокращении сердечная ткань ведет себя, как функциональный синцитий, и сила каждого сокращения определяется по закону "все или ничего", согласно которому при возбуждении, превышающем пороговую величину, сокращающиеся волокна миокарда развивают максимальную силу, не зависящую от величины надпорогового раздражителя.
Механические, электрические и физические проявления деятельности сердца. Запись сокращений сердца, выполненная каким-либо инструментальным способом, называется кардиограммой.
При сокращении сердце изменяет свое положение в грудной клетке. Оно несколько поворачивается вокруг своей оси слева направо, плотнее прижимаясь изнутри к грудной стенке. Запись сердечного толчка называется механокардиограчмой (апекс-кардиограммой) и находит некоторое, хотя и весьма ограниченное, использование на практике.
Неизмеримо более широкое применение в клинике и, в меньшей степени, в научных исследованиях находят различные модификации электрокардиографии. Последняя представляет собой метод исследования сердца, основанный на регистрации и анализе электрических потенциалов, возникающих при деятельности сердца.
В норме возбуждение охватывает все отделы сердца последовательно и поэтому на его поверхности возникает разность потенциалов между возбужденными и еше не возбужденными участками, достигающая 100
25S
мВ. Благодаря электропроводности тканей организма, эти процессы можно регистрировать и при размещении электродов на поверхности тела, где разность потенциалов составляет 1-3 мВ и образуется, благодаря асимметрии в расположении сердца,
Были предложены три так называемые двуполюсные отведения (I: правая рука — левая рука; II — правая рука — левая нога; III — левая рука — левая нога), которые под названием стандартных используются и в настоящее время. В дополнение к ним обычно регистрируют 6 грудных отведений, для чего один электрод размещают в определенных точках грудной клетки, а другой — на правой руке. Такие отведения, фиксирующие биоэлектрические процессы строго в точке наложения грудного электрода, называют однополюсными или униполярными.
При графической записи электрокардиограммы в любом отведении в каждом цикле отмечается совокупность характерных зубцов, которые принято обозначать буквами Р, Q, R, S и Т (рис.7.12). Эмпирически считается, что зубец Р отражает процессы деполяризации в области предсердия, интервал P-Q характеризует процесс распространения возбуждения в предсердиях, комплекс зубцов QRS — процессы деполяризации в желудочках, а интервал ST и зубец Т — процессы реполяризации в желудочках, Таким образом, комплекс зубцов QRST характеризует распространение электрических процессов в миокарде или электрическую систолу. Важное диагностическое значение имеют временные и амплитудные характеристики составляющих электрокардиограммы. Известно, что во втором стандартном отведении в норме амплитуда зубца R составляет 0.8-1.2 мВ, а амплитуда зубца Q не должна превышать 1/4 этой величины. Длительность интервала PQ в норме составляет 0.12-0.20 с, комплекса QRS — не более 0.08 с, а интервала ST — 0.36-0.44 с.
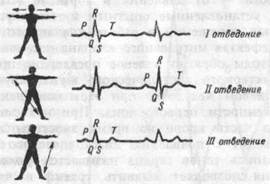
Рис.7.12. Двуполюсные (стандартные) отведения электрокардиограммы.
Концы стрелок соответствуют участкам тела, соединяемыми с кардиографом в первом (вверху), втором.. (посередине) и третьем (внизу) отведении. Справа приведено схематическое изображение электрокардиограммы в каждом из этих отведений.
259
Развитие клинической электрокардиографии пошло по линии сопоставления кривых различных отведений электрокардиограммы в норме с клиническими и патологоанатомическими исследованиями. Были найдены сочетания признаков, позволяющие производить диагностику различных форм патологии (повреждения при инфаркте, блокаду проводящих путей, гипертрофию различных отделов) и определять локализацию этих изменений.
Несмотря на то, что электрокардиография в значительной степени является эмпирическим методом, она и в настоящее время, благодаря доступности и технической простоте, представляет собой широко распространенный способ диагностики в клинической кардиологии.
Каждый сердечный цикл сопровождается несколькими раздельными звуками, которые называются тонами сердца. Их можно зарегистрировать, приложив стетоскоп, фонендоскоп или микрофон к поверхности грудной клетки. Первый тон, более низкий и протяжный, возникает в области атриовентрикулярных клапанов одновременно с началом систолы желудочков. Его начальная фаза связана со звуковыми явлениями, сопровождающими систолу предсердий и вибрацию атриовентрикулярных клапанов, включая их сухожильные струны, но основное значение в возникновении первого тона имеет сокращение мускулатуры желудочков. Первый тон называют систолическим, его общая продолжительность составляет приблизительно 0.12 с, что соответствует фазе напряжения и началу периода изгнания крови.
Второй тон, более высокий и короткий, продолжается около 0.08 с, его возникновение связано с захлопыванием полулунных клапанов и наступающей при этом вибрацией их стенок. Этот тон называют диастолическим. Принято считать, что интенсивность первого тона зависит от крутизны нарастания давления в желудочках во время систолы, а второго — от давления в аорте и легочной артерии. Известны также, установленные опытным путем, акустические проявления различных нарушений в работе клапанного аппарата. Так, например, при дефектах митрального клапана частичный отток крови во время систолы обратно в левое предсердие приводит к возникновению характерного систолического шума; крутизна нарастания давления в левом желудочке при этом ослаблена, что ведет к снижению выраженности первого тона. При недостаточности аортального клапана часть крови во время диастолы возвращается в сердце, что приводит к появлению диастолического шума.
Графическая запись тонов сердца называется фонокардиограммой. Фонокардиография позволяет выявить третий и четвертый тоны сердца: менее интенсивные, чем первый и второй, и поэтому неслышные при обычной аускультации. Третий тон отражает вибрацию стенок желудочков вследствие быстрого поступления крови в начале фазы наполнения. Четвертый тон возникает во время систолы предсердий и продолжается до начала их расслабления.
Процессы, протекающие в ходе сердечного цикла, находят отражение в ритмических колебаниях стенок крупных артерий и вен.
260
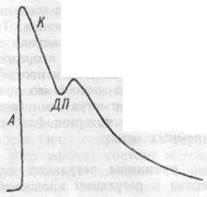
| Рис.7.13. Графическая запись пульсового колебания давления крови в артерии. А — анакрота; К — катакрота; ДП — дикротический подъем. |
Кривую записи артериального пульса называют сфигмограммой (рис.7.13). На ней отчетливо проявляется восходящий участок — анакрота и нисходящий — катакрота, на котором имеется зубец, называемый вторичным или д и кро-тическим подъемом. Выемка, разделяющая на сфигмограмме два пульсовых цикла, называется инцизурой. Анакрота возникает как результат резкого повышения давления в артериях при систоле, а катакрота — как результат постепенного (вследствие эластичности стенок крупных артерий) снижения давления во время диастолы. Дикротический подъем возникает в результате отраженного удара гидравлической волны о замкнутые створки полулунных клапанов в конце систолы. В некоторых условиях (при слабом растяжении артериальных стенок) дикротический подъем бывает настолько резким, что при пальпации его можно принять за дополнительное пульсовое колебание. Ошибка легко устранима при подсчете истинной частоты пульса по сердечному толчку.
| Рис.7.14. Графическая запись венозного пульса (флебограмма). Объяснение в тексте. |
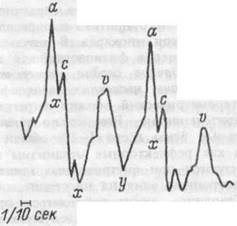 Графическую запись венозного пульса называют флебограммой (рис.7.14). На этой кривой каждому пульсовому циклу соответствуют три пика венозного давления, которые называют волнами флебограммы. Первая волна (а) — соответствует систоле правого предсердия, вторая волна (с) — возникает во время фазы изоволюмического сокращения, когда повышение давления в правом желудочке механически передается через закрытый ат-риовентрикулярный клапан на давление в правом
Графическую запись венозного пульса называют флебограммой (рис.7.14). На этой кривой каждому пульсовому циклу соответствуют три пика венозного давления, которые называют волнами флебограммы. Первая волна (а) — соответствует систоле правого предсердия, вторая волна (с) — возникает во время фазы изоволюмического сокращения, когда повышение давления в правом желудочке механически передается через закрытый ат-риовентрикулярный клапан на давление в правом
261
предсердии и магистральных венах. Последующее резкое снижение венозного давления отражает падение давления в предсердиях во время желудочковой фазы изгнания. Третья волна флебограммы (v) соответствует фазе изгнания систолы желудочков и характеризует динамику притока крови из вен в предсердия. Следующее за этим падение давления отражает динамику поступления крови из правого предсердия трехстворчатого клапана во время обшей диастолы сердца.
Регистрацию сфигмограммы обычно производят на сонной, лучевой или пальцевой артерии; флебограмму, как правило, регистрируют в яремных венах.
Общие принципы регуляции сердечного выброса.Рассматривая роль сердца в регуляции кровоснабжения органов и тканей, необходимо иметь в виду, что от величины сердечного выброса могут зависеть два необходимых условия для обеспечения адекватной текущим задачам нутритивной функции системы кровообращения: обеспечение оптимальной величины общего количества циркулирующей крови и поддержание (совместно с сосудами) определенного уровня среднего артериального давления, необходимого для удержания физиологических констант в капиллярах. При этом обязательным условием нормальной работы сердца является равенство притока и выброса крови. Решение этой задачи обеспечивается, в основном, механизмами, обусловленными свойствами самой сердечной мышцы. Проявления этих механизмов называют миогенной ауторе-гуляцией насосной функции сердца. Существуют два способа ее реализации: гетерометрическая — осуществляется вответ на изменение длины волокон миокарда, гомеометрическая — осуществляется при их сокращениях в изометрическом режиме.
Миогенные механизмы регуляции деятельности сердца. Изучение зависимости силы сокращений сердца от растяжения его камер показало, что сила каждого сердечного сокращения зависит от величины венозного притока и определяется конечной диастолической длиной волокон миокарда. В результате было сформулировано правило, вошедшее в физиологию как закон Старлинга: "Сила сокращения желудочков сердца, измеренная любым способом, является функцией длины мышечных волокон перед сокращением".
Гетерометрический механизм регуляции характеризуется высокой чувствительностью. Его можно наблюдать при введении в магистральные вены всего 1-2% общей массы циркулирующей крови, тогда как рефлекторные механизмы изменений деятельности сердца реализуются при внутривенных введениях не менее 5-10% крови.
Инотропные влияния на сердце, обусловленные эффектом Франка- Старлинга, могут проявляться при различных физиологических состояниях. Они играют ведущую роль в увеличении сердечной деятельности при усиленной мышечной работе, когда сокращающиеся скелетные мышцы вызывают периодическое сжатие вен конечностей, что приводит к увеличению венозного притока за счет мобилизации резерва депонированной в них крови. Отрицательные инотропные влияния по указанному механизму играют существенную роль в
262
изменениях кровообращения при переходе в вертикальное положение (ортостатическая проба). Эти механизмы имеют большое значение для согласования изменений сердечного выброса ипритока крови по венам малого круга, что предотврашает опасность развития отека легких. Гетерометрическая регуляция сердца может обеспечить компенсацию циркуляторной недостаточности при его пороках.
Термином "гомеометрическая регуляция" обозначают миогенные механизмы, для реализации которых не имеет значения степень конечно- диастолического растяжения волокон миокарда. Среди них наиболее важным является зависимость силы сокращения сердца от давления в аорте (эффект Анрепа). Этот эффект состоит в том, что увеличение давления в аорте первоначально вызывает снижение систолического объема сердца и увеличение остаточного конечного диастолического объема крови, вслед за чем происходит увеличение силы сокращений сердца и сердечный выброс стабилизируется на новом уровне силы сокращений.
Таким образом, миогенные механизмы регуляции деятельности сердца могут обеспечивать значительные изменения силы его сокращений. Особенно существенное практическое значение эти факты приобрели в связи с проблемой трансплантации и долгосрочного протезирования сердца. Показано, что у людей с пересаженным и лишенным нормальной иннервации сердцем в условиях мышечной работы имеет место увеличение ударного объема более чем на 40%.
Иннервация сердца.Сердце представляет собой обильно иннер-вированный орган. Большое количество рецепторов, расположенных в стенках сердечных камер и в эпикарде, позволяет говорить о нем как о рефлексогенной зоне. Наибольшее значение среди чувствительных образований сердца имеют две популяции механорецепто-ров, сосредоточенных, главным образом, в предсердиях и левом желудочке: А-рецепторы реагируют на изменение напряжения сердечной стенки, а В-рецепторы возбуждаются при ее пассивном растяжении. Афферентные волокна, связанные с этими рецепторами, идут в составе блуждающих нервов. Свободные чувствительные нервные окончания, расположенные непосредственно под эндокардом, представляют собой терминали афферентных волокон, проходящих в составе симпатических нервов. Считается, что именно эти структуры участвуют в развитии болевого синдрома с сегментарной иррадиацией, характерного для приступов ишемической болезни сердца, включая инфаркт миокарда.
Эфферентная иннервация сердца осуществляется при участии обоих отделов вегетативной нервной системы (рис.7.15). Тела симпатических преганглионарных нейронов, участвующих в иннервации сердца, располагаются в сером веществе боковых рогов трех верхних грудных сегментов спинного мозга. Преганглионарные волокна направляются к нейронам верхнего грудного (звездчатого) симпатического ганглия. Постганглионарные волокна этих нейронов вместе с парасимпатическими волокнами блуждающего нерва образуют верхний, средний инижний сердечные нервы. Симпатические волокна
263
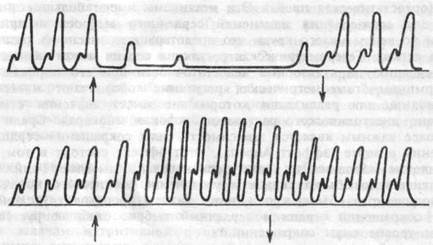
Рис.7.15. Электрическое раздражение эфферентных нервов сердца.
Вверху — уменьшение частоты сокращений при раздражении блуждающего нерва; внизу — увеличение частоты и силы сокращений при раздражении симпатического нерва. Стрелками отмечены начало и конец раздражения.
пронизывают весь орган и иннервируют не только миокард, но и элементы проводящей системы.
Тела парасимпатических преганглионарных нейронов, участвующих в иннервации сердца, располагаются в продолговатом мозге. Их аксоны идут в составе блуждающих нервов. После вхождения блуждающего нерва в грудную полость от него отходят веточки, которые включаются в состав сердечных нервов.
Дериваты блуждающего нерва, проходящие в составе сердечных нервов, представляют собой парасимпатические преганглионарные волокна. С них возбуждение передается на интрамуральные нейроны и далее — преимущественно на элементы проводящей системы. Влияния, опосредованные правым блуждающим нервом, адресованы, в основном, клетками синоатриального, а левым — атриовентрику-лярного узла. Прямого влияния на желудочки сердца блуждающие нервы не оказывают.
В сердце располагаются многочисленные интрамуральные нейроны, как одиночно расположенные, так и собранные в ганглии. Основная масса этих клеток расположена непосредственно вблизи атриовентрикулярного и синоатриального узлов, образуя вместе с массой эфферентных волокон, лежащих внутри межпредсердной перегородки, внутрисердечное нервное сплетение. В последнем имеются все элементы, необходимые для замыкания местных рефлекторных дуг, поэтому интрамуральный нервный аппарат сердца иногда относят к метасимпатической системе.
264
Иннервируя ткань водителей ритма, вегетативные нервы способны менять их возбудимость, тем самым вызывая изменения частоты генерации потенциалов действия и сокращений сердца {хронотроп-ный эффект). Нервные влияния могут изменять скорость электротонической передачи возбуждения и, следовательно, длительности фаз сердечного цикла. Такие эффекты называют дромотропными.
Поскольку действие медиаторов вегетативной нервной системы заключается в изменении уровня циклических нуклеотидов и энергетического обмена, вегетативные нервы в целом способны влиять и на силу сердечных сокращений (инотропный эффект). В лабораторных условиях получен эффект изменения величины порога возбуждения кардиомиоцитов под действием нейромедиаторов, его обозначают как батмотропный.
Перечисленные пути воздействия нервной системы на сократительную активность миокарда и насосную функцию сердца представляют собой хотя и исключительно важные, но вторичные по отношению к миогенным механизмам, модулирующие влияния.
Подробно изучено влияние на сердце блуждающего нерва. Результатом стимуляции последнего является отрицательный хроно-тропный эффект, на фоне которого проявляются также отрицательные дромотропный и инотропный эффекты (рис.7.15). Существуют постоянные тонические влияния на сердце со стороны бульбарных ядер блуждающего нерва: при его двусторонней перерезке частота сердцебиений возрастает в 1.5-2.5 раза. При длительном сильном раздражении влияние блуждающих нервов на сердце постепенно ослабевает или прекращается, что получило название "эффекта ускользания" сердца из-под влияния блуждающего нерва.
Симпатические влияния на сердце были впервые описаны в форме положительного хронотропного эффекта. Несколько позднее показана возможность и положительного инотропного эффекта стимуляции симпатических нервов сердца. Сведения о наличии тонических влияний симпатической нервной системы на миокард касаются, в основном, хронотропных эффектов.
Менее изученным остается участие в регуляции сердечной деятельности интракардиальных ганглиозных нервных элементов. Известно, что они обеспечивают передачу возбуждения с волокон блуждающего нерва на клетки синоатриального и атриовентрикуляр-ного узлов, выполняя функцию парасимпатических ганглиев. Описаны инотропные, хронотропные и дромотропные эффекты, полученные при стимуляции этих образований в условиях эксперимента на изолированном сердце. Значение этих эффектов в естественных условиях остается неясным. Поэтому основные представления о ней-рогенной регуляции сердца основаны на данных экспериментальных исследований эффектов стимуляции эфферентных сердечных нервов.
Электрическая стимуляция блуждающего нерва вызывает урежение или прекращение сердечной деятельности вследствие торможения автоматической деятельности водителей ритма синоатриального узла. Выраженность этого эффекта зависит от силы и частоты раздражения блуждающего нерва. По мере увеличения силы раздражения
265
отмечается переход от небольшого замедления синусового ритма до полной остановки сердца.
Отрицательный хронотропный эффект раздражения блуждающего нерва связан с угнетением (замедлением) генерации импульсов в водителе ритма сердца синусного узла. При раздражении блуждающего нерва в его окончаниях выделяется медиатор — ацетилхолин. В результате взаимодействия ацетилхолина с мускариночувствительными рецепторами сердца повышается проницаемость поверхностной мембраны клеток водителей ритма для ионов калия. Как следствие этого, возникает гиперполяризация мембраны, которая замедляет (подавляет) развитие медленной спонтанной диастолической деполяризации, и поэтому мембранный потенциал позже достигает критического уровня. Это приводит к урежению ритма сокращений сердца.
При сильных раздражениях блуждающего нерва диастолическая деполяризация подавляется, возникает гиперполяризация водителей ритма и полная остановка сердца. Развитие гиперполяризации в клетках водителя ритма снижает их возбудимость, затрудняет возникновение очередного автоматического потенциала действия и, тем самым, приводит к замедлению или даже остановке сердца. Стимуляция блуждающего нерва, усиливая выход калия из клетки, увеличивает мембранный потенциал, ускоряет процесс реполяризации и при достаточной силе раздражающего тока укорачивает длительность потенциала действия клеток водителя ритма.
При вагусных воздействиях имеет место уменьшение амплитуды и длительности потенциала действия кардиомиоцитов предсердия. Отрицательный инотропный эффект связан с тем, что уменьшенный по амплитуде и укороченный потенциал действия не способен возбудить достаточное количество кардиомиоцитов. Кроме того, вызванное ацетилхолином повышение калиевой проводимости противодействует потенциалзависимому входящему току кальция и проникновению его ионов внутрь кардиомиоцита. Холинергический медиатор ацетилхолин может также угнетать АТФ-фазную активность миозина и, таким образом, уменьшать величину сократимости кардиомиоцитов. Возбуждение блуждающего нерва приводит к повышению порога раздражения предсердий, подавлению автоматии и замедлению проводимости атриовентрикулярного узла. Указанное замедление проводимости при холинергических влияниях может вызвать частичную или полную атриовентрикулярную блокаду.
Электрическая стимуляция волокон, отходящих от звездчатого ганглия, вызывает ускорение ритма сердца, увеличение силы сокращений миокарда (рис.7.15). Под влиянием возбуждения симпатических нервов скорость медленной диастолической деполяризации повышается, снижается критический уровень деполяризации клеток водителей ритма синоатриального узла, уменьшается величина мембранного потенциала покоя. Подобные изменения увеличивают скорость возникновения потенциала действия в клетках водителей ритма сердца, повышают его возбудимость и проводимость. Эти изменения электрической активности связаны с тем, что выделяющийся из окончаний симпатических волокон медиатор норадреналин взаимодействует с В1,-адренорецепто-
266
рами поверхностной мембраны клеток, что приводит к повышению проницаемости мембран для ионов натрия и кальция, а также уменьшению проницаемости для ионов калия.
Ускорение медленной спонтанной диастолической деполяризации клеток водителя ритма, увеличение скорости проведения в предсердиях, атриовентрикулярном узле и желудочках приводит к улучшению синхронности возбуждения и сокращения мышечных волокон и к увеличению силы сокращения миокарда желудочков. Положительный инотропный эффект связан также с повышением проницаемости мембраны кардиомиоцитов для ионов кальция. При увеличении входящего тока кальция возрастает степень электромеханического сопряжения, в результате чего увеличивается сократимость миокарда.
Рефлекторные влияния на сердце.Воспроизвести рефлекторные изменения деятельности сердца, в принципе, можно с рецепторов любого анализатора. Однако, далеко не каждая воспроизводимая в условиях эксперимента нейрогенная реакция сердца имеет реальное значение для его регуляции. Кроме того, многие висцеральные рефлексы оказывают на сердце побочное или неспецифическое действие. Соответственно, выделены три категории кардиальных рефлексов: собственные,вызываемые раздражением рецепторов сердечно-сосудистой системы; сопряженные, обусловленные активностью любых других рефлексогенных зон; неспецифические, которые воспроизводятся в условиях физиологического эксперимента, а также в патологии.
Наибольшее физиологическое значение имеют собственные рефлексы сердечно-сосудистой системы, которые возникают чаще всего при раздражении барорецепторов магистральных артерий в результате изменения системного давления. Так, при снижении давления в аорте и каротидном синусе происходит рефлекторное увеличение частоты сердцебиения.
Особую группу собственных кардиальных рефлексов представляют те из них, которые возникают в ответ на раздражение артериальных хеморецепторов изменением напряжения кислорода в крови. В условиях гипоксемии развивается рефлекторная тахикардия, а при дыхании чистым кислородом — брадикадия. Эти реакции отличаются исключительно высокой чувствительностью: у человека увеличение частоты сердцебиения наблюдается уже при снижении напряжения кислорода всего на 3%, когда никаких признаков гипоксии в организме обнаружить еще невозможно.
Собственные рефлексы сердца проявляются и в ответ на механическое раздражение сердечных камер, в стенках которых находится большое количество барорецепторов. К их числу относят рефлекс Бейнбриджа, описанный как тахикардия, развивающаяся в ответ на внутривенное введение крови при неизменном артериальном давлении. Считается, что эта реакция является рефлекторным ответом на раздражение барореиепторов полых вен и предсердия, поскольку она устраняется при денервации сердца. В то же время доказано существование отрицательных хронотропных и инотропных реакций серд-
267
ца рефлекторной природы, возникающих в ответ на раздражение механорецепторов как правого, так и левого сердца. Показана также физиологическая роль интракардиальных рефлексов. Суть их состоит в том, что увеличение исходной длины волокон миокарда приводит к усилению сокращений не только растягиваемого отдела сердца (в соответствии с законом Старлинга), но и к усилению сокращений других отделов сердца, не подвергавшихся растяжению.
Описаны рефлексы с сердца, оказывающие влияние на функцию других висцеральных систем. К их числу относят, например, карди-оренальный рефлекс Генри- Гауэра, который представляет собой увеличение диуреза в ответ на растяжение стенки левого предсердия.
Собственные кардиальные рефлексы составляют основу нейроген-ной регуляции деятельности сердца. Хотя, как следует из представленного материала, реализация его насосной функции возможна и без участия нервной системы.
Сопряженные кардиальные рефлексы представляют собой эффекты раздражения рефлексогенных зон, не принимающих прямого участия в регуляции кровообращения. К числу таких рефлексов относят рефлекс Гольца, который проявляется в форме брадикардии (до полной остановки сердца) в ответ на раздражение механорецепторов брюшины или органов брюшной полости. Возможность проявления такой реакции учитывается при проведении оперативных вмешательств на брюшной полости, при нокауте у боксеров -и т.д. Сходные с упомянутыми изменения сердечной деятельности наблюдаются при раздражении некоторых экстерорецепторов. Так, например, рефлекторная остановка сердца может иметь место при резком охлаждении кожи области живота. Именно такую природу нередко имеют несчастные случаи при нырянии в холодную воду. Характерным примером сопряженного соматовисцерального кардиального рефлекса является рефлекс Данини-Ашнера, который проявляется в виде брадикардии при надавливании на глазные яблоки. К числу сопряженных кардиальных рефлексов относят также все без исключения условные р
Дата добавления: 2016-03-27; просмотров: 1907;
