Микроциркуляция (микрогемодинамика).
Кровоток в сосудах микроциркуляторного русла, обмен между плазмой и межтканевой жидкостью, а также обмен межтканевой жидкости и лимфы составляют понятие микроциркуляции. К микроциркулятор-ному руслу относят сосуды: распределители капиллярного кровотока (терминальные артериолы, метартериолы, артерио-венулярные анастомозы, прекапиллярные сфинктеры) и обменные сосуды (капилляры и посткапиллярные венулы). В месте отхождения капилляров от метар-териол имеются одиночные гладко мышечные клетки, получившие функциональное название прекапиллярные сфинктеры.
Стенки капилляров гладкомышечных элементов не содержат. В капиллярах имеются наиболее благоприятные условия для обмена между кровью и тканевой жидкостью. Это определяется высокой проницаемостью стенки капилляров для воды и растворенных в плазме веществ; большой обменной поверхностью капилляров; гидростатическим давлением, способствующим фильтрации на артериальном и реабсорбции на венозном концах капилляра; медленной линейной скоростью кровотока, обеспечивающей достаточный контакт крови с обменной поверхностью капилляров.
Стенки капилляров образованы, расположенными в один слой, эндотелиальными клетками. В зависимости от ультраструктуры стенок выделяют три типа капилляров: соматический, висцеральный, синусоидный. Стенка капилляров соматического типа образована сплошным слоем эндотелиальных клеток, в мембране которых имеется большое количество мельчайших пор, диаметром 4-5 нм. Этот тип капилляров характерен для кожи, скелетных и гладких мышц, миокарда, легких. Стенка капилляров соматического типа легко пропускает воду, растворенные в ней кристаллоиды, но мало проницаема для белка. Клетки капилляров висцерального типа имеют в мембране эндотелия "окошки" — фенестры, которые представляют собой пронизывающие цитоплазму эндотелиальных клеток отверстия, диаметром 40-60 нм, затянутые тончайшей мембраной. Такой тип капилляров имеет место в почках, кишечнике, эндокринных железах, т.е. органах, в которых всасывается большое количество воды с растворенными в ней вещества ми. Капилляры синусоидного типа имеют прерывистую стенку с большими просветами. Эндотелиальные клетки отделены друг от друга щелями, в области которых отсутствует базальная мембрана. Диаметр капилляров — синусоид колеблется от 1 до 4 мкм. Такой тип капилляров обеспечивает высокую проницаемость не только для жидкости, но и для белка и клеток крови. Он имеется в селезенке, печени, костном мозге.
Радиус капилляров в среднем составляет 3 мкм (истинный капилляр может иметь диаметр от 2 до 12-14 мкм), а длина 750 мкм.
317
Таким образом, площадь поперечного сечения капилляра равна в среднем около 30 мкм2, а площадь поверхности примерно 14000 мкм2 (общая эффективная обменная поверхность). Состояние капиллярного русла характеризуется отношением числа функционирующих капилляров к нефункционирующим. В скелетной мышце в покое функционирует 20-30% капилляров. При интенсивной физической нагрузке количество функционирующих капилляров увеличивается до 60%. При увеличении числа функционирующих капилляров возрастает величина их обменной поверхности, снижается диффузионное расстояние между капиллярами и клетками и улучшается кровоснабжение ткани. Толщина стенки капилляра составляет 0.7-1.5 мкм. Несмотря на небольшую толщину стенки, растяжимость капилляров мала. Это объясняется не столько строением стенки капилляров, сколько механическими свойствами окружающей их соединительной ткани органа.
Гидростатическое давление на артериальном конце "усредненного" капилляра равно примерно 30 мм рт.ст., на венозном — 10- 15 мм рт.ст. Этот показатель варьирует в различных органах и тканях и зависит от соотношения пре- и посткапиллярного сопротивления, которое и определяет его величину. Так, в капиллярах почек он может достигать 70 мм рт.ст., а в легких — только 6-8 мм рт. ст.
Транскапиллярный обмен веществ обеспечивается путем диффузии, фильтрации, реабсорбции и микропиноцитоза. Скорость диффузии высока: 60 л/мин. Легко осуществляется диффузия жирорастворимых веществ (СО2, О2), водорастворимые вещества попадают в интерс-тиций через поры, крупные вещесхва — путем пиноцитоза.
Второй .механизм, обеспечивающий обмен жидкости и растворенных в ней веществ между плазмой и межклеточной жидкостью, — фильтрация-абсорбция. Давление крови на артериальном конце капилляра способствует переходу воды из плазмы в тканевую жидкость. Белки плазмы, создавая онкотическое давление, равное примерно 25 мм рт.ст., задерживают выход воды. Гидростатическое давление тканевой жидкости около 3 мм рт.ст., онкотическое — 4 мм рт.ст. На артериальном конце капилляра силы, обеспечивающие фильтрацию, больше сил, обеспечивающих абсорбцию. На венозном конце капилляра создаются условия для абсорбции. Между объемом жидкости, фильтрующейся на артериальном конце капилляра и абсорбирующейся в венозном конце, существует динамическое равновесие. За сутки через капилляры проходит примерно 8000 л крови, фильтруется 20 л, абсорбируется 18 л жидкости, 2 л возвращается в кровь через лимфатические сосуды. Таким образом, транскапиллярный обмен является одним из механизмов поддержания внутри-сосудистого объема циркулирующей крови.
Линейная скорость кровотока в сосудах микроциркуляторного русла мала — от 0.1 до 0.5 мм/с. Низкая скорость кровотока обеспечивает длительный контакт крови с обменной поверхностью и создает оптимальные условия для обменных процессов. Характер капиллярного кровотока сложен. При биомикроскопическом исследовании с помощью телевизионного микроскопа может наблюдаться замена
318
одних функционирующих капилляров другими. Просвет мелких ар-териол и прекапиллярных сфинктеров меняется, что приводит к периодическим спонтанным изменениям кровотока ("вазомоции"). Форменные элементы, проходя через мелкие капилляры, могут закупоривать их и временно прекращать поступление крови в капилляры. Кровоток в капиллярах может менять направление. Объемный кровоток в микрососудах различных органов неодинаков и зависит, как правило, от уровня метаболизма: чем выше уровень метаболизма, тем больше кровоток.
Отсутствие мышечных клеток в стенке капилляров указывает на невозможность активного сокращения капилляров. Пассивные сужения и расширения капилляров, величина кровотока и количество функционирующих капилляров зависят от тонуса гладко мышечных структур терминальных артериол, метартериол и прекапиллярных сфинктеров.
Процессы транскапиллярного обмена жидкости в соответствии с уравнением Старлинга определяются силами, действующими в области капилляров: капиллярным гидростатическим давлением {Рс) и гидростатическим давлением интерстициальной жидкости {Pi), разность которых (Pc-Pi) способствует фильтрации, т.е. переходу жидкости из внутрисосудистого пространства в интерстициальное; кол-лоидноосмотическим давлением крови (Пс) и интерстициальной жидкости (Пi), разность который (Пс- Пi) способствует абсорбции, т.е. движению жидкости из тканей во внутрисосудистое пространство. Если фильтрация и абсорбция сбалансированы, то наступает "старлинговское равновесие".
Объемная скорость транскапиллярного обмена жидкости (Qf) в значительной мере зависит от суммарной плошади поверхности функционирующих капилляров и их проницаемости. Следовательно, количественная характеристика объемной скорости транскапиллярного перемещения жидкости может быть произведена по формуле 1, где CFC — коэффициент капиллярной фильтрации, характеризующий площадь обменной поверхности (число функционирующих капилляров) и проницаемость капиллярной стенки для жидкости. Коэффициент имеет размерность мл/мин/100 г ткани/мм рт.ст., т.е. показывает, сколько миллилитров жидкости в 1 мин фильтруется (или абсорбируется) в 100 г исследуемой ткани при изменении капиллярного гидростатического давления на 1 мм рт.ст.; о — осмотический коэффициент отражения капиллярной мембраны, который характеризует реальную проницаемость мембраны не только для воды, но и для растворенных в ней веществ, а также белков.
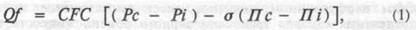
|
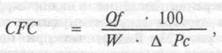
|
(2)
319
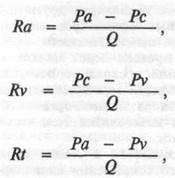
|
(3)
(4)
(5)
где Qf — объемная скорость фильтрации; Ra — прекапиллярное сопротивление; Ра — артериальное (перфузионное) давление; Q — объемная скорость кровотока через орган; Rv — посткапиллярное сопротивление; Pv — венозное давление; Rt — полное (суммарное) сосудистое сопротивление в органе; W — вес органа.
Скорость транскапиллярного перемещения жидкости может измениться при сдвиге величины CFC и любого из входящих в формулу 1 параметра. Поэтому, количественная оценка фильтрационно-абсорбционного процесса, собственно, и заключается в нахождении величины всех составляющих компонентов этой формулы. По формуле 2 определяется величина CFC практически в любом органе.
Капиллярное и гидростатическое давление определяется соотношением пре- и посткапиллярного сопротивления, поэтому раздельное определение этих параметров и их соотношение является крайне важным для оценки органного кровообращения, особенно оценки сопротивления венозных сосудов. Они определяются по формулам 3 и 4. Полное (суммарное) сосудистое сопротивление в органе определяется общеизвестным способом по формуле Пуазейля (ф.5).
Как следует из вышесказанного, основополагающим параметром для расчета большинства показателей, характеризующих органное кровообращение и микроциркуляцию в нем, является величина Рс — капиллярное гидростатическое давление. Специально разработанные для этого способы позволяют определять этот параметр прямым и косвенным методом.
Таким образом, органное кровообращение характеризуется по многим его составляющим параметрам, которые определяют его макро- и микрогемодинамику и позволяют расшифровать механизмы сопряжения резистивной, емкостной и обменной функций органных сосудов. Следует подчеркнуть, что перфузия органа (или ткани) в режиме стабилизированного расхода крови или при постоянном перфузионном давлении имеет существенное значение для определения сдвигов транскапиллярного обмена жидкости не только в количественном, но и в качественном плане.
Результаты измерения давления в капиллярах мышечного препарата в ответ на электрическую стимуляцию симпатических нервов представлены на рис.7.23. Видно, что при постоянном кровотоке (Q=const) капиллярное гидростатическое давление (Рс) увеличива-
320
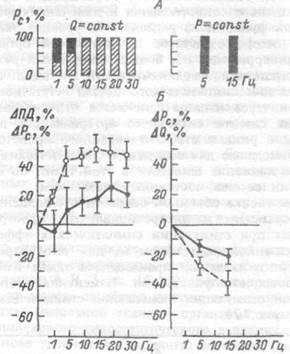
Рис.7.23. Зависимость характера (А) и величины (Б) изменений капиллярного гидростатического давления (Рс) в сосудах задней конечности кошек от интенсивности электростимуляции симпатических эфферентных волокон при перфузии с постоянным кровотоком (слева) и постоянным давлением (справа).
На А — процентное соотношение числа случаев уменьшения (зачернено) и увеличения (заштриховано) капиллярного давления. На Б — средние величины изменений перфузионного давления (ПД), капиллярного давления (Рс), кровотока (О) в процентах от исходного уровня.
ется в среднем на 20% при частотах стимуляции нерва 15-30 Гц. При режиме стабилизированного давления в магистральной артерии мышцы (P=const) капиллярное давление в ней в ответ на указанную стимуляцию снижается примерно на ту же величину. Приведенные данные указывают на возможность различий в характере изменений капиллярного гидростатического давления на примененный вазомоторный стимул в зависимости от способа перфузии органа. Увеличение этого давления в ответ на стимуляцию симпатических эффе-рентов при перфузии мышцы с постоянным объемом кровотока и уменьшение его при постоянном перфузионном давлении приводит, соответственно, к фильтрации или абсорбции жидкости в препарате. Поскольку даже в экспериментальных исследованиях еще не разработан метод измерения регионарного посткапиллярного сопротивления в условиях естественного кровоснабжения региона, использо-
321
вание перфузионной техники является необходимым приемом анализа участия указанного сопротивления в изменениях фильтрацион-но-абсорбционной функции на регионарном уровне. Экстраполяция, получаемых при этом, результатов на интактный организм тем в большей степени корректна, чем больше выбранный режим перфузии адекватен конкретной гемодинамической ситуации. В частности, если при возбуждении симпатического отдела вегетативной нервной системы кровоток через мышцы изменяется относительно слабо на фоне выраженных сдвигов системного артериального давления, то перфузия мышцы в режиме стабилизированного кровотока является более адекватной моделью для выяснения симпатических влияний на транскапиллярное движение жидкости в этой ткани по сравнению с режимом перфузии ее под постоянным давлением.
Количественная оценка объемной скорости перемещения жидкости между внутрисосудистым и интерстициальным пространствами в скелетных мышцах при стимуляции симпатических эфферентов определяется по указанной выше формуле, для чего, наряду с измерением капиллярного давления, производится также измерение коэффициента капиллярной фильтрации. Изменения этого параметра при электрической стимуляции люмбальной симпатической цепочки представлены на рис.7.24.
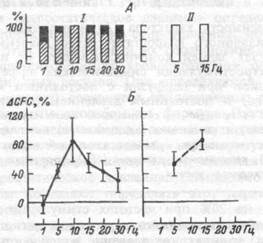
Рис.7.24. Влияние электрической стимуляции люмбальной
симпатической цепочки на характер (А) и величину (Б) изменений коэффициента капиллярной фильтрации (CFC) сосудов задней конечности при их перфузии в режимах стабилизированного кровотока (I) и давления (II).
На А — процентное соотношение числа случаев уменьшения (зачерненная часть столбиков) и увеличения (заштрихованная часть) коэффициента капиллярной фильтрации. На Б — средние величины изменений коэффициента капиллярной фильтрации в процентах от исходного уровня. Цифры под столбиками и диаграммами — частота стимуляции симпатической цепочки в Гц.
322
В каждом из рассматриваемых режимов имеет место увеличение коэффициента капиллярной фильтрации, причем, значения этого параметра при выбранных для сравнения частотах стимуляции 5 и 15 Гц сопоставимы при обоих способах перфузии. Считается, что сдвиги коэффициента капиллярной фильтрации контролируются работой прекапиллярных сфинктеров (распределителей кровотока). С этой точки зрения, указанные результаты измерения CFC можно интерпретировать таким образом, что активация симпатических нервов в скелетных мышцах вызывает дилататорный эффект на уровне прекапиллярных сфинктеров, т.е. качественно иную реакцию по сравнению с артериями и артериолами. Если считать увеличение коэффициента капиллярной фильтрации обусловленным дилатацией прекапиллярных сфинктеров, то этот феномен можно связать с активацией их В- адренорецепторов, поскольку высказывается мнение о преобладании В- адренорецепторов в области прекапиллярных сфинктеров.
Количество транскапиллярно перемещаемой жидкости в 100 г скелетных мышц при раздражении симпатических эфферентов (параметры стимуляции: 6 В, 5 мс, 15 Гц) составляет за 1 мин примерно 0.03 мл; тем не менее, ее общее количество, которое рассчитывается с учетом массы мышечной ткани в организме и длительности повышения капиллярного гидростатического давления, может теоретически (на основе уравнения Старлинга) составить около 6- 8% объема циркулирующей крови. Реальная величина перемещаемой между внутрисосудистым и интерстициальным пространствами жидкости, очевидно, меньше указанной цифры в силу существующей ауторе-гуляции капиллярного гидростатического давления.
В качестве примера целесообразности и необходимости использования такого рода подходов могут служить результаты исследования механизмов действия некоторых коронарорасширяющих веществ, применяемых в клинике (коринфар, изоптин, сензит, обзидан), которые, как оказалось, весьма эффективны и для сосудов других органов. При этом коринфар, изоптин и сензит примерно в равной мере (зависимой от дозы препарата) вызывали снижение сопротивления сосудов тонкого кишечника и конечности, в то же время наибольшие изменения венозного оттока в сосудах кишечника имели место при применении изоптина, а в сосудах конечности — сензита (рис.7.25). Сопоставление влияния коринфара и обзидана на сосуды кишечника показало, что последний в большинстве случаев вызывает в них повышение перфузионного давления, прекапилляр-ного сопротивления и отношения пре- к посткапиллярному сопротивлению и всегда — рост посткапиллярного сопротивления, капиллярного гидростатического давления и коэффициента капиллярной фильтрации, в то время как коринфар, аналогичным образом влияя на последние два показателя, остальные сдвигает в противоположном направлении (рис.7.26).
Эти данные свидетельствуют о необходимости более детального изучения механизмов действия вазоактивных препаратов, особенно, применяемых в клинике, ибо при использовании их, как, например,
323
Рис.7.25. Величины снижения

|
перфузионного давления (ПД) и увеличения венозного оттока (ВО) в сосудах кишечника (А) и конечности (Б) при введении в кроток возрастающих доз антагонистов Са2+.
Столбики: белые — коринфар, с косой штриховкой — изоптин, черные — сензит. Цифры над стобиками — доза препарата, в мкг/кг. Шкалы: вверху — величина уменьшения ПД, в % к исходному, внизу — изменения ВО, в мл. Iф — 1-я фаза, IIф —2-я фаза.
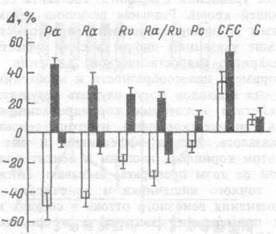
Рис.7.26. Характер и величина изменений параметров микро- и макрогемодинамики в сосудах тонкого кишечника при инфузии в его кровоток коринфара и обзидана.
Шкала — изменения параметра, в % к его исходной величине; выше горизонтальной линии — увеличение, ниже — снижение величины. Ра — перфузионное давление, Ra — прекапиллярное, Rv — посткапиллярное сопротивление, Ra/Rv — их отношение, Рс — капиллярное гидростатическое давление, CFC — коэффициент капиллярной фильтрации, С — растяжимость венозных сосудов. Столбики: белые — коринфар (7.5 мкг/мин); черные — обзидан (7.5 мкг/мин).
324
в изученном случае с целью коронародилатации, возможны одновременные выраженные изменения макро- и микрогемодинамики в других органах, причем, не всегда однозначные. А от характера и величины сдвигов капиллярного давления зависит транскапиллярное перемещение жидкости, что требует внимания у больных с отеком тканей. Основной эффект — расширение прекапиллярных сфинктеров (о чем свидетельствует повышение коэффициента капиллярной фильтрации) достигается при этом обоими препаратами.
Своеобразие терминального сосудистого русла различных органов и тканей отражает и зависит от их функциональных особенностей, прежде всего, от уровня обмена кислорода, интенсивности процессов метаболизма. Так, в различных тканях и органах капилляры образуют сеть определенной плотности в зависимости от их метаболической активности. На основании этих данных введено даже понятие "критическая толщина тканевого слоя", т.е. наибольшая толщина ткани между двумя капиллярами, которая обеспечивает оптимальный транспорт кислорода и эвакуацию продуктов метаболизма. Чем интенсивнее обменные процессы в органе, тем меньше критическая толщина ткани, т.е. между этими показателями существует обратно пропорциональная зависимость. В большинстве паренхиматозных органов величина этого показателя составляет всего 10-30мкм, а в органах с замедленными процессами обмена она возрастает до 1000 мкм.
Для оценки функциональной активности шунтирующих сосудов (артерио- венозных анастомозов) используют возможность перехода частиц, превышающих по размерам диаметр капилляров, из артериального отдела сосудистого русла в венозный.
Оценка функциональной активности артерио-венозных анастомозов по переходу через них надэритроцитарных частиц (превышающих по диаметру эритроциты и капилляр) больше качественная, чем количественная. Она, прежде всего, дает представление о наличии прекапиллярного кровотока через анастомозы большего или меньшего диаметров и, в меньшей степени, отражает количество шунтируемой крови.
При использовании формулы Пуазейля рассчитано, что кровоток через анастомозы может во много раз превышать кровоток по капиллярам. При этом определено, что через анастомоз диаметром 40 мкм может пробрасываться в 250 раз больше крови, чем через капилляр такой же длины, но диаметром 10 мкм. Однако, по другим данным, полученным с использованием меченных изотопами микроядер, через артерио-венозные анастомозы проходит только 1-2% величины сердечного выброса.
Диаметр артерио-венозных анастомозов в разных органах колеблется в широких пределах и составляет: в сердце — 70- 170 мкм, в селезенке — 160-170 мкм, в почках — 30-440 мкм, в печени — 100-370 мкм, в тонком кишечнике — 20-180 мкм, в желудке — 40-140 мкм, в легких — 28-500 мкм, в скелетной мускулатуре — 20-40 мкм. Таким образом, диаметр артерио- венозных анастомозов и их "пропускная способность" в разных органах далеко не одинакова,
что объясняется спецификой функций, скоростью метаболизма, величиной кислородного запроса в органах и особенностями строения терминального отдела их сосудистого русла.
Дата добавления: 2016-03-27; просмотров: 1115;
