РЕГУЛЯЦИЯ СВЕРТЫВАНИЯ КРОВИ
Еще в начале нашего века В. Кеннон отметил, что при болевом раздражении, эмоциях страха и гнева, т. е. состояниях, протекающих с возбуждением симпатического отдела вегетативной нервной системы и гиперадреналинемией, свертывание крови ускоряется. Это наблюдается при всех стрессорных воздействиях, ускоряющих гемокоагуля-цию на 25—50 % и более — с 5—10 мин до 3—4 мин. Совершенно ясно, что такое укорочение времени свертывания может быть достигнуто лишь за счет самой продолжительной фазы гемокоагуляции — образования протромбиназы.
Ускорение свертывания крови называют гиперкоагулемией, а замедление — гипокоа-гулемией.
Развитие гиперкоагулемии при активации симпатического отдела вегетативной нервной системы и стрессовых реакциях обусловлено действием адреналина и норадреналина. Ведущей причиной гиперкоагуляции является то, что адреналин освобождает из стенок сосудов тромбопластин, который в кровотоке быстро превращается в тканевую протром-биназу. Под влиянием адреналина из стенок сосудов выделяются также естественные антикоагулянты и активаторы фибринолиза, но определяющим является действие более мощного тромбопластина. Сейчас сосуды считают главным эффектором в регуляции свертывания крови. Эту же задачу выполняют почки и желудочно-кишечный тракт, выводящие из организма избыток прокоагулянтов.
Вторая причина гиперкоагулемии связана с тем, что адреналин прямо в кровотоке активирует фактор Хагемана, являющийся инициатором образования кровяной протромбиназы.
Адреналин активирует тканевые липазы, что усиливает расщепление жиров и приводит к поступлению в кровь жирных кислот, обладающих тромбопластической активностью.
Адреналин усиливает «эффект отдачи» — освобождение фосфолипидов из форменных элементов крови, особенно из эритроцитов.
Гиперкоагулемия достигается за счет расходования факторов свертывания, поэтому после прекращения действия раздражителя на организм она сменяется вторичной гипо-коагулемией. Развитие гиперкоагулемии подготавливает организм к более быстрому образованию сгустка при угрозе травмы или других повреждений.
Раздражение блуждающего нерва (или внутривенное введение ацетилхолина) приводит к выделению из стенок сосудов веществ, аналогичных тем, которые выделяются при действии адреналина. Таким образом, в процессе эволюции в системе гемокоагуляции сформировалась лишь одна защитно-приспособительная реакция — гиперкоагуле-мия, направленная на срочную остановку кровотечения. Идентичность сдвигов гемокоагуляции при возбуждении симпатического и парасимпатического отделов еще раз подтверждает тот факт, что первичной гипокоагулемии не существует. Она всегда вторична и развивается после первичной гиперкоагулемии вследствие использования части факторов свертывания крови.
У здоровых людей ускорение гемокоагуляции, как правило, вызывает вторичную стимуляцию фибринолиза,. что обеспечивает расщепление избытка фибрина, который образуется в результате усиления латентного микросвертывания крови. Активация фибринолиза наблюдается при физической работе, эмоциях, болевом раздражении.
На свертывание крови оказывает влияние кора больших полушарий мозга. Свои воздействия она реализует через вегетативную нервную систему и те эндокринные железы, гормоны которых обладают вазоактивным действием. Расширение и сужение сосудов приводит к освобождению из их стенок тромбопластина, естественных антикоагулянтов и активаторов фибринолиза.
Система свертывания крови входит в состав более обширной системы — системы регуляции агрегатного состояния крови и коллоидов (система PACK), которая поддерживает гомеостаз внутренней среды организма и ее агрегатное состояние на таком уровне, который необходим для нормальной жизнедеятельности. Система PACK обеспечивает поддержание жидкого состояния крови и восстановление свойств стенок сосудов, изменяющихся даже при нормальном их функционировании. Она же поддерживает на оптимальном уровне содержание факторов свертывания на случай катастрофы — повреждения сосудов, органов и тканей.
ГРУППЫ КРОВИ
В практике врача часто возникает необходимость в возмещении потерянной крови (после кровопотери, при некоторых отравлениях, при хронических инфекциях и по другим медицинским показаниям). В прошлом попытки переливания крови нередко приводили к тяжелым нарушениям, вплоть до смерти больных.
Причины осложнений при переливании крови были выяснены в начале нашего века. В 1901 г. австриец К. Ландштейнер и в 1903 г. чех Я. Янский обнаружили, что при смешивании крови разных людей часто наблюдается склеивание эритроцитов друг с другом — явление агглютинации. Это зависит от наличия в эритроцитах агглютинируемых факторов — агглютиногенов А и В. В эритроцитах они могут быть по одному или вместе, либо отсутствовать.
Одновременно было установлено, что в плазме находятся агглютинирующие агенты, которые склеивают эритроциты. Указанные вещества названы агглютининами « и ?. В крови разных людей содержится либо один, либо два, либо ни одного агглютинина. При переливании несовместимой крови эритроциты не только склеиваются, но и разрушаются (гемолиз). Последнее связано с тем, что в плазме, помимо агглютининов, находятся одноименные гемолизины.
• Агглютиноген А и агглютинин к, а также Вир называются одноименными. Склеивание эритроцитов происходит в том случае, если эритроциты донора (человека, дающего кровь) встречаются с одноименными агглютининами реципиента (человека, получающего кровь): А+«, В+Р или АВ+«Р- Отсюда ясно, что в крови каждого человека находятся разноименные агглютиноген и агглютинин.
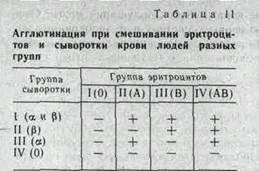
У людей имеется 4 комбинации агглютиногенов и агглютининов системы АВО. Они обозначаются следующим образом: 1(0) —ар, П(А) —Ар, П1(В) —Ва и IV (АВ). Из этих обозначений следует, что. у людей I группы эритроциты не содержат агглютиногенов АВ, а в плазме имеются оба агглютинина. У людей II группы эритроциты имеют агглютиноген А, а плазма — агглютинин р. К III группе относятся люди, у которых в эритроцитах находится агглютиноген Вив плазме — агглютинин ю. Кровь людей IV группы характеризуется наличием в эритроцитах обоих агглютиногенов и отсутствием в плазме агглютининов.
В табл. 11 показано, когда возникает агглютинация (обозначено знаком -)-) при смешивании эритроцитов и сыворотки крови людей разных групп. Людям I группы можно переливать кровь только этой группы. Кровь же I группы можно переливать людям всех групп. Поэтому людей с I группой крови называют универсальными донорами. Людям IV группы можно переливать кровь всех групп, поэтому этих людей называют универсальными реципиентами. Кровь же IV группы можно переливать людям с кровью IV группы. Кровь людей II и III групп можно переливать людям с одноименной, а также с IV группой крови. Указанные закономерности отражены на рис. 113.
|

|
| Выяснение причин агглютинации позволило сформулировать два основных правила переливания крови: 1) необходимо подбирать кровь так, чтобы избежать встречи одноименных агглютиногенов донора с одноименными агглютининами реципиента, т. е. плазма реципиента должна быть пригодна для жизни перелитых эритроцитов; 2) агглютинины донора в расчет не принимаются — это так называемое правило разведения, которое пригодно при переливании небольших количеств крови. Агглютинины весьма неустойчивы к разведению, поэтому при вливании небольших количеств крови (200—500 мл) их концентрация в 5 л крови реципиента резко падает, и они не могут склеить эритроциты реципиента. Прогрессивное развитие хирургии, трансфузиоло-гии и гематологии заставило отказаться от этих правил и перейти к переливанию только одногруппной крови. Даже переливание «универсальной» крови I группы допускается в исключительных случаях и только в небольших количествах (не более 500 мл). Одной из причин отказа от классических правил явилось то, что при ряде хирургических операций (особенно в грудной хирургии) производят массивные гемотрансфузии. Если человеку с IV группой влить 4-5 л крови I группы, то разведения агглютининов донора не происходит и они склеивают эритроциты реципиента. Другой причиной отказа от классических правил послужило то, что при тщательном изучении людей с кровью I группы были обнаружены иммунные агглютинины анти-А и анти-В. Такие агглютинины имеются у 10—20 % людей с I группой крови. Переливание такой крови людям с другими группами крови вызывает тяжелые осложнения, поэтому людей с I группой крови, содержащих агглютинины анти-А и анти-В, сейчас называют опасными универсальными донорами., Переливание несовместимой крови может вызвать гемотрансфузионный шок, нередко приводящий к смерти. Одним из механизмов развития данного со- |

|
| Рис.114. Определение групп крови. Сверху — положение на стекле двух капель исследуемой крови и капель сыворотки II и III группы. Римскими цифрами обозначены группы сыворотки крови. I — агглютинации сывороткой I! и III группы не происходит—кровь I группы; 2 — агглютинация происходит сывороткой III группы — кровь II группы; 3 — агглютинация происходит сывороткой II группы — кровь III группы; 4 — кровь агглютинируется сывороткой II и III групп — кровь IV группы. |
стояния является то, что при разрушении склеенных эритроцитов выделяются их факторы свертывания, в том числе тромбопластин. Он вызывает внутрисосудистое свертывание крови и блокаду микроциркуляторных сосудов всех органов и тканей образовавшимися фибриновыми и тромбоцитарными тромбами.
Группу крови определяют путем смешивания капли крови исследуемого человека со стандартными сыворотками, содержащими известные агглютинины. Для этого достаточно иметь две сыворотки — II и III группы (но для надежности результатов лучше брать еще сыворотку I группы, где содержатся оба агглютинина), так как при смешивании этих сывороток с исследуемой кровью возникновение агглютинации или ее отсутствие позволяет определить любую группу крови (рис. 114). Несмотря на простоту метода, в 7—10 % случаев группа крови определяется неверно и больным вводят несовместимую кровь. Для избежания такого осложнения перед переливанием крови проводят биологическую пробу на совместимость: вливают вначале 10—15 мл донорской крови и затем в течение 3-5 мин наблюдают за состоянием больного.
При исследовании групп крови в разных странах получены данные о принадлежности людей к той или иной группе крови: I группа — 40—50 %, II группа — 30—40 %, III группа — 10—20 % и IV группа — 5 %. Группы крови передаются по наследству в соответствии с законами генетики и на протяжении жизни не изменяются. Антигены, подобные агглютиногенам А и В, содержатся во всех тканях человека, что используется в судебной медицине и при антропологических исследованиях.
В 1930 г. за открытие групп крови К. Ландштейнер был удостоен Нобелевской премии. Выступая на церемонии вручения премии, он предположил, что в будущем будут открыты новые агглютиногены, а количество группы крови будет расти до тех пор, пока не достигнет числа живущих на земле людей. Это предположение оказалось верным. Только в системе АВО выявлено много вариантов каждого агглютиногена. Так, агглютиноген А существует более чем в 10 вариантах. Различие между ними состоит в том, что а| является самым сильным, а Аа—Ау и другие варианты обладают слабыми агглютинацион-ными свойствами. Поэтому кровь таких лиц может быть ошибочно отнесена к I группе, что может привести к гемотрансфузионным осложнениям при переливании ее больным с I и III группами. Агглютиноген В тоже существует в нескольких вариантах, активность которых убывает в порядке их нумерации.
Среди агглютиногенов, не входящих в систему АВО, одним из первых был обнаружен резус-фактор (или резус-агглютиноген). К. Ландштейнер и И. Винер нашли его в 1940 г. у обезьян макак резус. Этот же агглютиноген содержится у 85% людей (резус-положительная кровь). У 15 % людей он отсутствует (резус-отрицательная кровь). Система резус имеет 6 разновидностей агглютиногенов — D, С, Е, из которых наиболее активен D. Если кровь человека, содержащего резус-фактор, перелить человеку, не имеющего его, то у него образуются иммунные антирезус-агглютинины. Повторное введение такому человеку резус-положительной крови может привести к развитию гемотрансфузионных осложнений.
При браке резус-положительного мужчины с резус-отрицательной женщиной (вероятность такого брака составляет 50%) плод нередко наследует резус-фактор отца. Кровь плода проникает в организм матери, вызывая образование антирезус-агглютининов. Через плаценту они диффундируют в кровь плода, вызывая разрушение эритроцитов и внутрисосудистое свертывание крови. Если концентрация антирезус-агглютининов высока, это приводит к смерти плода и выкидышу. При легких формах резус-несовместимости плод рождается живым, но с гемолитической желтухой.
Резус-конфликт возникает.лишь при высокой концентрации антирезус-агглютининов. Чаще всего первый ребенок рождается нормальным, зато при последующих беременностях угроза резус-конфликта нарастает вследствие образования новых порций антирезус-агглютининов. Резус-несовместимость при беременности встречается часто — 1 случай на 700 родов. Во Франции она является причиной 3000—5000 выкидышей в год. Поэтому будущих резус-несовместимых супругов предупреждают о возможных последствиях.
К настоящему времени в эритроцитах человека обнаружено более 200 различных агглютиногенов, 140 из которых объединены в 20 систем (групп), а остальные являются общими или индивидуальными. Это определяет удивительную антигенную неповторимость в природе, и в этом смысле каждый человек имеет свою группу крови. Данные системы агглютиногенов отличаются от системы АВО тем, что не содержат в плазме естественных агглютининов, подобных а- и (^агглютининам. Но при определенных условиях к этим агглютиногенам могут вырабатываться иммунные антитела-агглютинины.
Среди систем агглютиногенов, существующих помимо системы АВО, наиболее важны Rh, М, N, S, Р и А и многие другие. В каждой из этих систем имеется один или несколько агглютиногенов, составляющих разные комбинации, т. е. группы крови данных систем. Они находятся в эритроцитах независимо от системы АВО и друг от друга.
Система Келл — Челлано состоит из двух агглютиногенов — Кик, они образуют 3 группы крови — КК, кк и Кк. Эта система имеется у 100% людей. Система Кидд имеет два агглютиногена — Jk" и Jk1', которые образуют 3 группы крови:
встречаются либо по одному, либо оба агглютиногена. Иммунные антитела к ним появлялись при очень частых переливаниях крови, несовместимой по этим агглютиногенам.
Система Лютеран тоже состоит из двух агглютиногенов — Lua и Lub, которые образуют 3 группы крови этой системы.
Система Даффи имеет два агглютиногена — Fya и Fyb, которые образуют 3 группы крови этой системы.
Система Диего имеет один агглютиноген — Di. Он найден у 36% индейцев Южной Америки, по нему существует 2 группы крови.
Все эти системы агглютиногенов имеют значение лишь при частых переливаниях крови или при беременности, несовместимой по какому-то из этих агглютиногенов. Поэтому повторно переливать больному кровь одного и того же донора не рекомендуется.
ФОРМЕННЫЕ ЭЛЕМЕНТЫ КРОВИ
ЭРИТРОЦИТЫ
Эритроциты, или красные кровяные тельца, представляют собой клетки, которые у человека и млекопитающих не имеют ядра.
В крови у мужчин содержится в среднем б-Ю^/л эритроцитов (6000000 в 1 мкл), у женщин—около 4,5•1012/л (4 500 000 в 1 мкл).
Во всей крови человека содержится 25 трлн. красных кровяных телец. Если уложить это количество эритроцитов рядом Друг с другом, то получится цепочка длиной около 200 000 км, которой можно 5 раз опоясать земной шар по экватору.
Количество эритроцитов изменчиво. Увеличение их числа называют эритроцитозом (эритре-мией), а уменьшение—эритропенией (анемией). Эти сдвиги могут носить абсолютный или относительный характер.
Абсолютный эритроцитоз — увеличение числа эритроцитов в организме — наблюдается при снижении барометрического давления (на высокогорье), у больных с хроническими заболеваниями легких и сердца вследствие гипоксии, которая стимулирует эритропоэз.
Относительный э.ритроцитоз — увеличение числа эритроцитов в единице объема крови без увеличения их общего количества в организме — наблюдается при сгущении крови (при обильном потении, ожогах, холере и дизентерии). Он возникает также при тяжелой мышечной работе вследствие выброса эритроцитов из селезеночного кровяного депо.
Абсолютная эритропения развивается вследствие пониженного образования, усиленного разрушения эритроцитов или после кровопотери.
Относительная эритропения возникает при разжижении крови за счет быстрого увеличения жидкости в кровотоке.
Диаметр отдельного эритроцита равен 7,2—7,5 мкм, толщина — 2,2 мкм, а объем — около 90 мкм3. Общая поверхность всех эритроцитов достигает 3000 м2, что в 1500 раз превышает поверхность тела человека. Такая большая поверхность эритроцитов обусловлена их большим числом и своеобразной формой. Они имеют форму двояковогнутого диска, при поперечном разрезе напоминают гантели. При такой форме в эритроцитах нет ни одной точки, которая отстояла бы от поверхности более чем на 0,85 мкм. Если бы они имели форму шара, то центр клетки находился бы от поверхности на расстоянии 2,5 мкм, а общая площадь эритроцитов была бы на 20 % меньше. Такие соотношения поверхности и объема способствуют оптимальному выполнению основной функции эритроцитов — переносу кислорода от органов дыхания к клеткам организ'ма.
Эритроциты млекопитающих — безъядерные образования. Лишение ядра привело к тому, что эритроцит потребляет в 200 раз меньше кислорода, чем его ядерные предста-дии (эритробласты и нормобласты). Снабжая кислородом весь организм, эритроциты тратят на себя ничтожную часть переносимого ими кислорода.
В структуре эритроцитов различают строму — остов клетки и поверхностный слой — мембрану. Мембрана эритроцитов состоит из двух слоев фосфолипидов, снаружи и внутри от которых расположены мономолекулярные слои белков. В отличие от мембран всех клеток организма, мембрана эритроцитов малопроницаема для катионов Na4' и К4', зато легкопроницаема для анионов НСОз" и С1~, а также для Ог, СОа, ионов Н^^и ОН". Минеральный состав эритроцитов и плазмы неодинаков: в эритроцитах человека больше К, чем Na. В плазме же имеется обратное соотношение этих ионов. Около 90 % сухого вещества эритроцитов составляет гемоглобин, остальные 10 % — другие белки, липиды, глюкоза и минеральные соли.
Большая суммарная поверхность эритроцитов и их постоянное движение по организму способствует тому, что кроме транспорта газов они являются идеальными переносчиками веществ, осуществляющих межклеточные взаимодействия — креаторные связи, обеспечивающие сохранение структуры органов и тканей. Доказано, например, что при повреждении печени у крыс эритроциты начинают транспортировать из костного мозга в печень нуклеотиды, пептиды и аминокислоты, восстанавливающие структуру органа.
Гемоглобин
Гемоглобин является основной составной частью эритроцитов и обеспечивает дыхательную функцию крови, являясь дыхательным ферментом. Он находится внутри эритроцитов, а не в плазме крови, что: а) обеспечивает уменьшение вязкости крови (растворение такого же количества гемоглобина в плазме повысило бы вязкость крови в несколько раз и резко затруднило бы работу сердца и кровообращение); б) уменьшает онкотическое давление плазмы, предотвращая обезвоживание тканей; в) предупреждает потерю организмом гемоглобина вследствие его фильтрации в клубочках почек и выделения с мочой.
По химической структуре гемоглобин представляет собой хромопротеид. Он состоит из белка глобина и простетической группы гема. В молекуле гемоглобина содержится одна молекула глобина и 4 молекулы гема. Гем имеет в своем составе атом железа, способный присоединять и отдавать молекулу Оа. При этом валентность железа не изменяется, т. е. оно остается двухвалентным. Железо входит в состав всех дыхательных ферментов тканей. Такая важная роль железа в дыхании определяется строением его атома — большим числом свободных электронов, способностью к комплексообразованию и к участию в реакциях окисления-восстановления.
В крови здоровых мужчин содержится в среднем 14,5 г% гемоглобина (145 г/л) с колебаниями от 13 до 16 (130—160 г/л). В крови женщин находится около 13 г% (130 г/л по системе СИ) с колебаниями от 12 до 14 %.
Идеальным количеством считается 160,7 г/л (16,67 г %) гемоглобина.
В клинике часто определяют цветовой показатель — относительное насыщение эритроцитов гемоглобином. В норме он составляет 0,8—1. Эритроциты, имеющие такой показатель, называют нормохромными. Если показатель больше 1, то эритроциты называют гиперхромными, а если меньше 0,8 — гипохромными.
Гемоглобин синтезируется эритробластами и нормобластами костного мозга. При разрушении эритроцитов гемоглобин после отщепления гема превращается в желчный пигмент билирубин. Последний с желчью поступает в кишечник, где превращается в стеркобилин и уробилин, выводимые с калом и мочой. За сутки разрушается и превращается в желчные пигменты около 8т гемоглобина, т. е. около 1 % гемоглобина, находящегося в крови.
Гемоглобин человека имеет несколько разновидностей. В первые 7—12 нед внутриутробного развития зародыша его красные кровяные тельца содержат НЬР (примитивный). На 9-й неделе в крови зародыша появляется HbF (фетальный), а перед рождением—НЬА (гемоглобин взрослых). В течение первого года жизни фетальный гемоглобин почти полностью заменяется гемоглобином взрослых. Весьма существенно, что фетальный НЬ обладает более высоким сродством к С>2, чем гемоглобин взрослых, что позволяет ему насыщаться при более низком напряжении кислорода. Гем разных гемоглобинов одинаков, глобины же отличаются по своему аминокислотному составу и свойствам.
В норме гемоглобин содержится в виде 3 физиологических соединений. Гемоглобин, присоединивший кислород, превращается в оксигемоглобин — НЬ02. Это соединение по цвету отличается от гемоглобина, поэтому артериальная кровь имеет ярко-алый цвет. Оксигемоглобин, отдавший кислород, называют восстановленным или дезоксиге-моглобином (НЬ). Он находится в венозной крови, которая имеет более темный цвет, чем артериальная. Кроме того, в венозной крови содержится соединение гемоглобина с углекислым газом — карбгемоглобин, который транспортирует С02 из тканей к легким.
Гемоглобин и оксигемоглобин неодинаково поглощают световые лучи длиной 620—680 мкм, что легло в основу метода оценки насыщения крови кислородом — оксигемометрии. По этому методу ушную раковину или кювету с кровью просвечивают электрической лампочкой и с помощью фотоэлемента определяют интенсивность световых волн указанной длины, проходящих через ткань уха или кювету с кровью. По показаниям фотоэлемента определяют насыщение гемоглобина кислородом (Е. М. Крепе).
Гемоглобин обладает способностью образовывать и патологические соединения. Одним из них является карбоксигемоглобин — соединение гемоглобина с угарным газом (НЬСО). Сродство железа гемоглобина к СО превышает его сродство к Ог, поэтому даже 0,1 % СО в воздухе ведет к превращению 80 % гемоглобина в НЬСО, который неспособен присоединять кислород, что является опасным для жизни.
Слабое отравление угарным газом — обратимый процесс. При дыхании свежим воздухом СО постепенно отщепляется. Вдыхание чистого кислорода увеличивает скорость расщепления НЬСО в 20 раз.
Метгемоглобин (MetHb) тоже патологическое соединение, является окисленным гемоглобином, в котором под влиянием сильных окислителей (феррицианид, перманганат калия, амил- и пропилнитрит, анилин, бертолетовая соль, фенацетин) железо гема из двухвалентного превращается в трехвалентное. При накоплении в крови больших количеств метгемоглобина транспорт кислорода тканям нарушается и может наступить смерть.
Миоглобин. В скелетных мышцах и миокарде находится мышечный гемоглобин, называемый миоглобином. Его простетическая группа идентична гемоглобину крови, а белковая часть — глобин — обладает меньшей молекулярной массой.
Миоглобин человека связывает до 14 % общего количества кислорода в организме. Это его свойство играет важную роль в снабжении работающих мышц. При сокращении мышц их кровеносные капилляры сдавливаются, и кровоток уменьшается либо прекращается. Однако благодаря наличию кислорода, связанного с миоглобином, в течение некоторого времени снабжение мышечных волокон кислородом сохраняется.
Гемолиз
Гемолизом называют разрушение оболочки эритроцитов, сопровождающееся выходом из них гемоглобина в плазму крови, которая окрашивается при этом в красный цвет и становится прозрачной («лаковая кровь»).
Разрушение эритроцитов может быть вызвано уменьшением осмотического давления, .что вначале приводит к набуханию, а затем к разрушению эритроцитов,— это так называемый осмотический гемолиз. Мерой осмотической стойкости (резистентности) эритроцитов является концентрация Nad, при которой начинается гемолиз. У человека это происходит в 0,4 % растворе, а в 0,34 % растворе разрушаются все эритроциты. При некоторых заболеваниях осмотическая стойкость эритроцитов уменьшается, и гемолиз наступает при больших концентрациях NaCI в плазме.
Химический гемолиз происходит под влиянием веществ, разрушающих белково-липидную оболочку эритроцитов (эфир, хлороформ, алкоголь, бензол, желчные кислоты, сапонин и Др.).
Механический гемолиз возникает при сильных механических воздействиях на кровь, например, сильном встряхивании ампулы с кровью.
Термический гемолиз наблюдается при замораживании и размораживании крови.
Биологический гемолиз, развивается при переливании несовместимой крови, при укусах некоторых змей, под влиянием иммунных гемолизинов и т. д.
Скорость оседания эритроцитов (СОЭ)
При стоянии крови, не свертывающейся вследствие добавления антикоагулянтов, наблюдается оседание эритроцитов.
Для исследования СОЭ кровь смешивают с раствором лимоннокислого натрия и набирают в стеклянную трубочку с; миллиметровыми делениями. Через час отсчитывают высоту верхнего прозрачного слоя. , '
Оседание эритроцитов в норме у мужчин равно 1—10 мм в час, у женщин—2— 15 мм в час. Увеличение скорости оседания больше указанных величин является признаком патологии.
Величина СОЭ зависит от свойств плазмы, в первую очередь от содержания в ней крупномолекулярных белков — глобулинов и особенно фибриногена. Концентрация последних возрастает.при всех воспалительных процессах, поэтому у таких больных СОЭ обычно превышает норму. При беременности содержание фибриногена перед родами почти в 2 раза больше нормы, и СОЭ достигает 40—50 мм/час. По-видимому, крупно-молекулярные белки уменьшают электрический заряд и явления электроотталкивания клеток крови, что способствует большей скорости оседания эритроцитов (образованию более длинных «монетных столбиков»).
ЛЕЙКОЦИТЫ
Лейкоциты, или белые кровяные тельца, играют важную роль в защите организма от микробов, вирусов, от патогенных простейших, любых чужеродных веществ, т. е. они обеспечивают иммунитет.
Иммунитет — это способ защиты организма от микробов, вирусов, паразитов и генетически чуждых клеток и веществ. Различают противомикробный, противовирусный, противопаразитарный, противоопухолевый, противотрансплантационный и другие виды иммунитета. Иммунитет осуществляется разными механизмами, которые делят на неспецифические и специфические.
К неспецифическим механизмам относятся кожа и слизистые оболочки, осуществляющие барьерные функции, выделительная функция почек, кишечника и печени, лимфатические узлы. Лимфатические узлы представляют фильтр для оттекающей от тканей лимфы. Попадающие в лимфу бактерии, их токсины и другие вещества нейтрализуются и уничтожаются клетками лимфатических узлов. На пути от тканей в кровеносное русло лимфа проходит несколько таких фильтров и поступает в кровь очищенной.
К неспецифическим механизмам принадлежат также защитные вещества плазмы крови, воздействующие на вирусы, микробы и их токсины. Такими веществами являются гамма-глобулины (нормальные антитела), нейтрализующие микробы и их токсины, а также обладающие опсонирую-щим действием (облегчение поглощения и переваривания бактерий фагоцитами); интерферон, инактивирующий действие многих вирусов; лизоцим (фермент мурамидаза), продуцируемый лейкоцитами и разрушающий, грамположительные микробы (стафилококки, стрептококки и др.);
пропердин, осуществляющий разрушение грамотрицательиых микробов, некоторых простейших, инактивацию вирусов, лизис аномальных и поврежденных клеток организма; бета-лизины (катион-ные белки), выделяемые тромбоцитами и обладающие бактерицидным действием на грамположительные спорообразующие бактерии (возбудителей столбняка, газовой гангрены и др.); система комплемента, состоящая из 11 компонентов (белков-ферментов), вырабатываемых моноцитами и макрофагами, обеспечивающими освобождение организма от микробов, отторжение трансплантата, элиминацию опухолевых и других измененных клеток, цитолитическое действие, активацию свертывания крови путем влияния на тромбоциты и фактор Хагемана, взаимодействие с калли-креин-кининовой системой, регулирующей проницаемость и тонус сосудов, участие в защитных воспалительных реакциях.
Среди неспецифических факторов защиты существуют также клеточные механизмы. Одним из них является фагоцитоз (от гр. phagos — пожирающий, kytos — клетка) — поглощение клетками чужеродных частиц и их внутриклеточное переваривание. Явление фагоцитоза открыл И. И. Мечников, за что он в 1908 г. был удостоен Нобелевской премии. Он назвал клетки, способные к фагоцитозу, фагоцитами и разделил их на микрофаги (нейтрофилы, эозинофилы, базофилы крови) и макрофаги (моноциты крови, гистиоциты, купферовские клетки печени, альвеолярные макрофаги, макрофаги лимфатических узлов, селезенки и др.). Решением Всемирной организации здравоохранения (ВОЗ) в 1973 г. все фагоцитирующие мононуклеарные клетки объединены в так называемую мононуклеарную фагоцитарную систему (МФС). Этот термин заменил старое расплывчатое название—ретикулоэндотелиальная система (РЭС).
Специфические механизмы иммунитета обеспечиваются лимфоцитами, которые создают специфический гуморальный (образование защитных белков — антител или иммуноглобулинов) и клеточный (образование иммунных лимфоцитов) иммунитет в ответ на действие определенных чужеродных агентов — антигенов.
У взрослых кровь содержит 4—9-10'Ул (4000—9000 в 1 мкл) лейкоцитов, т. е. их в 500—1000 раз меньше, чем эритроцитов. Увеличение их количества называют лейкоцитозом, а уменьшение — лейкопенией.
Лейкоциты делят на 2 группы: гранулоциты (зернистые) и агранулоциты (незернистые). В группу гранулоцитов входят нейтрофилы, эозинофилы и базофилы, а в группу агранулоцитов — лимфоциты и моноциты.
При оценке изменений количества лейкоцитов в клинике решающее значение придается не столько изменениям их количества, сколько изменениям взаимоотношений. Процентное соотношение отдельных форм лейкоцитов называют лейкоцитарной формулой (лейкоформулой), или лейкограммой. В последние 30—40 лет лейкоцитарная формула заметно изменилась (табл. 12). У здоровых людей лейкограмма довольно постоянна и ее изменения служат признаком различных заболеваний. Нейтрофилы — самая большая группа белых кровяных телец, они составляют 50—75 % всех лейкоцитов. Свое название они получили за способность их зернистости окрашиваться нейтральными красками. В зависимости от формы ядра нейтрофилы делятся на юные (метамиелоциты), палочкоядерные и сегментоядерные.
В лейкоформул'е юные составляют не более 1 %, палочкоядерные — 1—5 %, сегментоядерные—45—70%. При ряде заболеваний содержание молодых нейтрофилов увеличивается. О соотношении молодых и зрелых форм нейтрофилов судят по величине так называемого сдвига влево (или индекса регенерации). Такое название дано потому, что в бланке леикограммы нейтрофилы распределены по степени их зрелости слева направо. Этот сдвиг вычисляют по отношению миелоцитов, юных и палочкоядерных форм к количеству сегментоядерных. В норме этот показатель равен 0,05—0,1. При тяжелых инфекционных заболеваниях и воспалительных процессах.он может достигать I—2. По степени сдвига судят о тяжести болезни и реакции организма на нее.
В крови циркулирует не более 1 % имеющихся в организме нейтрофилов. Основная их часть сосредоточена в тканях. Наряду с этим в костном мозге имеется резерв, превосходящий число циркулирующих нейтрофилов в 50 раз. Выброс их в кровь происходит по «первому требованию» организма.
Основная функция нейтрофилов — защита организма от проникших в него микробов и их токсинов. Нейтрофилы первыми пребывают в место повреждения тканей, т. е. являются авангардом лейкоцитов. Их появление в очаге воспаления связано со способностью к активному передвижению. Они выпускают псевдоподии, проходят через стенку капилляров и активно перемещаются в тканях к месту проникновения микробов. Скорость их движения достигает 40 мкм в минуту, что в 3—4 раза превышает диаметр клетки. Выход лейкоцитов в ткани называют миграцией. Контактируя с живыми или мертвыми микробами, с разрушающимися клетками собственного организма или чужеродными частицами, нейтрофилы фагоцитируют их, переваривают и уничтожают за счет собственных ферментов и бактерицидных веществ. Один нейтрофил способен фагоцити-ровать 20—30 бактерий, но при этом может погибнуть сам (в таком случае бактерии продолжают размножаться).
Кроме фагоцитоза, нейтрофилы осуществляют и другие противомикробные реакции. Они секретируют в окружающую среду лизосомные катионные белки и гистоны. Противовирусное действие нейтрофилы осуществляют путем продукции интерферона. Функцию нейтрофилов усиливает или угнетает ряд физиологически активных веществ:
адреналин, ацетилхолин, гормоны, компоненты комплемента и др. Их активность зависит также от продуктов жизнедеятельности токсинов микробов.
Эозинофилы составляют 1—5 % всех лейкоцитов. Зернистость в их цитоплазме окрашивается кислыми красками (эозином и др.), что и определило их название. Эозинофилы обладают фагоцитарной способностью, но из-за малого количества в крови их роль в этом процессе невелика. Основная функция эозинофилов заключается в обезвреживании и разрушении токсинов белкового происхождения, чужеродных белков, комплексов антиген — антитело. Эозинофилы фагоцитируют гранулы базофилов и тучных клеток, которые содержат много гистамина. Эозинофилы продуцируют фермент гиста-миназу, разрушающую поглощенный гистамин.
Ассимиляция и нейтрализация гистамина эозинофилами уменьшает изменения в очаге воспаления. При аллергических состояниях, глистной инвазии и антибактериальной терапии количество эозинофилов возрастает. Это связано с тем, что при данных состояниях разрушается (дегранулирует) большое количество тучных клеток и базофилов, из которых освобождается очень много гистамина, для нейтрализации которого необходимы эозинофилы. Одной из функций эозинофилов является выработка плазминогена, что определяет их участие в процессе фибри-нолиза.
Базофилы (0—1 % всех лейкоцитов) представляют самую малочисленную группу гранулоцитов. Их крупная зернистость окрашивается основными красками, за что они и получили свое название. Функции базофилов обусловлены наличием в них биологически активных веществ. Они, как и тучные клетки соединительной ткани, продуцируют гистамин и гепарин, поэтому эти клетки объединены в группу гепариноцитов. Количество базофилов нарастает во время регенеративной (заключительной) фазы острого воспаления и немного увеличивается при хроническом воспалении. Гепарин базофилов препятствует свертыванию крови в очаге воспаления, а гистамин расширяет капилляры, что способствует рассасыванию и заживлению.
Значение базофилов возрастает при различных аллергических реакциях, когда из них и тучных клеток под влиянием комплекса антиген — антитело освобождается гистамин, который определяет клинические проявления крапивницы, бронхиальной астмы и других аллергических заболеваний.
Моноциты составляют 2—10 % всех лейкоцитов, способны к амебовидному движению, проявляют выраженную фагоцитарную и бактерицидную активность. Моноциты фагоцитируют до 100 микробов, в то время как нейтрофилы — лишь 20—30. Моноциты появляются в очаге воспаления после нейтрофилов и проявляют максимум активности в кислой среде, в которой нейтрофилы теряют свою активность. В очаге воспаления моноциты фагоцитируют микробы, а также погибшие лейкоциты, поврежденные клетки воспаленной ткани, очищая очаг воспаления и подготавливая его для регенерации. За эту функцию моноциты называют «дворниками организма».
Моноциты—центральное звено мононуклеарной фагоцитарной системы (МФС). Отличительными признаками элементов этой системы является способность к фагоцитозу и пиноцитозу, наличие рецепторов для антител и комплемента, общность происхождения и морфологии. После миграции моноцитов в ткани они превращаются в макрофаги. Кроме фагоцитоза, макрофаги участвуют в формировании специфического иммунитета. Поглощая чужеродные вещества, они перерабатывают их и переводят в особое соединение — иммуноген, который совместно с лимфоцитами формирует специфический иммунный ответ.
Макрофаги участвуют в процессах воспаления и регенерации, в обмене липидов и железа, обладают противоопухолевым и противовирусным действием. Это связано с тем, что они секрети-руют лизоцим, комплемент, интерферон, эластазу, коллагеназу, активатор плазминогена, фибро-генный фактор, усиливающий синтез коллагена и ускоряющий формирование фиброзной ткани.
Лимфоциты составляют 20—40 % белых кровяных телец. У взрослого человека содержится 10'2 лимфоцитов общей массой 1,5 кг. Лимфоциты в отличие от всех других лейкоцитов способны не только проникать в ткани, но и возвращаться обратно в кровь. Они отличаются от других лейкоцитов и тем, что живут не несколько дней, а 20 и более лет (некоторые на протяжении всей жизни человека).
Лимфоциты представляют центральное звено иммунной системы организма. Они отвечают за формирование специфического иммунитета и осуществляют функцию иммунного надзора («цензуры») в организме, обеспечивая защиту от всего чужеродного и сохраняя генетическое постоянство внутренней среды. Лимфоциты обладают удивительной способностью различать в организме «свое» и «чужое» вследствие наличия в их оболочке специфических участков — рецепторов, активирующихся при контакте с чужеродными белками. Лимфоциты осуществляют синтез защитных антител, лизис чужеродных клеток, обеспечивают реакцию отторжения трансплантата, иммунную память (способность отвечать усиленной реакцией на повторную встречу с чужеродным антигеном), уничтожение собственных мутантных клеток и др.
Каждая из перечисленных функций осуществляется специализированными формами лимфоцитов. Все лимфоциты делят на 3 группы: Т-лимфоциты (тимусзависимые), В-лимфоциты (бурсазависимые) и нулевые.
Т-лимфоциты возникают в костном мозге из клеток-предшественников, проходят дифференцировку в вилочковой железе (thymus) и затем расселяются в лимфатических узлах, селезенке или циркулируют в крови, где на их долю приходится 40—70 % всех лимфоцитов.
Различают несколько форм Т-лимфоцитов, каждая из которых выполняет определенную функцию. Клетки-хелперы (помощники) взаимодействуют с В-лимфоцитами, превращая их в плазматические клетки. Клетки-супрессоры (угнетатели) блокируют чрезмерные реакции В-лимфо-цитов и поддерживают постоянное соотношение разных форм лимфоцитов. Клетки-киллеры (убийцы) непосредственно осуществляют реакции клеточного иммунитета. Они взаимодействуют с чужеродными клетками и разрушают их. Таким способом клетки-киллеры разрушают опухолевые клетки, клетки чужеродных трансплантатов, клетки-мутанты, что сохраняет генетический гомеостаз. Одна клетка-киллер убивает одну чужеродную клетку. Клетки-киллеры выделяют медиаторы иммунитета, или лимфокины, которые разрушают чужеродные клетки путем активации их лизосомальных ферментов или с помощью макрофагов. Среди Т-лимфоцитов выделяют также клетки иммунной памяти и клетки-амплифайеры, активирующие клетки-киллеры.
Т-лимфоциты играют ведущую роль в иммунном надзоре. При ослаблении их функций возрастает опасность развития опухолей, аутоиммунных заболеваний (когда собственные ткани организма воспринимаются как чужие), повышается склонность к разным инфекциям.
В-лимфоциты образуются в костном мозге, но у млекопитающих проходят диффе-ренцировку в лимфоидной ткани кишечника, червеобразного отростка, небных и глоточных миндалин. В крови на их долю приходится 20—30 % циркулирующих лимфоцитов. Основная функция В-лимфоцитов — создание гуморального иммунитета путем выработки антител. После встречи с антигеном В-лимфоциты мигрируют в костный мозг, селезенку и лимфатические узлы, где они размножаются и трансформируются в плазматические клетки, которые являются продуцентами антител — иммунных "углобулинов.
В-лимфоциты очень специфичны: каждая их группа (клон) реагирует лишь с одним антигеном и отвечает за выработку антител только против него. Среди В-лимфоцитов тоже существует специализация. Bi-клетки образуют антитела к чужеродным полисахаридам. Вуклетки при участии Т-хелперов создают гуморальный иммунитет против чужеродных белков. Ву-клетки или К-клетки обладают цитотоксической активностью, т. е. представляют собой В-киллеры.
Нулевые лимфоциты не проходят дифференцировки в органах иммунной системы, но при необходимости способны превратиться в В- или Т-лимфоциты. На их долю приходится 10—20 % лимфоцитов крови.
Под действием чужеродного агента лимфоциты способны трансформироваться в бласты (бласттрансформация) — молодые недифференцированные клетки, которые затем превращаются в зрелые клетки (плазматические клетки и иммунные лимфоциты).
Лимфоциты обеспечивают целостность организма не только путем защиты его от чужеродных агентов. Эти клетки несут макромолекулы с информацией, необходимой для управления генетическим аппаратом других клеток организма. Это имеет важное значение в процессах роста, дифференцировки, регенерации и т. д. Путем таких межклеточных взаимодействий, получивших название креаторных связей, восстанавливается и поддерживается целостность организма.
Лейкоциты — одна из самых реактивных клеточных систем организма, поэтому их количество и качество изменяется при самых различных воздействиях. Чаще всего реакция лейкоцитов на разные влияния проявляется лейкоцитозом. Различают два вида лейкоцитозов — физиологические и реактивные. Первые по своей природе являются перераспределительными, т. е. обусловлены перераспределением лейкоцитов между сосудами разных органов и тканей. Чаще всего оно обусловлено раздепонированием лейкоцитов, находящихся в селезенке, костном мозге и легких, что объясняет быстроту развития подобных лейкоцитов. Существуют следующие виды физиологических лейкоцитозов: а) пищеварительный — возникает после еды; б) миогенный — наблюдается после тяжелой физической работы; в) эмоциональный: г) при болевых воздействиях. Характерными признаками перераспределительных лейкоцитозов является небольшое увеличение числа лейкоцитов, отсутствие изменений лейкоформулы и кратковременность.
Реактивные, или истинные, лейкоцитозы развиваются при воспалительных процессах и инфекционных заболеваниях. Они представляют собой реакцию организма на болезнетворные воздействия.
Реактивные лейкоцитозы обусловлены усилением продукции лейкоцитов органами кроветворения. Число белых кровяных телец при них увеличивается намного больше, чем при перераспределительных лейкоцитозах. Но главное различие между данными видами лейкоцитозов заключается в том, что при реактивных лейкоцитозах меняется лейкоцитарная формула. В крови увеличивается количество молодых форм нейтрофилов — миелоцитов, юных и палочкоядерных, что указывает на активацию гранулоцитопоэза. По ядерному сдвигу влево оценивают тяжесть заболевания и сопротивляемость организма.
Лейкопения в последние годы встречается гораздо чаще, чем раньше. Если 40— 50 лет назад нижней границей нормы считали 6000 лейкоцитов в 1 мкл крови. (6- ЮУл), то теперь такой границей считают 4•109/л (в ряде стран даже меньше). Уменьшение числа белых кровяных телец объясняют урбанизацией, повышением фоновой радиоактивности, широким применением различных лекарств и другими причинами.
Особенно тяжелая лейкопения, обусловленная поражением костного мозга, наблюдается при лучевой болезни. Падение числа лейкоцитов ниже o.s-io'/a (500 в 1 мкл) приводит, как правило, к смерти. Количественные изменения лейкоцитов, связанные с нарушением лейкопоэза, обычно сопровождаются и изменениями их функциональной активности, которая во многом определяет устойчивость организма к инфекциям.
КРОВЕТВОРЕНИЕ И РЕГУЛЯЦИЯ СИСТЕМЫ КРОВИ
КРОВЕТВОРЕНИЕ
Кроветворение — процесс образования и развития форменных элементов крови. Различают эритропоэз — образование эритроцитов, лейкопоэз — образование лейкоцитов и тромбоцитопоэз — образование кровяных пластинок.
Эритроциты, гранулоциты, моноциты и тромбоциты развиваются в красном костном мозге, который находится в плоских костях и метафизах трубчатых костей. Его масса равна массе печени и составляет 1,5—2 кг. Лимфоциты, кроме костного мозга, образуются в лимфатических узлах, селезенке, лимфоидной ткани кишечника и миндалин.
За сутки образуется и разрушается примерно 200—250 млрд. эритроцитов. Родоначальной клеткой эритропоэза является эритробласт, который последовательно превращается в пронормо-бласт, базофильный, полихроматофильный и оксифильный (ортохромный) нормобласт. На стадии оксифильного нормобласта происходит выталкивание ядра и образование эритроцита-нормоцита. Иногда ядро выталкивается на стадии полихроматофильного нормобласта, из которых образуются ретикулоциты. Эти элементы содержат вещество, которое при окрашивании специальной краской имеет вид сеточки. По своей величине ретикулоцит крупнее эритроцита-нормоцита. Их содержание в крови здорового человека не превышает 1 %. Через 20—40 ч после выхода из костного мозга в кровь ретикулоциты теряют данное вещество и превращаются в зрелые эритроциты-норлюцигы.
Количество ретикулоцитов в крови является показателем интенсивности эритропоэза. Ретику-лоцитоз — показатель активации эритропоэза.
Для образования эритроцитов требуются строительные материалы и стимуляторы этого процесса. Для синтеза гема необходимо железо, суточная потребность в котором составляет 20—25 мг. Почти 95 % этого количества организм получает из гемоглобина разрушающихся эритроцитов и лишь 5 % поступает с пищей (около 1 мг). Железо, которое освобождается при разрушении эритроцитов, используется для образования гемоглобина в костном мозге, а также депонируется в виде ферритина (в печени и слизистой оболочке кишечника) и гемосидерина (в костном мозге, печени, селезенке). В депо находится 1—1,5 г железа, которое расходуется при быстрых изменениях темпа эритропоэза. Транспорт железа из депо и из кишечника, где всасывается железо пищи, осуществляет белок трансферрин (сидерофилин). В костном мозге железо захватывается преимущественно базофильными и полихроматофильными нормобластами.
Образование эритроцитов требует поступления в организм витаминов В\ч и фолие-вой кислоты. Первое из этих веществ примерно в 1000 раз активнее второго. Витамин Bi2 (цианкобаламин) представляет собой внешний фактор кроветворения и поступает в организм с пищей. Он всасывается лишь в том случае, если железы желудка выделяют мукопротеид, называемый внутренним фактором кроветворения. Если это соединение в желудке отсутствует, то всасывание витамина Bi2 нарушается. Фолиевая кислота содержится в растительных продуктах. Эти витамины оказывают взаимодополняющее влияние на эритропоэз. Они необходимы для синтеза нуклеиновых кислот и глобина в ядерных предстадиях эритроцитов.
Для эритропоэза нужен также витамин С, участвующий во всех этапах обмена железа. Он стимулирует всасывание железа из кишечника, способствует образованию гема, усиливает действие фолиевой кислоты.
Витамин Bf, (пиридоксин) влияет на ранние фазы синтеза гема, витамин В, (рибофлавин) необходим для образования липидной стромы эритроцитов, пантотеновая кислота — для синтеза фосфолипидов.
Срок жизни эритроцитов равен в среднем 120 дням. Срок жизни эритроцитов можно определить разными способами. В частности для этого применяют метод меченых атомов. В кровь человека вводят меченые эритроциты, содержащие радиоактивный изотоп хрома "Сг или железа ^Fe и определяют, как быстро меченые эритроциты разрушаются в крови.
Разрушение эритроцитов происходит 3 путями. Одним из них является фрагмен-тоз — разрушение эритроцитов вследствие механической травматизации при циркуляции по сосудам. Полагают, что таким путем гибнут только что вышедшие из костного мозга молодые эритроциты. За счет фрагментоза организм проводит селекцию (выбраковку) механически неполноценных эритроцитов. Значительная часть эритроцитов подвергается фагоцитозу клетками мононуклеарной фагоцитарной системы (МФС), которых особенно много в печени и селезенке. Эти органы называют «кладбищем эритроцитов». Третий путь разрушения — гемолиз. Он происходит потому, что при старении эритроциты становятся сферичнее и гемолизируются прямо в циркулирующей крови.
Разрушение и образование лейкоцитов, так же как и эритроцитов, происходит непрерывно, причем срок жизни разных видов лейкоцитов составляет от нескольких часов до нескольких дней (за исключением лимфоцитов, часть которых живет на протяжении всей жизни человека).
Дата добавления: 2016-03-27; просмотров: 2111;
