КЛАССИФИКАЦИЯ КРОВЕТВОРНЫХ КЛЕТОК
На основании способности с самообновлению, клеточному делению и образованию форменных элементов различных типов кроветворные клетки можно разделить на шесть классов:
I класс - полипотентные стволовые клетки, которые могут образовывать любые форменные элементы и обладают способностью к самообновлению.
II класс – частично детерминированные поли-, или мультипотентные родоначальные клетки, именуемые также полу-стволовыми клетками. Развиваются из СКК, способны к ограниченному самоподдержанию, являются полипотентными, однако прошедшими первый этап коммитирования клетками, т.е. дающими начало форменным элементам нескольких (но не всех) видов. Родоначальные клетки, относящиеся к данному и следующему (III) классам, называют также колониеобразующими единицами (КОЕ), поскольку в экспериментах на летально облученных мышах они способны давать колонии кроветворных клеток в их органах.
Частично детерминированные полипотентные родоначальные клетки включают родоначальную клетку лимфоцитопоэза (КОЕ-Л), родоначальную клетку миелопоэза (КОЕ-ГЭММ), дающую начало гранулоцитам, эритроцитам, моноцитам и мегакариоцитам.
III класс – унипотентные (коммитированные) родоначальные клетки, прошедшие новый этап коммитирования и детерминированные в направлении развития только одного вида форменных элементов. Они обладают низким потенциалом самоподдержания. Эти клетки не идентифицируются морфологически и внешне сходны с малыми лимфоцитами.
Унипотентные (коммитированные) родоначальные клетки включают:
1) родоначальные клетки эритроцитов; 2) родоначальную клетку мегакариоцитов; 3) родоначалыную клетку гранулоцитов (нейтрофильных) и моноцитов, дающую родоначалыгую клетку гранулоцитов (нейтрофильных) и родоначальную клетку моноцитов; 4) родоначальную клетку базофилов; 5) родоначальную клетку эозинофилов; 6) коммитированные клетки лимфоцитопоэза - про-В-лимфоциты и протимоциты.
IV класс - морфологически распознаваемые предшественники (precursors в англоязычной литературе) - бластные формы. Представляют отдельные линии развития форменных элементов. Пролиферативная активность этих клеток ограничена; способностью к самоподдержанию они не обладают. Название класса отражает тот факт, что, хотя морфологически все клетки этого класса сходны друг с другом, их можно идентифицировать при использовании стандартных гематологических методов окраски, не прибегая к выявлению иммуноцитохимических маркеров. Властные формы имеют вид крупных клеток с базофильной цитоплазмой и светлым ядром, в котором хорошо определяются ядрышки.
V класс - созревающие (дифференцирующиеся) клетки. Подвергаются структурной и функциональной дифференцировке, образуя соответствующий вид форменных элементов, в ходе которой они (за исключением лимфоцитов и моноцитов) утрачивают способность к делению.
VI класс - зрелые (дифференцированные) форменные элементы, циркулирующие в крови. Неспособны к делению (за исключением лимфоцитов и моноцитов).

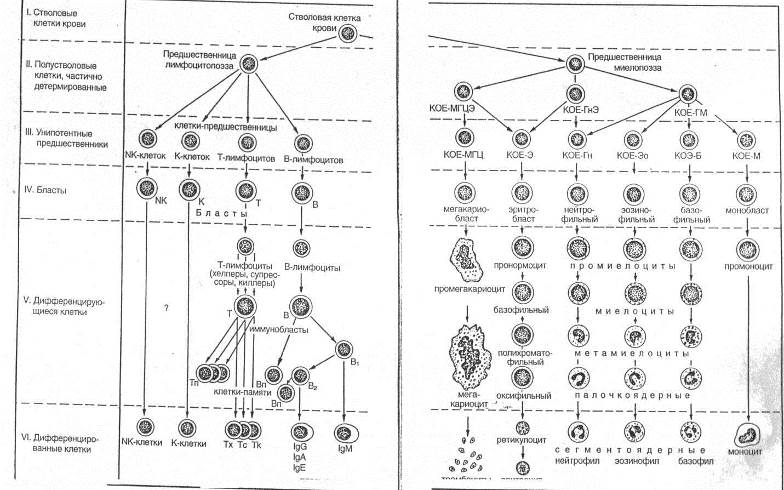
Рис.5.1. Схема кроветворения. Постэмбриональный гемоцитопоэз: КОЕ – колониеобразующие единицы, полустволовые клетки – предшественницы, ГМ - для гранулоцитов и моноцитов, Ги. Э - для нейтрофильных гранулоцитов и эритроцитов; МГЦЭ – для мегариоцитов и эритроцитов;М, Б, Эо, Гн, Э, МГЦ – для моноцитов, базофилов, эозинофилов, нейтрофилов, эритроцитов, мегакариоцитов соответственно.
ЭРИТРОПОЭЗ
Эритропоэз (эритроцитопоэз) процесс образования и созревания эритроцитов, происходящий в миелоидной ткани.
Эритрон - эритроидньй дифферон, представляющий собой совокупность указанных форм – от эритроидных родоначальных клеток до зрелых эритроцитов (включая циркулирующие в крови).
Процесс дифференцировки предшественников эритроцита в зрелые форменные элементы включает:
1) уменьшение размеров клетки;
2) выработку и накопление гемоглобина в цитоплазме;
3) постепенное снижение содержания и в конечном итоге утрату всех органелл;
4) изменение окраски цитоплазмы от интенсивно базофильной (в связи с большим числом полирибосом) до оксифильной (обусловленной присутствием гемоглобина);
5) снижение, а в дальнейшем (в конце стадии оксифильного эритробласта) – утрату способности к делению;
6) конденсацию ядра и его последующее удаление из клетки.
Железо, необходимое для синтеза гема, поступает в цитоплазму эритробластов из двух источников: (1) непосредственно из крови (где оно связано с белком трансферрином) – путем транспорта, опосредованного рецепторами трансферрина на поверхности эритробластов; (2) из цитоплазмы макрофагов, контактирующих с эритробластами и эритробластических островках. Железо в составе ферритина (в комплексе с белком) выделяется на поверхность эритробластов в виде частиц диаметром 6 нм, которые связываются с их гликокаликсом и далее переносятся в их цитоплазму механизмом микропиноцитоза. Небольшие скопления ферритина диаметром 0.1-0.3 мкм (сидеросомы) можно выявить в цитоплазме. Согласно расчетам, второй механизм переносит и 1000 раз больше железа, чем первый.
Длительность всех этапов эритропоэза -от КОЕ-Э до образованиязрелого эритроцита равна около 3-7 сут.
Регуляция процесса эритропоэза. Осуществляется рядом гуморальных факторов, из которых наибольшее значение имеют ИЛ-3 (стимулирует пролиферативную активность КОЕ-Э) и эритропоэтин (усилиливает пролиферацию КОЕ-Э). Для нормального эритропоэза необходимы также железо, фолиевая кислота и витамин В12.
Эритропоэтин продуцируется у взрослого на 90% почкой, на 10% печенью (последняя, однако, служит главным его источником у плода) и вырабатывается в ответ на гипоксию. Его действие усиливается андрогенами, гормоном роста, тироксином и ослабляется эстрогенами (поэтому у женщин содержание эритроцитов и гемоглобина в крови ниже, чем у мужчин).
Применение эритропоэтина в качестве допинга у спортсменов для повышения физической работоспособности основано на увеличении переноса кислорода возросшим числом эритроцитов в крови. Последнее, однако, чревато риском развития тромботических осложнений из-за повышенной вязкости крови.
Тромбоцитопоэз – процесс образования и созревания тромбоцитов, происходящий в миелоидной ткани. Тромбоциты образуются в результате процесса частичной фрагментации цитоплазмы гигантских клеток костного мозга – мегакариоцитов.
Цикл развития от стволовой клетки до формирования тромбоцитов занимает около 10 сут. Тромбоцитопоэз контролируется рядом гуморальных факторов, из которых наибольшее значение имеют КСФ-Мег (стимулирует пролиферацию КОЕ-Мег) и тромбопоэтин (ускоряет созревание мегакариоцитов). Эти гуморальные факторы поддерживают скорость продукции тромбоцитов на необходимом для организма уровне, быстро повышая ее в случае возникающей потребности. Так, через несколько дней после кровопотери с развитием тромбопитопении содержание мегакариоцитов в миелоидной ткани увеличивается в 3-4 раза, а уровни тромбоцитов в крови – в 1.5-2 раза по сравнению с нормой.
Процесс дифференцировки предшественников гранулоцитов в зрелые клетки включает:
1) уменьшение размеров клетки;
2) снижение, а в дальнейшем (со стадии метамиелоцита) – утрату способности к делению;
3) изменение формы ядра – от округлой до бобовидной и палочковидной, его сегментация; нарастание конденсации ядерного хроматина;
4) выработку и накопление гранул в цитоплазме;
5) изменение состава гранул с постепенным увеличением доли специфических гранул и снижением содержания азурофильных;
6) нарастание подвижности клетки, обусловленное перестройкой цитоскелета с увеличением содержания актиновых микрофиламентов;
7) приобретение разнообразных рецепторов плазмолеммы, опосредующих адгезивные взаимодействия с другими клетками и компонентами межклеточного вещества и обеспечивающих важнейшие функции клеток – фагоцитоз, хемотаксис, секреторные реакции.
Цикл развития гранулоцитов в миелоидной ткани включает:
1) стадии, связанные с митотическим делением клеток, – от СКК до миелоцита включительно (длительность – 5-7 сут.);
2) стадии созревания (дифференцировки) постмитотических клеток - начиная с метамиелоцита до сегментоядерных форм (длительность – около 3-4 сут.);
3) накопление структурно зрелых гранулоцитов в костном мозге (длительность - около 4-5 сут.) - создает значительные запасы этих клеток, которые могут выбрасываться костным мозгом при возникновении острой потребности; за счет этой стадии общее количество гранулоцитов в миелоидной ткани в 10 раз превышает их содержание в крови;
4) выделение зрелых клеток в кровь.
После циркуляции в крови в течение нескольких часов гранулоциты мигрируют в периферические ткани, где осуществляют свои функции.
Повышение количества гранулоцитов в крови может осуществляться двумя механизмами:
1. При острой потребности гранулоциты (в особенности, нейтрофильные), быстро мобилизуются из очень обширного пула зрелых клеток, находящихся в миелоидной ткани.
2. При необходимости длительного поддержания высокого уровня этих клеток в крови (например, при бактериальной инфекции) происходит стимуляция пролиферации различных стадий развития гранулоцитов в костном мозге, которая регулируется системным и местным выделением цитокинов (гемопоэтинов).
Регуляция развития гранулоцитов цитокинами осуществляется на различных уровнях и с участием большого количества разнообразных факторов. Наибольшее специфическое стимулирующее влияние оказывают на развитие:
Ø нейтрофильных гранулоцитов – Г-КСФ и ГМ-КСФ;
Ø эозинофильных гранулоцитов – ИЛ-5 и ГМ-КСФ;
Ø базофильных гранулоцитов – ИЛ-3 и ИЛ-4.
Моноцитопоэз - процесс развития моноцитов - происходит в красном костном мозге.
Процесс образования моноцитов включает:
1. дальнейшее увеличение размеров клетки преимущественно за счет нарастания объема цитоплазмы;
2. снижение базофилии цитоплазмы;
3. накопление в ней азурофильных гранул (лизосом);
4. изменение формы ядра, которое становится бобовидным.
Моноциты покидают костный мозг вскоре после формирования, не образуя резервного костномозгового пула. Выделяясь в синусы красного костного мозга, они попадают в кровь, в которой циркулируют от 8 ч до 3-4 сут, а далее через стенку сосудов мигрируют в ткани. Лишь около 5% моноцитов, имеющихся в организме, циркулирует в крови, остальные находятся во внесосудистом пуле. В тканях они превращаются в различные виды макрофагов (вместе с которыми образуют единую моноцитарно-макрофагальную систему), а также в дендритные антиген-представляющие клетки. Развитие моноцитов стимулируется М-КСФ и ГМ-КСФ.
Лимфоцитопоэз – развитие лимфоцитов - происходит в красном костном мозге и различных лимфоидных органах и характеризуется их поэтапной миграцией.
Красный костный мозг содержит полипотентные СКК, которые дают начало частично детерминированным полипотентным родоначальными клетками лимфоцитопоэза (КОЕ-Л).
КОЕ-Л служит источником развития трех видов лимфоцитов – В лимфоцитов, Т-лимфоцитов и NK-клеток, давая, соответственно, три вида унипотентных (коммитированных) родоначалъных клеток – про-В-лимфоциты, протимоциты и (возможно) предшественник NK-клеток. Каждая из этих клеток детерминирована в направлении развития только одного вида лимфоцитов.
РАЗВИТИЕ NK-КЛЕТОК
NK-клетки происходят из костномозгового предшественника, причем их развитие не связано с образованием Т- и В-лимфоцитов. Полагают, что наряду с костным мозгом, они могут развиваться также и к тимусе. После выхода в кровь NK-клетки циркулируют в ней или мигрируют в селезенку; в лимфатических узлах содержатся лишь единичные NK-клетки. Их дозревание происходит в тканях под влиянием малоизученных факторов микроокружения. Механизмы, регулирующие рециркуляцию NK-клеток и их миграцию в селезенку, остаются малоизученными; по всей видимости, они опосредуются адгезивными взаимодействиями между NK-клетками и эндотелием сосудов.
Дата добавления: 2016-02-16; просмотров: 1946;
