Обучающие задачи и эталоны их решения
Задача № 1. Определите вид гибридизации всех атомов углерода в молекулах масляной (бутановой) кислоты и пиридина.
Эталон решения. Органическая химия – это химия соединений углерода. Естественно, что свойства органических соединений во многом определяются электронным строением атома углерода и природой его химических связей. В возбужденном состоянии (1s22s12p3)атом углерода имеет четыре неспаренных электрона и, следовательно, может образовать четыре ковалентные связи. При этом все связи в структурах типа СХ4равноценны. Для объяснения этого явления Л. Полинг ввел понятие "гибридизация" – своеобразное взаимодействие близких по энергии орбиталей с образованием, так называемых гибридных орбиталей с более низкой энергией.
Для атома углерода возможны три различных типа гибридизации.
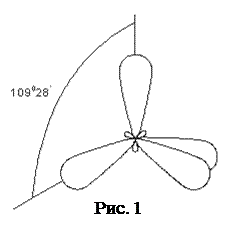 1. sp3-Гибридизация, при которой взаимодействуют одна s- и три p-орбитали и образуются четыре энергетически равноценные гибридные орбитали, имеющие форму объемных восьмерок с неодинаковыми лопастями (рис.1). Наибольшее удаление электронов соответствует направлению гибридных орбиталей к вершинам правильного тетраэдра под углом 109°28'. Атомы углерода, не связанные с другими атомами кратными связями, находятся в sp3-гибридном состоянии и орбитали имеют пространственную конфигурацию. Химические связи в этом случае образуются за счет осевого перекрывания гибридных орбиталей атомами углерода с орбиталями соседних атомов. В результате образуются σ-связи, в которых максимальная электронная плотность находится между ядрами атомов на прямой, соединяющей их. Типичными соединениями, в которых атом углерода находится в sp3-гибридном состоянии, являются насыщенные углеводороды.
1. sp3-Гибридизация, при которой взаимодействуют одна s- и три p-орбитали и образуются четыре энергетически равноценные гибридные орбитали, имеющие форму объемных восьмерок с неодинаковыми лопастями (рис.1). Наибольшее удаление электронов соответствует направлению гибридных орбиталей к вершинам правильного тетраэдра под углом 109°28'. Атомы углерода, не связанные с другими атомами кратными связями, находятся в sp3-гибридном состоянии и орбитали имеют пространственную конфигурацию. Химические связи в этом случае образуются за счет осевого перекрывания гибридных орбиталей атомами углерода с орбиталями соседних атомов. В результате образуются σ-связи, в которых максимальная электронная плотность находится между ядрами атомов на прямой, соединяющей их. Типичными соединениями, в которых атом углерода находится в sp3-гибридном состоянии, являются насыщенные углеводороды.
2. sp2-Гибридизация, при которой взаимодействуют одна s и две р-орбитали с образованием трех гибридных орбиталей, оси которых расположены в одной плоскости и направлены из центра треугольника к его вершинам под углом 120° (рис.2). Направление негибридизированной р-орбитали перпендикулярно плоскости, в которой расположены гибридные орбитали. При образовании ковалентных связей между атомами углерода в состоянии sp2-гибридизации имеют место осевое перекрывание гибридных орбиталей и боковое перекрывание негибридных р-орбиталей (рис. 3). В последнем случае образуется π-связь, электронное облако которой расположено выше и ниже плоскости σ-связей. Типичными соединениями, в которых атомы углерода находятся в состоянии sp2-гибридизации, являются этилен и его гомологи (алкены).
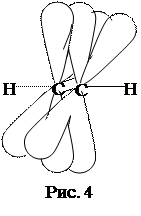

 3. sp-Гибридизация, при которой взаимодействуют одна s- и одна р-орбиталь и образуются две гибридные орбитали. Они расположены линейно под углом 180°. Две оставшиеся негибридные р-орбитали расположены во взаимно перпендикулярных плоскостях. При соединении двух атомов углерода в состоянии sp-гибридизации между ними образуется одна σ- и две π-связи (рис. 4). sp-гибридизация углеродных атомов реализуется в ацетилене и его гомологах (алкинах).
3. sp-Гибридизация, при которой взаимодействуют одна s- и одна р-орбиталь и образуются две гибридные орбитали. Они расположены линейно под углом 180°. Две оставшиеся негибридные р-орбитали расположены во взаимно перпендикулярных плоскостях. При соединении двух атомов углерода в состоянии sp-гибридизации между ними образуется одна σ- и две π-связи (рис. 4). sp-гибридизация углеродных атомов реализуется в ацетилене и его гомологах (алкинах).
В молекуле масляной кислоты CH3–CH2–CH2–COOH атомы углерода в радикале связаны с другими атомами четырьмя σ-связями, следовательно, находятся в состоянии sp3-гибридизации. Атом углерода карбоксильной группы образует три σ-связи и одну π-связь, т.е. находится в состоянии sp2-гибридизации.
В молекуле пиридина все атомы углерода находятся в состоянии sp2-гибридизации.

Задача №2. Дайте определение понятия "сопряжение". Какие атомы участвуют в образовании сопряженных систем в молекулах 1,3-бутадиена, бензола и хлористого винила?
Эталон решения. Электронное строение молекул, содержащих несколько кратных связей, определяется их взаимным расположением. Если между кратными связями находится хотя бы один sp3-гибридный атом углерода, связи называются изолированными:
СН3 –СН = СН – СН2 – СН=СН2
1,4-гексадиен
По свойствам такие соединения подобны этилену. Если же атомы углерода, связанные кратными связями с другими атомами, соединены между собой одной простой связью, то такие системы называются сопряженными, а кратные связи –сопряженными связями. Типичным примером сопряженной системы является 1,3-бутадиен. В этом соединении все четыре атома углерода находятся в состоянии sp2-гибридизации и, следовательно, каждый из них образует три σ-связи, лежащие в одной плоскости под углом 120°, и имеет по одной р-орбитали, расположенные перпендикулярно плоскости σ-скелета (рис. 5).
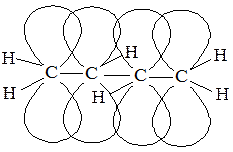
Рис. 5
Боковое перекрывание этих четырех р-орбиталей приводит к образованию π-электронного облака, общего для всей молекулы. Сказанное выше подтверждается электронно-графическими исследованиями, которые показывают, что длина связи между первым и вторым, а также между третьим и четвертым атомами углерода равна 0,136 нм, т.е. она несколько больше, чем длина двойной связи. Расстояние между вторым и третьим атомами –0,148 нм, что меньше длины одинарной связи.
В сопряженной системе р-электроны не закреплены попарно в определенных связях, а делокализованы, т.е. расположены по всей системе. Делокализация р-электронов сопровождается уменьшением энергии системы. Так, сопряженная система связей 1,3-бутадиена будет беднее энергией, чем система с двумя изолированными двойными связями.
Выигрыш энергии, являющийся результатом делокализации электронов в сопряженной системе и приводящий к стабилизации молекулы, называется энергией сопряжения. Многие биологически активные вещества содержат сопряженные системы: гем – небелковая часть гемоглобина крови, витамин А, нуклеиновые основания (аденин, гуанин, цитозин, тимин, урацил) и др.
Примером замкнутых сопряженных систем являются ароматические и многие гетероциклические соединения. В молекуле бензола все атомы углерода находятся в состоянии sp2-гибридизации, образуя по три σ-связи, лежащие в одной плоскости под углом 120°, шесть р-электронов негибридных орбиталей образуют общее электронное облако, осуществляя круговое сопряжение (рис. 6). В молекуле бензола длина всех углерод-углеродных связей одинакова и равна 0,139 нм. Энергия сопряжения бензола довольно велика – 227,8 кДж/моль. Этим объясняется большая устойчивость молекулы бензола. В рассмотренных случаях сопряженная система образована перекрыванием орбиталей π-связей. Такой вид сопряжения называется π,π-сопряжением. В органических соединениях могут образовываться также р,π-сопряженные системы, когда в сопряжение вступает π-орбиталь кратной связи и р-орбиталь заместителя. Например, в молекуле хлористого винила H2C=CH–Cl сопряжение вступает р-орбиталь хлора, имеющая неподеленную пару электронов.
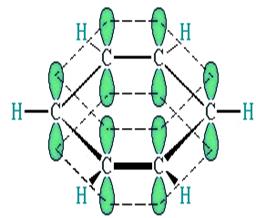

Рис. 6
Задача № 3. Изобразите заслоненную к заторможенную конформации 1,2-дихлорэтана. Какая из них обладает меньшей энергией?
Эталон решения. Взаимное расположение атомов, соединенных только σ-связью, не является жестким, так как атомы могут поворачиваться вокруг оси, соединяющей их. Образующиеся при этом формы молекул называются конформациями. Это разные формы молекул одного и того же вещества. Любая конкретная конформация является лишь временным состоянием молекул, которые непрерывно переходят из одной конформации в другую. При этом большинство молекул находятся в виде энергетически более выгодных конформаций, т.е. в которых несвязанные атомы наиболее удалены друг от друга.
Конформации 1,2-дихлорэтана могут быть изображены с помощью проекционных формул Ньюмена, получающихся при перенесении на плоскость проекции молекулы вдоль С-Ссвязи.
Конформация, в которой заместители (атомы хлора) находятся на минимальном расстоянии и заслоняют друг друга, называется заслоненной. Максимальному удалению заместителей соответствует заторможенная конформация. Остальные конформации называются скошенными.
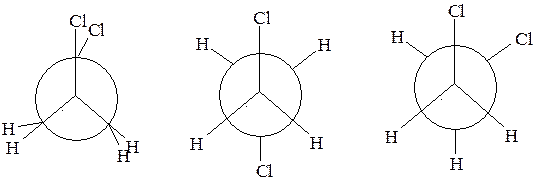
заслоненная заторможенная скошенная
Задача № 4. Изобразите наиболее выгодную конформацию метилциклогексана.
Эталон решения. Циклы, образованные атомами углерода в sp3-гибридном состоянии, не могут быть плоскими (кроме циклопропана), так как не будет сохранена тетраэдрическая конфигурация. В связи с тем, что у первых двух представителей предельных циклических углеводородов – циклопропана и циклобутана – угол, образованный прямыми, соединяющими ядрами атомов, меньше тетраэдрического и равен соответственно 60° и 90°, область максимального перекрывания атомных орбиталей атомов углерода располагается не на этих прямых, а с внешней стороны от них (рис. 7). Такие σ-связи (так называемые "банановые" связи) по характеру расположения максимальной электронной плоскости подобны π-связям.
Наименьшее отклонение валентного угла от тетраэдрического наблюдается в циклопентане - 0,44°.

Рис. 7
Молекула циклогексана не может иметь форму правильного шестиугольника, так как в этом случае угол между связями был бы равен 120°. Основными конформациями циклогексана, лишенными угловых напряжений, являются форма кресла (рис. 8) и форма лодки.
 |
Рис. 8
При этом большая часть молекул находится в форме более энергетически выгодной конформации кресла. Двенадцать связей С-Нв молекуле циклогексана позволяют разделить их на две группы. Шесть аксиальных связей (символ "а", рис. 8) направлены перпендикулярно циклу попеременно вверх и вниз. Другие шесть связей направлены по периферии цикла, образуя с осью симметрии угол 109°28’, их называют экваториальными (символ "е"). При наличии в молекуле циклогексана какого-либо заместителя он может занимать аксиальное или экваториальное положение. Эти формы являются конформерами. Экваториальное положение заместителя энергетически выгоднее и поэтому его существование более вероятно.
Наиболее выгодной конформацией метилциклогексана будет конформация кресла с экваториальным расположением метильной группы.
Задача №5. В чем отличие цис- и транс-изомеров 2-бутена?
Эталон решения. В отличие от одинарной, двойная связь исключает возможность свободного вращения связываемых атомов. Замещение атомов водорода у sp2-гибридизованных атомов углевода может происходить двояко: по одну или по разные стороны от двойной связи:

цис-2-бутен транс-2-бутен
Этот вид изомерии получил название геометрической или цис-транс-иэомерии. Изомеры, в которых заместители расположены по одну сторону от двойной связи, называются цис-изомерами, по разную – транс-изомерами. Цис- и транс-изомеры отличаются не только пространственным строением, но и некоторыми физическими, химическими и физиологическими свойствами.
Цис-транс-изомерия достаточно часто встречается в биологически активных соединениях. Так, непредельные высшие жирные кислоты (структурные компоненты липидов) имеют цис-конформацию, что определяет их более компактное расположение в клеточных мембранах.
Задача №6. Определите вид и знак электронных эффектов в молекулах хлоруксусной кислоты и бензойном альдегиде.
Эталон решения. При изучении свойств органических соединений важно не только знать их электронное строение, но и учитывать взаимное влияние атомов в молекуле. Впервые идеи о взаимном влиянии атомов были высказаны А.М. Бутлеровым и развиты его учеником В.В. Марковниковым. В настоящее время определены качественные зависимости между строением и реакционной способностью соединений, называемые эффектами. Наиболее важными являются электронные и пространственные (стерические) эффекты.
Наличие в молекуле атомов, существенно отличающихся по электроотрицательности от атома углерода, ведет к поляризации связи между ними, что в свою очередь вызывает поляризацию соседних С–С и С–Нсвязей, постепенно «затухающую» по мере удаления от атома, вызывающего поляризацию.
Смещение электронной плотности σ-связи к одному из связываемых атомов, передающееся по цепи σ-связей в молекуле, называется индуктивным эффектом (І-эффектом).
Направление смещения электронной плотности обозначается стрелкой, совпадающей с валентной черточкой и направленной в сторону более электроотрицательного атома:

Если электронная плотность смещена от атома углерода к заместителю, то индуктивный эффект считается отрицательным (-І-эффект), если же наоборот, то положительным (+І -эффект ).
Положительным индуктивным эффектом обладают электронодонорные заместители – атомы металлов и алкильные группы -СН3, -С2Н5 и др. В последнем случае +І-эффект обусловлен незначительной полярностью С-Нсвязей (электроотрицательность атомов углерода 2,5, а водорода 2,1 по шкале Полинга). С возрастанием числа углеродных атомов в алкильном радикале + І-эффект возрастает: -С3Н7 > -С2Н5 > -СН3
Отрицательный индуктивный эффект проявляют электроноакцепторные заместители: -ОН, >С=О, -СООН, -NH2, -ОR, галогены. Индуктивный эффект оказывает влияние на свойства органических соединений. Так, замещение атома водорода в радикале уксусной кислоты хлором, обладающим -І-эффектом, приводит к увеличению кислотности вследствие смешения электронной плотности к атому галогена:
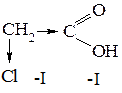
Если в молекуле имеется система сопряженных связей или кратная связь и при ней стоит заместитель с неподеленной электронной парой, то передача влияния происходит по системе π-связей и тогда эффект заместителя называется мезомерным эффектом или эффектом сопряжения (М-эффект). Мезомерный эффект проявляется в тех случаях, когда заместитель имеет либо π-связи (>С=О, -СООН, -NO2), либо неподеленные пары электронов (-ОН, -NH2, галогены). Если такие заместители соединены с атомами углерода в состоянии, sp2- или sp-гибридизации, то электроны π-связей или спаренные электроны заместителей оказываются сопряженными с электронами π-связи углеродного скелета. Мезомерный эффект обозначается изогнутыми стрелками:
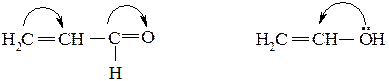
Начало стрелки указывает, какие π-или р-электроны смещаются, а конец – связь или атомы, к которым они смещаются. Электроны π-связей обладают большой подвижностью, поэтому М-эффект передается с одного конца сопряженной системы на другой практически без затухания.
Если заместитель оттягивает электронную плотность из сопряженной системы, то мезомерный эффект считается отрицательным (-М-эффектом). Если заместитель отдает свою электронную пару для участия в общем сопряжении, мезомерный эффект считается положительным (+М-эффектом). Отрицательным мезомерным эффектом обладают заместители, имеющие π-связи (>С=О, -СООН, -NO2),а положительным – заместители с неподеленной электронной парой (-ОН, -NH2, галогены). В молекуле бензойного альдегида карбоксильная группа находится в π,π-сопряжении с ароматической системой и благодаря наличию атомов кислорода проявляет отрицательный индуктивный и отрицательный мезомерный эффекты

Вопросы и упражнения
№ 1
1. Определите тип гибридизации всех атомов углерода в следующих соединениях:
СН2 =СН – СН2 – СН2–ОН; Н3С –С≡С–СН3
2. Изобразите циклогександиол-1,3 в конформации кресла с наиболее выгодным расположением заместителей.
3. Определите вид и знак электронных эффектов заместителей в следующих соединениях:
Н3С–СН2–СООН 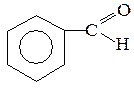 Н3С–СН2–СН=СН–Cl
Н3С–СН2–СН=СН–Cl
№ 2
1. Определите тип гибридизации всех атомов углерода в следующих молекулах:
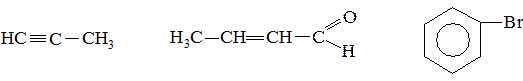
2. Назовите изображенную в проекции Ньюмена конформацию. Какому соединению она соответствует?
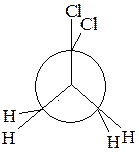
3. Приведите строение пиррола и объясните, почему пиррол является ароматическим соединением.
№ 3
1. Определите тип гибридизации всех атомов углерода в следующих молекулах:
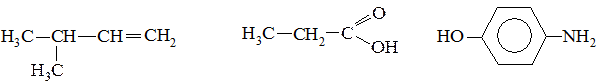
2. Изобразите 1,2-диметилциклогексан в конформации кресла с наиболее выгодным расположением заместителей.
3. Определите вид и знак электронных эффектов в молекулах следующих веществ:
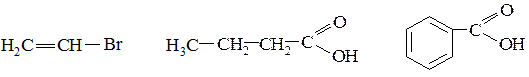
№ 4
1. Определите тип гибридизации всех атомов углерода в следующих молекулах:
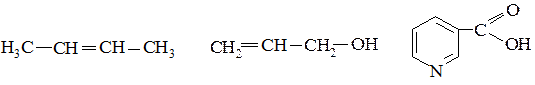
2. Изобразите в проекции Ньюмена заторможенную конформацию этанола. Какому энергетическому состоянию (максимуму или минимуму) она соответствует?
3. Определите вид и знак электронных эффектов в молекуле п-аминобензойной кислоты:
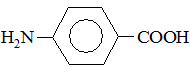
№ 5
1. Определите тип гибридизации всех атомов углерода в следующих молекулах:

2. Изобразите наиболее предпочтительную конформацию циклогексанола.
3. Приведите строение пиридина и объясните, почему пиридин является ароматическим соединением.
№ 6
1. Определите тип гибридизации всех атомов углерода в следующих молекулах:

2. Назовите изображенную в проекции Ньюмена конформацию. Какому соединению она соответствует?
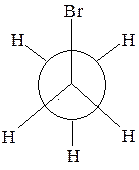
3. Определите вид и знак электронных эффектов карбоксильной группы в уксусной и бензойной кислотах:
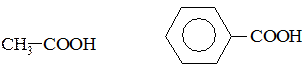
№ 7
1. Определите тип гибридизации всех атомов углерода в следующих молекулах:
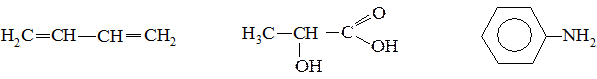 2. Изобразите наиболее предпочтительную конформацию бромциклогексана.
2. Изобразите наиболее предпочтительную конформацию бромциклогексана.
3. Определите вид и знак электронных эффектов в молекуле м-крезола:
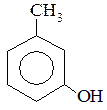
№ 8
1. Определите тип гибридизации всех атомов углерода в следующих молекулах:
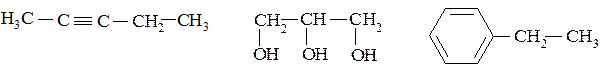
2. Изобразите в проекции Ньюмена наиболее предпочтительную конформацию этиленгликоля:
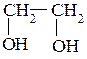
3. Какие атомы участвуют в образовании сопряженных систем в молекулах:
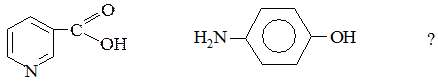
№ 9
1. Определите тип гибридизации всех атомов углерода в следующих молекулах:

2. Изобразите строение и преимущественную конформацию метилциклогексана.
3. Укажите электронные эффекты и виды сопряжения заместителей с бензольным кольцом в молекуле сульфаниловой кислоты (основа большой группы сульфаниламидных препаратов):
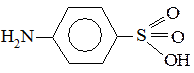
№ 10
1. Определите тип гибридизации всех атомов углерода в следующих молекулах:
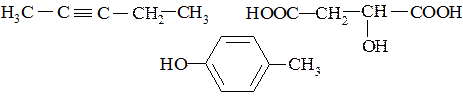
2. Изобразите строение и кресловидную конформацию молекулы миоинозита (пять ОН групп занимают экваториальное положение), содержащегося в мышцах и являющегося циклогексангексаолом-1,2,3,4,5,6.
3. Какое влияние оказывает гидроксильная группа на электронную плотность бензольного кольца в следующих соединениях:
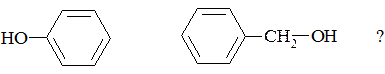
№ 11
1. Определите тип гибридизации всех атомов углерода в следующих молекулах:
 2. Изобразите в проекции Ньюмена заторможенную конформацию 2-аминоэтанола-1 (коламина). Какому энергетическому состоянию она соответствует?
2. Изобразите в проекции Ньюмена заторможенную конформацию 2-аминоэтанола-1 (коламина). Какому энергетическому состоянию она соответствует?
3. Определите вид и знак электронных эффектов заместителей в соединениях:
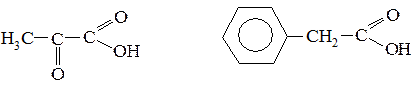
№ 12
1. Определите тип гибридизации всех атомов углерода в молекулах:
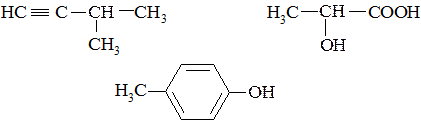
2. Изобразите строение и предпочтительную конформацию аминоциклогексана.
3. Определите вид и знак электронных эффектов в молекулах:

№ 13
1. Определите тип гибридизации всех атомов углерода в молекулах:
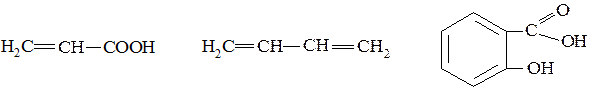
2. Изобразите предпочтительную конформацию 1,2-дибромциклогексана.
3. Какое влияние оказывают заместители на электронную плотность бензольного кольца в следующих соединениях:

№ 14
1. Определите тип гибридизации всех атомов углерода в молекулах:
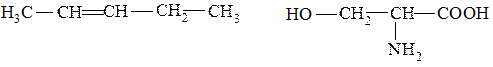
2. Изобразите в проекции Ньюмена заслоненную и заторможенную конформации 1,2-дихлорэтана. Какая из них обладает меньшей энергией?
3. Определите вид и знак электронных эффектов заместителей в молекулах:

№ 15
1. Определите тип гибридизации всех атомов углерода в молекулах:
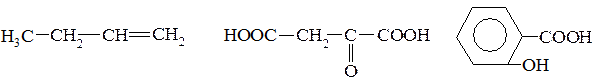
2. Изобразите строение и предпочтительную конформацию гексахлорциклогексана (гексахлорана).
3. Какое влияние оказывают заместители на электронную плотность бензольного кольца в следующих соединениях:
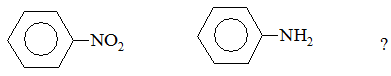
Тема ІІІ. КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Дата добавления: 2016-03-22; просмотров: 8466;
