Описание технологического процесса и технологической схемы производства
Сущность процесса получения минеральных удобрений заключается в нейтрализации фосфорной кислоты, получаемой из апатитового концентрата, жидким аммиаком по следующим основным реакциям:
Н3РО4 + NН3 = NН4Н2РО4 (моноаммонийфосфат), (1)
NН4Н2РО4 + NН3 = (NН4)2НРО4 (диаммонийфосфат), (2)
Н3РО4 + 2NН3 = (NН4)2НРО4 (3)
На стадии выпаривания фосфорной кислоты в производстве экстракционной фосфорной кислоты (ПЭФК) выпадают осадки сульфата кальция, ортофосфатов кальция, железа, алюминия, фториды и кремнефториды кальция, образуя взвеси - твердый осадок в фосфорной кислоте.
Присутствующие в фосфорной кислоте примеси железа, алюминия, растворимого кальция образуют в основном средние соли.
СаО + Н3РО4 = СаНРО4 + Н2О, (4)
Fе2О3 + 2Н3РО4 = 2FеРО4 + 3Н2О, (5)
Аl2О3 + 2Н3РО4 = 2АlРО4 + 3Н2О (6)
Возможно также образование солей типа Fе, Аl NН4(НРО4)2 * 0,5Н2О и других.
Некоторое количество ионов кальция в фосфорной кислоте связано в виде кристаллогидрата сульфата кальция.
СаО + Н2SО4 + Н2О = СаSО4 * 2Н2О (7)
Серная и кремнефтористоводородная кислоты при аммонизации образуют аммонийные соли, то есть являются носителями азота в удобрениях.
Н2SО4 + 2NН3 = (NН4)2SO4 + Q, (8)
Н2SiF6 + 2NН3 = (NН4)2SiF6, (9)
3SiF4 + 3Н2О = 2Н2SiF6 + Н2SiО3, (10)
НF + NН3 = NН4F (11)
При использовании в технологическом процессе фосфорной кислоты с повышенным содержанием магния, образуются нерастворимые соли.
3МgО + 3Н3РО4 = 3МgНРО4 * 3Н2О, (12)
МgО + NН3 + Н3РО4 = МgNН4РО4 + Н2О (13)
За счет образования этих солей снижается содержание азотной части в удобрениях, особенно это заметно при производстве диаммонийфосфата. Кроме того, происходит выпадение осадка на стенках труб и их забивка.
При производстве диаммофоски применяемый в качестве сырья концентрат минеральный «Сильвин» в аммонизаторе - грануляторе и после находится в виде самостоятельной фазы, а часть его вступает в реакцию.
NН4Н2РО4 + КСl = КH2РО4 + NН4Сl (14)
Растворимость диаммонийфосфата описывается уравнением:
L = 36,5 + 0,213t - при 10 ºС - 70 ºС,
где L – растворимость (г/100 г насыщенного раствора), t – температура, ºС
Степень гидролиза диаммонийфосфата зависит от его массовой концентрации в растворе:
| Массовая концентрация соли, г. экв/л | 2,0 | 0,5 | 0,2 | 0,04 | 0,004 |
| Степень гидролиза, % | 8,0 | 11,61 | 14,68 | 20,34 | 22,43 |
Растворимость моноаммонийфосфата описывается уравнением:
L = 17,2 + 0,457t - при 0 ºС – 110,5 ºС,
где L - растворимость, t – температура.
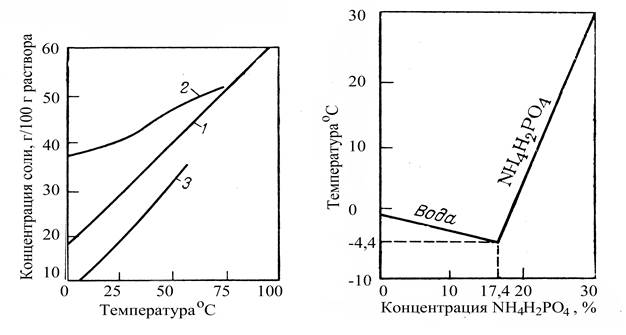
Зависимость растворимости ортофосфатов аммония от температуры приведена на рисунке 2 [3], где 1- NН4Н2РО4, 2 - (NН4)2НРО4, 3 - (NН4)3РО4.
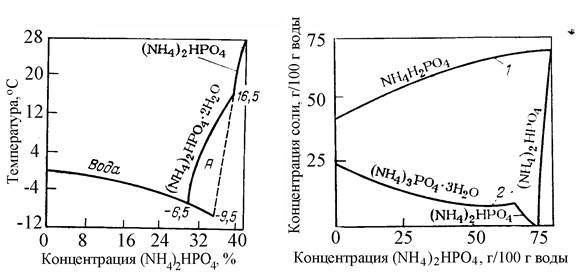
Диаграммы состояния бинарных систем NН4Н2РО4 – Н2О и (NН4)2НРО4 – Н2О приведены на рисунке 3 и 4 [3]. На диаграмме рисунка 3 эвтектическая точка соответствует температуре минус 4,4 ºС и отвечает составу 17,4 % NН4Н2РО4. В системе (NН4)2НРО4 – Н2О на диаграмме рисунка 4 существует метастабильная область в интервале температур от минус 6,5 ºС до 16,5 ºС, в которой образуется кристаллогидрат (NН4)2НРО4 * Н2О.
Диаграмма растворимости NН4Н2РО4 и (NН4)3РО4 в воде в присутствии (NН4)2НРО4 приведена на рисунке 5 [3]. Из диаграммы видно, что в присутствии (NН4)2НРО4 растворимость моноаммонийфосфата увеличивается. При добавлении (NН4)3РО4 * 3Н2О растворимость диаммонийфосфата понижается.
|
|
Наиболее устойчивым из фосфатов аммония в твердом состоянии является моноаммонийфосфат, при нагревании которого до 100 оС - 110 оС не наблюдается существенных потерь аммиака.
Диаммонийфосфат термически малоустойчив и начинает разлагаться уже при температуре 70 ºС с выделением аммиака, превращаясь в моноаммонийфосфат.
(NН4)2НРО4 → NН4Н2РО4 + NН3 (15)
Данные о давлении паров аммиака (Р) при диссоциации этой соли приведены ниже:
| Т, оС | 50 60 70 80 90 100 110 120 130 |
| Р, Па | 26,7 66,7 146,8 307 760 1200 2139 3667 6360 |
Как видно из приведенных данных, давление паров аммиака при диссоциации диаммонийфосфата велико, что указывает на легкое разложение соли с выделением в газовую фазу аммиака.
Давление паров аммиака при 125 ºС составляет 6,67 Па [3].
Зависимость физико-химических свойств насыщенных растворов моно- и диаммонийфосфатов от мольного отношения NН3 : Н3РО4 при 25 ºС приведены на рисунке 1.1.
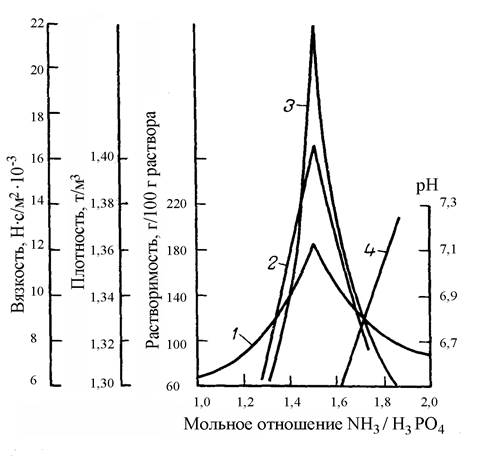
Рисунок 1.1 - Зависимость физико-химических свойств насыщенных растворов моно- и диаммонийфосфатов от мольного отношения NН3 : Н3РО4 при 25 ºС 1 – растворимость, 2 – плотность, 3 – вязкость, 4 – рН раствора
Физико-механические свойства минеральных удобрений являются важными показателями, характеризующими их устойчивость к воздействиям внешней среды при транспортировке и хранении. При большой гигроскопичности удобрения слеживаются, ухудшается сыпучесть, теряется прочность. ДАФ и аммофос слабо гигроскопичны и относятся к слабо слеживающимся и слабо уплотняющимся удобрениям.
Гигроскопическая точка для ДАФ удобрительного из кислоты, полученной на основе апатита, составляет от 72 % до 74 % [7], для аммофоса по экспериментальным данным от 73 % до 79 %.
Угол естественного откоса диаммонийфосфата при влажности от 1,3 % до 1,5 % составляет от 34 до 36 °.
Процесс производства гранулированных минеральных удобрений состоит из следующих стадий:
· Прием, хранение и снабжение производства основным сырьем и технологическими добавками
· Получение пульпы фосфатов аммония
· Доаммонизация и гранулирование удобрений
· Получение топочных газов и сушка удобрений
· Рассев высушенных гранул и дробление крупной фракции
· Охлаждение готового продукта
· Кондиционирование продукта и транспортировка готового продукта на склад
· Дообработка продукта
· Очистка пылегазовоздушной смеси, выбрасываемой в атмосферу
1.5 Прием, хранение и снабжение производства основным
сырьем
Дата добавления: 2016-03-15; просмотров: 2233;
