Исследования морфофункциональных особенностей биологических объектов при помощи сканирующей зондовой микроскопии
***
СЗМ позволяет проводить исследования изменений формы клеток крови (эритроцитов) и строения их мембран в процессе взаимодействия с вирусами. Для исследований на воздухе используют простой мазок крови, приготовленный на предметном стекле стандартным для клинической лаборатории методом. В световом микроскопе, на столике которого смонтирована сканирующая головка прибора Solver BIO, выбирается область, где клетки крови расположены в один слой. Препарат готов к исследованию практически сразу и не требует дополнительных манипуляций. Так же возможно нанесение клеток из суспензии.Образец представляет собой суспензию клеток крови (в основном эритроцитов) в фосфатном буфере (рН 7,0). Перед сорбцией клетки фиксируют добавлением параформальдегида до конечной концентрации 2% и через 2 часа переводят в дистиллированную воду, доводя концентрацию до 108 штук/мл. Каплю суспензии (5-10 мкл) наносят на предметное стекло размером 3х3 см и высушивают на воздухе. Стекло крепится к столику СЗМ с помощью двухстороннего скотча. Сканирование препарата проводят на воздухе в контактном (зонды CSC11) и полуконтактном режиме (зонды NSG11). По сравнению с жидкостным методом воздушный режим обеспечивает более высокое разрешение и позволяет наблюдать как целостность, так и характер повреждений мембраны. Сравнение обзорных сканов с контрольного и опытных образцов дают представление об изменении формы эритроцитов в процессе их взаимодействия с вирусными частицами.
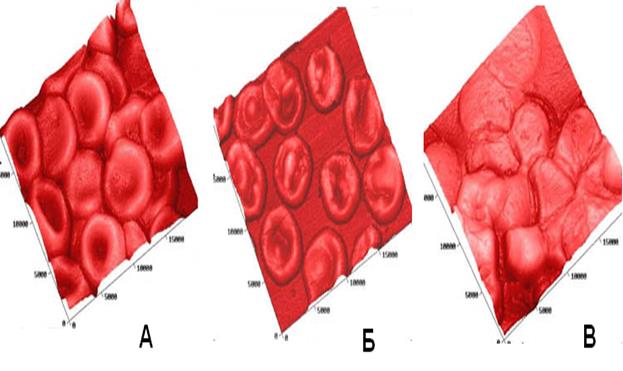
Рис. 64. Сканы эритроцитов: А – контрольный образец, искажения формы вызваны только влиянием эритроцитов друг на друга; Б – влияние на форму эритроцитов вируса гриппа; В – полная деградация эритроцитов макаки резус после 90 минутного взаимодействия с паровирусом собак.
Метод рассогласования дает возможность исследовать мелкие особенности поверхности на фоне резких перепадов высоты в кадре. В настоящем исследовании метод рассогласования применялся для выявления изменений рельефа размером 10-20 нм по z на склоне эритроцита (изменение высоты 1 мкм). В этом режиме хорошо различимы нарушения и дефекты на поверхности эритроцитов, вызываемые влиянием вирусных частиц.
Таким образом, изучение взаимодействия вирус-эритроцит может рассматриваться как пример особого случая воздействия на мембрану. Взаимодействие вирус-эритроцит является специфичным процессом. В результате взаимодействия меняется форма эритроцитов и тонкое строение их мембраны. В тех случаях, когда реакция не идет и взаимодействие вирус-клетка ограничивается сорбцией вирионов на мембране эритроцита, вирусные частицы можно наблюдать на поверхности мембраны.
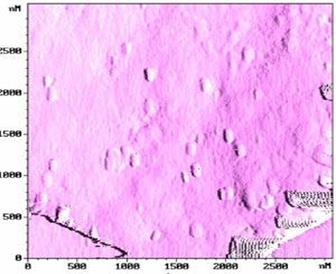
Рис. 65. Изображение поверхности эритроцита с сорбированными на ней вирионами гриппа.
***
В сочетании с другими методами, например с хемилюминесценцией, СЗМ позволяет оценить динамику формирования псевдоподий и образование свободных радикалов О2 при процессе фагоцитоза нейтрофилами крови человека.
Полиморфноядерныелейкоциты (ПМЯЛ) человека были выделены из венозной крови здоровых доноров путем центрифугирования через двойной градиент фиколл-верографина (Pharmacia, Sweden). Использовались концентрации градиента 1.077 и 1.116 г/мл. Эритроциты лизировали добавлением холодного изотонического раствора NH4CL (155 mM NH4CL, 10 mM KHCO3, 0.1 mM EDTA, pH 7.2-7.4) в течение 12 мин. Затем гранулоциты отмывали забуференным физиологическим раствором и ресуспендировали. В работе были использованы микроорганизмы Staphylococcus aureus 7M и Candida albicans 601 в концентрации 2.108 клеток/мл и 9.106 клеток/мл соответственно. ПМЯЛ (0.2 мл) инкубировались с суспензией микроорганизмов (0.2 мл) в опыте или с забуференным физиологическим раствором в контроле в течение 5, 10, 15, 20, 30 мин (37oC) отмывали в силиконированных центрифужных пробирках (1000g, 2 мин). Затем 0.05 мл суспензии наносилось на поверхность стекла. После экспозиции (40 min, 20oC) клетки фиксировали метанолом (0.05 ml, 10 min). Приготовленные препараты отмывались дистиллированной водой и высушивали на воздухе. Топография поверхности ПМЯЛ исследовалась на зондовом микроскопе TopoMetrix Accurex (USA) в контактном режиме. Использовались зонды из Si3N4 с жесткостью 0,036 N/m. Радиус закругления кончика зонда составлял примерно 50 nm. Данные о кислородной активности ПМЯЛ получали, изучая хемилюминесцентную активность на жидкостно-стинциляционном счетчике "Beta-1" (Медаппаратура, Украина). Суспензия ПМЯЛ (0.5 x 106клеток/мл), обрабатывалась люминолом (Serwa, USA) в конечной концентрации 10-5 M и смешивалась с суспензией микроорганизмов (106 клеток/мл) в опыте или забуференным физиологическим раствором в контроле в конечной концентрации 1 мл. Кинетика люминолзависимой хемилюминесценции измерялась в течение 120 мин.
После инкубации нейтрофилов с микроорганизмами S. aureus и C. аlbicans происходило формирование псевдоподий. Исследования методом СЗМ показало полиморфизм поверхности нейтрофилов вследствие образования разных форм псевдоподий в одинаковых условиях.

Рис. 66. Топография поверхности нейтрофила через 5 минут, после инкубации со S.аureus. (А). Структура псевдоподий со стафилококками (Б).
В результате исследований установлено, что наиболее активное формирование псевдоподий происходит через 5-10 минут после инкубации и заканчивается на 20-30 минуте. Так же выявлено, что активность нейтрофилов не зависит от того, какие микроорганизмы поглощаются, а данные хемилюминесценции показывают возрастание уровня дыхательной активности после стимуляции нейтрофилов. Пик респираторного взрыва приходится на 70-90 минуту.
***
СЗМ позволяет исследовать поверхностную морфологию биополимеров (типа коллагена), и “прощупывать” их внутреннюю структуру.
Например, можно выявить морфологические изменения молекул коллагена при его обводненности используя СЗМ, а так же исследовать внутреннюю структуру фибрилл коллагена, используя более “жесткий” режим сканирования зондовым микроскопом.
Использовался коллаген сухожилий хвоста крыс, растянутый на поверхности предметного стекла. При исследованиях в жидкости фибриллы коллагена обнаруживали плохую адгезию к поверхности подложки. Для фиксирования молекул поверхность стекла предварительно обрабатывалась 0.1 % раствором альцианового синего, что придавало подложке положительный заряд. Исследования поверхности макромолекул проводили на сканирующем зондовом микроскопе Solver Bio NT-MDT. Сканирование фиксированных препаратов осуществляли методом АСМ на воздухе. Для сканирования высушенных фибрилл на воздухе был выбран полуконтактный метод, так как при использовании контактного метода наблюдается увлечение биологического препарата зондом. Частота развертки сканирования выбиралась порядка 1-1.5 Hz. Использовались: неконтактные кремниевые зонды серии NSG11 (NT-MDT) жесткостью порядка 5 Н/м, радиусом закругления 10 нм, аспектное отношение 3:1, неконтактные зонды «вискерного» типа серии NSC05 (NT-MDT) жесткостью порядка 11 Н/м, радиусом закругления 10 нм, аспектное отношение 10:1.
Сканирование обводненных молекул методом АСМ в жидкой среде проводилось на предметном стекле в капле дистиллированной воды. Для сканирования обводненных фибрилл также был выбран полуконтактный режим сканирования, но более “мягкими” зондами. Частота развертки сканирования составляла примерно 0.5 Гц. Использовались: затупленные контактные кремниевые зонды серии CSG11 (NT-MDT) жесткостью 0,03 Н/м, с радиусом закругления примерно 30 нм и резонансной частотой в пределах 15-40 KГц. В результате исследования высушенных препаратов на воздухе величина периодичности составляла порядка 67 нм.
При сканировании фибрилл в жидкости было обнаружено, что период исчерченности составлял примерно 54-57 нм. Кроме того, при подробном рассмотрении выявилась “тонкая” структура – каждый пик оказывался двойным. Наличие такой структуры авторы объясняют как обводнением фибриллы, так и выявлением внутренней структуры вследствие большего воздействия на мягкую гидратированную молекулу со стороны зонда микроскопа.
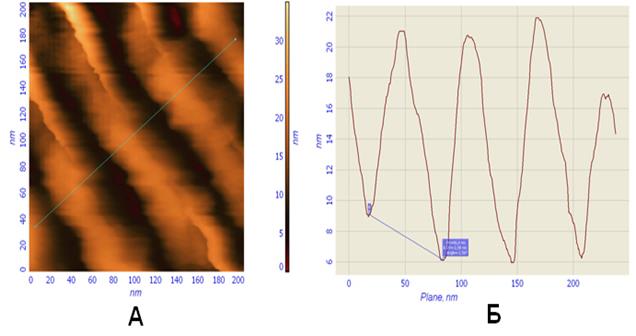
Рис. 67. Изображение (А) и профиль участка (Б) высушенной коллагеновой фибриллы на предметном стекле. Отмечается четкая поперечная исчерченность.
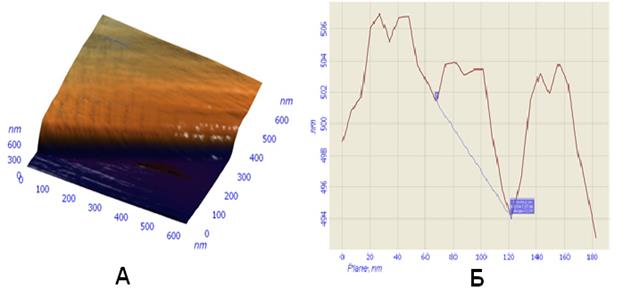
Рис. 68. Коллагеновая фибрилла на предметном стекле в жидкости. Наблюдается поперечная исчерченность поверхности фибриллы (А) и выявляется дополнительная “тонкая” структура каждого периода (Б) по сечению вдоль фибриллы.
Также было установлено, что при исследовании в водной среде наблюдается деформация фибриллы – размазывание периферической части по поверхности подложки и смещение более “твердой” внутренней части в направлении быстрого сканирования. Это подтверждает предположение о двухслойной структуре молекулы коллагена.
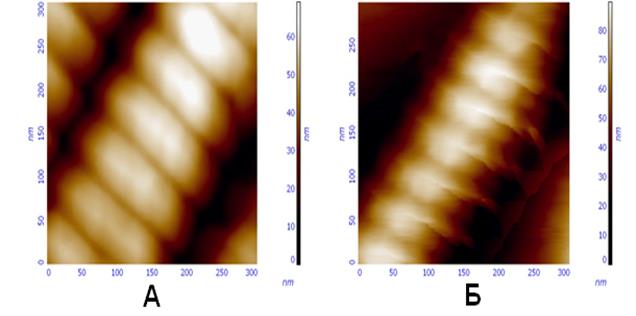
Рис. 69. Изображение участка высушенной коллагеновой фибриллы на предметном стекле в полуконтактном режиме сканирования. А) – изображение получено зондом серии NSG11 с аспектным отношением 3:1, Б) - изображение получено зондом серии NSC05 с аспектным отношением 10:1.
Однако авторы подчеркивают, что именно сердцевина фибриллы имеет большую плотность по отношению к периферической. Этот вывод согласуется с данными рентгеноструктурного анализа, на основе которых предполагали, что коллагеновые фибриллы по структуре напоминают жидкие кристаллы, высокоорганизованные в центре и менее организованные на периферии. Использование зондов «вискерного» типа для лучшего разрешения морфологических особенностей высушенных фибрилл позволило установить отсутствие раздвоения пиков. Как отмечают, это связано с изменениями гликозаминогликанового окружения фибрилл, т. к. гликозамингликаны – высокосульфатированные полисахариды – ковалентно связаны с коллагеном и, в зависимости от условий среды, могут маскировать или демаскировать тонкую структуру фибрилл.
В результате проведенного исследования морфологических особенностей коллагеновых фибрилл на воздухе и в жидкости удалось определить периодичность исчерченности на высушенных образцах (67 нм) и в жидкости (54-57 нм). По-видимому, это связано с изменением пространственной ориентации тропоколлагена, обусловленным обводнением. Молекулы коллагена имеют двухслойную структуру, причем плотность тропоколлагеновых молекул увеличивается от периферии к центру, что было установлено ранее методом рентгеноструктурного анализа. СЗМ измерения при более “жестком сканировании” подтверждают этот факт.
***
Различные модификации методик СЗМ позволяют проводить исследования структурных особенностей белков.
В качестве объектов исследования авторы использовали белки с различными молекулярными массами: иммуноглобулины IgM изотипа -950 кДа, иммуноглобулины IgGl - 150 кДа, агглютинин рицина - 120 кДа, рицин -60 кДа, связывающую субъединицу рицина - 30 кДа и рекомбинантный белок эглин С со встроенным фрагментом молекулы β1-адренорецептора -11 5 кДа В ходе работы измерялись геометрические параметры молекул, что позволило отличать по размеру молекулы рицина от молекул антител и агглютинина рицина. Для приготовления образцов исходный раствор белков разводился до концентрации 0,5-2 мкг/мл. Капля раствора белка наносилась на свежесколотую слюду и инкубировалась в течение 1 мин. Затем образец отмывался в деионизованной воде и обдувался сжатым воздухом.
Измерения макромолекул производились на зондовом микроскопе Solver P47H (НТ МДТ, Москва). Для получения высокого разрешения была применена приставка АА110 (НТ МДТ) и зондовые датчики серии NSG11 S (НТ МДТ), типичный радиус кривизны острия которых был менее 10 нм. Использовался прерывисто-контактный метод. Сканирование проводилось с частотой 3,5 Гц с разрешением 512x512 точек.
В результате сканирования было получено АСМ-изображение молекулы иммуноглобулина изотипа IgM (950 кДа). Это IgM представляет собой структуру, состоящую из пяти субъединиц. Диаметр каждой из субъединиц равен 10 нм, а высота - 2,5 нм. Данные АСМ соответствуют представлениям о пространственной организации IgM, согласно которым IgM - это молекула, состоящая из пяти Y-образных молекул, при этом С-концевые участки направлены к центру, а Fab-фрагменты располагаются на внешней стороне.
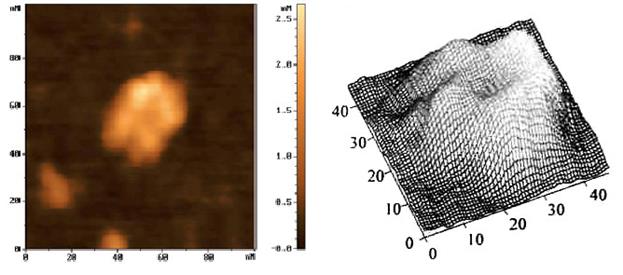
Рис. 70. АСМ изображение IgM.
На полученном АСМ изображении молекулы IgG1 (150 кДа) четко различаются три глобулы, две глобулы имеют одинаковые размеры: диаметр составляет 10 нм, а высота 1,5 нм; размеры третьей глобулы несколько больше: диаметр также 10 нм, а высота превышает 2 нм. Авторы отмечают, что вероятно, две сходных по размеру глобулы соответствуют Fab-фрагментам, а третья, большая, соответствует Fc-фрагменту иммуноглобулинов.
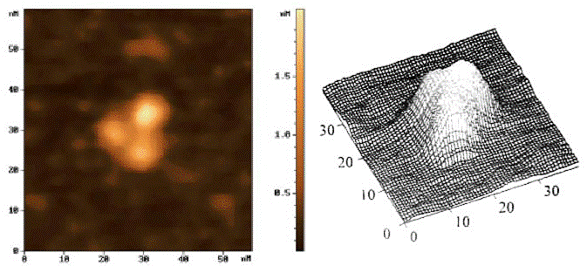
Рис. 71. АСМ изображение IgG1.
Были выявлены также молекулы агглютинина рицина (120 кДа.). Они имеют структуру, состоящую из двух глобулярных блоков, вытянутых на подложке. Блок представляет собой природный тетрамер ВА-АВ, с двумя А-субъединицами в центре и двумя В-субъсдиницами по краям. Определен рицин (60 кДа) состоящий из каталипческой А-субъединицы ингибирующей синтез белка и В-субъединицы, связывающей токсин с клеткам. Все молекулы имеют глобулярную форму. АСМ-изображения молекул связывающей В-субъединицы рицина (30 кДа) и рекомбинантного белка эглина со встроеным фрагментом (11,5 кДа) β1-адренорецептора человека практически не отличались друг от друга и молекулы агглютинина рицина (120 кДа).
В результате применения СЗМ были изучены структурные особенностей белков, которые различались пространственной организацией. Наиболее отчетливые изображения белков получены при начальной амплитуде колебаний кантилевера 5-15 нм и с рабочей амплитудой в режиме отталкивания зонда от образца. Применение прерывисто-контактного метода позволило четко различать структурные детали молекул иммуноглобулинов IgM, IgG1 и агглютинина рицина. Использование зондов, радиус кривизны острия которых был немного меньше 10 нм, приводило к ограничению выявления особенностей строения белков с молекулярной массой 60 кДа и менее. Продемонстрированы возможности дифференцировки IgG1, агглютинина рицина и рицина на основе количественной оценки геометрических параметров молекул.
Дата добавления: 2016-02-10; просмотров: 1691;
