СОЕДИНЕНИЙ И ИХ РАСТВОРОВ.
Практическая значимость темы
Совершенно очевидно, что без образования ВМС вообще невозможно было бы возникновение жизни на Земле.
Изучение свойств ВМС и их растворов имеет исключительно важное значение для понимания механизма биохимических и физиологических процессов в организме: обмена веществ, пищеварения, роста и старения организма, а также патофизиологических процессов: воспалений, отеков, почечно-каменной и желчно-каменной болезней, атеросклероза.
Высокомолекулярные соединения (ВМС) – это вещества, молекулы которых состоят из большого числа химически связанных атомов и имеют высокую молярную массу M > 5000 г/моль.
Молекулы ВМС представляют собой длинные цепи, состоящие из многократно повторяющихся группировок атомов, поэтому их называют макромолекулами.
Биополимеры
Одной из важнейших групп ВМС, которая особенно интересна для биологии и медицины, являются биополимеры.
Биополимеры – это высокомолекулярные вещества, обеспечивающие жизнедеятельность живых систем.
К ним относятся:
Белки.
Нуклеиновые кислоты (ДНК и РНК)
Полисахариды – целлюлоза, крахмал, гликоген.
Все они выполняют важнейшие различные функции в биосистемах.
Особые свойства ВМС
Полимеры обладают свойствами, которые отличают их от других классов веществ. К ним относятся:
Ø высокая молярная масса
Ø асимметричное строение
Ø гибкость и эластичность
1) Молярная масса полимеров колеблется в широких пределах от 5000 до десятков миллионов г/моль. (таблица 2)
Таблица 2
| полимер | М, г/моль |
| Целлюлоза | 1 000 000 – 2 000 000 |
| Гликоген | 1 000 000 – 4 000 000 |
| Крахмал: амилоза (10-20%) амилопектин (90-80%) | 10 000 – 60 000 до 1 000 000 |
| Гемоглобин | 66 000 – 68 000 |
| Альбумин | более 75 000 |
| Желатин | до 60 000 |
2) Асимметричное строение-длина молекулы в 10 и 100 раз больше, чем диаметр
Диаметр длинных полимерных цепей равен диаметру молекулы низкомолекулярного соединения (НМС). Например, длина макромолекулы целлюлозы составляет 400-800 нм, а диаметр 0,3-0,75 нм. Для образного представления такие молекулы можно сравнить с нитями, имеющими длину от 1 до 4 метров, а диаметр 0,5 мм.
3) Гибкость и эластичность.
Гибкость макромолекул – это способность отдельных звеньев или участков (сегментов) цепи полимера вращаться или колебаться относительно валентных связей – С – С – , что приводит к изменению конфигурации цепи.
барьера требуется энергия, называемая энергией активации.
Гибкость и эластичность полимеров зависит от:
Ø температуры
При повышении температуры благодаря возрастанию кинетической энергии системы может быть снижен энергетический барьер, сегменты цепей будут легко вращаться или колебаться с большей амплитудой, и макромолекулы будут вести себя как гибкие нити, принимая всевозможные конфигурации. Поэтому при повышении температуры гибкость увеличивается.
Ø природы групп атомов в макромолекуле
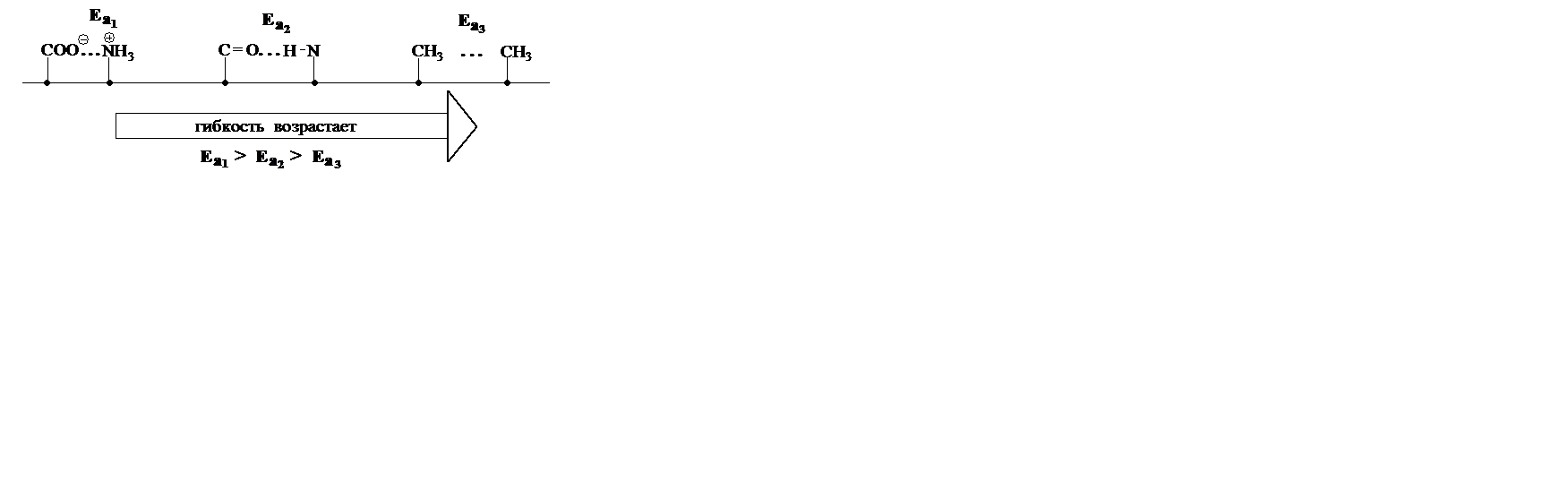 Увеличение в макромолекуле количества полярных групп – ОН, – СООН, – CN, – Cl, усиливает внутримолекулярное взаимодействие, ограничивает свободу колебаний сегментов макромолекулы и понижает ее гибкость.
Увеличение в макромолекуле количества полярных групп – ОН, – СООН, – CN, – Cl, усиливает внутримолекулярное взаимодействие, ограничивает свободу колебаний сегментов макромолекулы и понижает ее гибкость.
Ø расположения групп атомов в макромолекуле
Чем ближе расположены группы атомов, тем им легче взаимодействовать друг с другом и тем меньше гибкость.
Ø длины полимерной цепи и количества сегментов в молекуле
Ø Чем длиннее цепь и больше количество сегментов, тем выше гибкость макромолекул.
Ø Присутствие пластификаторов.
Пластификация – это процесс, в результате которого увеличивается эластичность полимера. С этой целью в полимер можно вводить низкомолекулярные вещества (пластификаторы), которые будут препятствовать взаимодействию цепей макромолекул друг с другом. Для полярных полимеров, например белков, пластификатором является вода, которая, гидратируя полярные группы, препятствует образованию связей между ними. Для неполярных полимеров пластификаторами будут неполярные вещества, например для вулканизированного каучука применяют сажу.
Свойства растворов ВМС.
Растворы полимеров являются лиофильными системами, поскольку между макромолекулами ВМС и молекулами растворителя существует сродство. При растворении ВМС наблюдается процесс сольватации – взаимодействие молекул растворителя с соответствующими группами полимера с образованием сольватных оболочек.
Таким образом, если между полимером и растворителем нет сродства, то получить раствор ВМС невозможно.
Если растворитель вода, то процесс называется гидратацией. В воде будут хорошо растворяться полярные полимеры, например белки. В растворах белков наблюдается два вида гидратации:

Ø Электростатическая
(ион-дипольное взаимодействие)
Ø  Электронейтральная
Электронейтральная
(диполь-дипольное
взаимодействие)
водородные связи
Неполярные полимеры растворяются в неполярных растворителях (например, каучук в бензоле или спирте). При этом происходит процесс сольватации гидрофобных цепей молекулами неполярных органических растворителей за счет Ван-дер-Ваальсовых сил (Еа = 4 кДж/моль), в результате возникает гидрофобный тип сольватации:

Природа растворов ВМС.
В основе современной теории растворов ВМС лежат следующие положения:
Ø Полимеры образуют истинные растворы, в которых частицами дисперсной фазы являются макромолекулы, а не мицеллы. Это обусловлено, во-первых, их асимметричностью; во-вторых, мощной сольватной оболочкой. При таких условиях система гомогенна из-за отсутствия физической поверхности раздела между дисперсной фазой и средой.
Ø В концентрированных растворах полимеров появляется вероятность столкновения макромолекул, что приводит к образованию ассоциатов за счет взаимодействия между участками, лишенными сольватных оболочек. В отличие от мицелл, ассоциаты существуют кратковременно, распадаются и вновь образуются в различных участках объема системы и не являются постоянными кинетическими единицами.
Таким образом, растворы ВМС являются истинными растворами, проявляющими общие свойства с растворами низкомолекулярных соединений.
Свойства растворов ВМС общие с
истинными растворами НМС
Ø Самопроизвольность образования
Ø Термодинамическая устойчивость
Ø Обратимость
Самопроизвольность образования растворов ВМС объясняется двумя причинами:
-при образовании раствора ВМС система переходит из гетерогенного состояния (сухой полимер – растворитель) в гомогенное (истинный раствор полимера), что приводит к уменьшению поверхностной энергии (DGS < 0) и увеличению энтропии;
-растворение полимеров экзотермический процесс, т.к. сопровождается сольватацией (гидратацией) соответствующих групп атомов, и DНсистемы < 0
С термодинамической точки зрения самопроизвольное протекание процесса обеспечивают энтальпийный (DH < 0) и энтропийный (DS > 0) факторы.
Термодинамическая устойчивость – это способность сохранять агрегативную устойчивость длительное время при неизменных внешних условиях. Устойчивость растворов ВМС обусловлена их гомогенностью и, как следствие, отсутствием стремления системы к уменьшению поверхностной энергии, а также самопроизвольным образованием растворов, которое сопровождается уменьшением свободной энергии (DG < 0).
Обратимость растворов ВМС. Обратимость – это способность растворов ВМС обратимо изменять свои свойства при изменении определенных факторов (концентрации, температуры, давления, рН среды и т.д.). Например, если из раствора полимера удалить часть растворителя, а потом снова добавить такое же количество жидкости, то полученный раствор будет иметь свойства исходного раствора. Примером обратимости являются процессы высаливания и лиофильной сушки.
Свойства растворов ВМС общие с коллоидными растворами
Растворы полимеров имеют общие свойства с коллоидными растворами. К ним относятся:
Ø Одинаковая степень дисперсности:
Для ВМС Д = 10 8– 10 9м –1
Для коллоидных частиц Д = 10 7– 10 9м –1
Ø Малая скорость диффузии
Ø Не способность макромолекул проникать через полупроницаемые мембраны
Особые свойства растворов ВМС
Ø Аномально высокая вязкость
Ø Более высокое осмотическое давление, чем рассчитанное по уравнению Вант-Гоффа
Ø Защитное действие ВМС по отношению к коллоидным растворам
Ø Явление коацервации
Ø Способность к желатинированию (структурированию)
Вязкость растворов ВМС
Растворы полимеров обладают более высокой вязкостью по сравнению с растворами низкомолекулярных соединений.
Основные причины:
-длинные разветвленные макромолекулы не способны ориентироваться в одном слое текущей жидкости, попадая в слои, текущие с меньшей скоростью, они замедляют течение жидкости, что приводит к увеличению вязкости;
-в результате сольватации макромолекул в растворах уменьшается доля свободного растворителя, что приводит к уменьшению текучести раствора;
-в концентрированных растворах ВМС макромолекулы образуют внутренние структуры, иммобилизирующие часть растворителя, что приводит к резкому повышению вязкости.

Аномально высокую вязкость в концентрированных
растворах полимеров называют структурной.
Структурная вязкость имеет особенности:
- Увеличивается со временем.
В результате теплового движения макромолекул несольватированные участки молекул сближаются, возникают межмолекулярные связи, что приводит к образованию ассоциатов и иммобилизации растворителя. Изменяется при механическом воздействии. Это явление называется тиксотропией.
Тиксотропия – это свойство концентрированных растворов ВМС обратимо изменять вязкость под влиянием механического воздействия. При встряхивании или перемешивании концентрированных растворов ВМС механически разрушаются непрочные внутренние структуры, вязкость уменьшается.
Например: протоплазма клетки, синовиальная жидкость, хрусталик глаза обладают тиксотропными свойствами.
Осмотическое давление растворов ВМС.
Осмотическое давление растворов ВМС выше, чем рассчитанное по уравнению Вант-Гоффа. Это объясняется следующими причинами:
- Макромолекулы, благодаря гибкости, образуют петли и сегменты, которые ведут себя как отдельные кинетические единицы. Таким образом, в растворе ВМС осмотически активными частицами являются не макромолекулы, а их сегменты. Чем больше гибкость полимера, тем больше сегментов и соответственно выше осмотическое давление раствора.
- 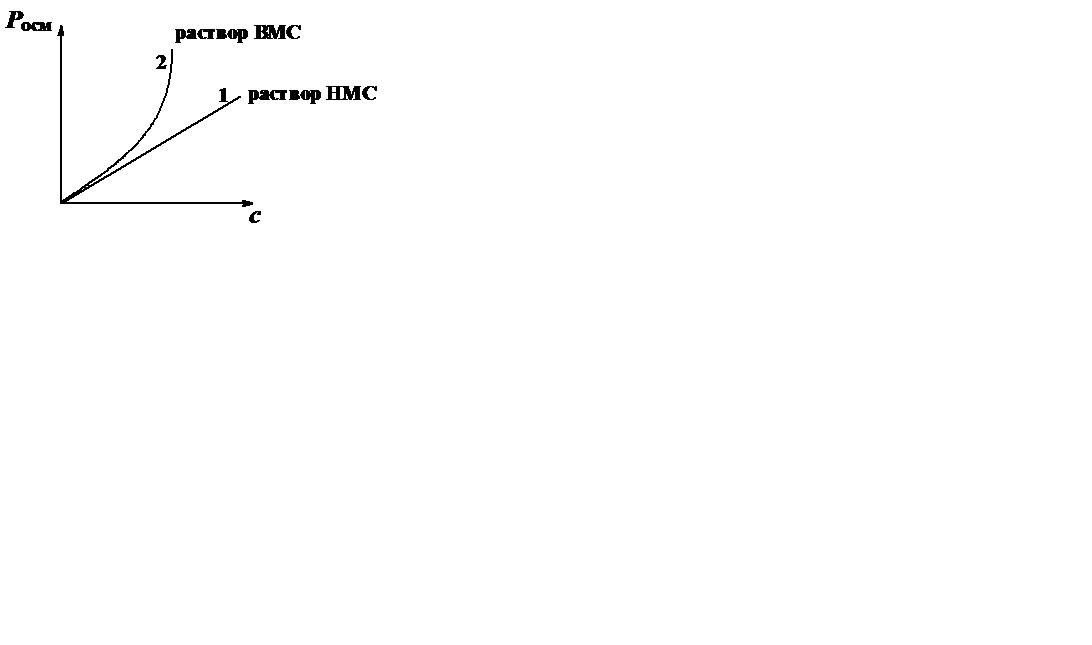 В результате сольватации макромолекул часть растворителя связывется, поэтому уменьшается доля свободного растворителя и увеличивается концентрация раствора, а, следовательно, и осмотическое давление.
В результате сольватации макромолекул часть растворителя связывется, поэтому уменьшается доля свободного растворителя и увеличивается концентрация раствора, а, следовательно, и осмотическое давление.
Зависимость осмотического давления от концентрации для растворов НМС (1) и растворов ВМС (2)
Защитное действие ВМС в коллоидных растворах.
Введение в коллоидные растворы полимеров значительно повышает их устойчивость. Такое явление называется коллоидной защитой. Защитным действием обладают белки, углеводы, пектины, а для систем с неводной средой – каучук. Защищенные золи более устойчивы к действию электролитов. Механизм защитного действия зависит от строения полимера. Глобулярные гидратированные (сольватированные) белковые молекулы адсорбируются на коллоидных частицах, сообщая им дополнительные факторы устойчивости – заряд и мощную сольватную оболочку.

Схема коллоидной защиты для глобулярных биополимеров
Если полимер имеет фибриллярное (асимметричное) строение, то, наоборот, коллоидные частицы адсорбируются на полимерных цепочках и не могут приближаться на расстояние, при котором действуют межмолекулярные силы.

Схема коллоидной защиты
для фибриллярных биополимеров
Количественной характеристикой защитного действия белков является «золотое число» (предложил Зигмонди) – это количество мг белка, которое необходимо добавить к 10 мл красного золя золота, чтобы предотвратить его коагуляцию (изменение его окраски в синюю) при добавлении 1 мл раствора NaCl с w = 10 %.
Чем меньше «золотое число», тем выше защитное действие полимера.
Коллоидная защита выполняет важную биологическую функцию.
ü Благодаря защитному действию белков крови, нерастворимые в крови вещества: соли (оксалаты, фосфаты и т.д.), холестерин, биллирубиновая известь находятся в диспергированном состоянии и могут переноситься по сосудам током крови.
ü В молоке фосфат кальция находится в диспергированном состоянии благодаря защитному действию белка казеина.
ü В фармации многие лекарственные формы, полученные в коллоидном состоянии, стабилизируются полимерами. Например, протаргол и колларгол – это коллоидные растворы серебра и оксида серебра, защищенные белками.
ü
 Астабилизация – уменьшение устойчивости коллоидного раствора при введении недостаточного количества полимера (меньше «золотого числа»). Происходит адсорбция большого количества коллоидных частиц на полимере, что приводит к седиментации крупных и тяжелых агрегатов (рис.16).
Астабилизация – уменьшение устойчивости коллоидного раствора при введении недостаточного количества полимера (меньше «золотого числа»). Происходит адсорбция большого количества коллоидных частиц на полимере, что приводит к седиментации крупных и тяжелых агрегатов (рис.16).
Схема астабилизации
В организме снижение белков в плазме крови при нарушении обменных процессов приводит к развитию почечно-каменной и желчно-каменной болезням, остеохондроза, атеросклероза и т.д.
Коацервация
Растворы ВМС термодинамически устойчивы при сохранении неизменными внешних условий. Если в раствор полимера ввести электролиты, резко изменить температуру или рН среды, то будет наблюдаться явление коацервации.
Коацервация – это разделение раствора ВМС на концентрированный и разбавленный растворы.
Сольватная оболочка макромолекулы в растворе состоит из двух слоев: плотного и диффузного. Плотный сольватный слой образуется при непосредственном взаимодействии молекулы полимера с молекулами растворителя. Диффузный сольватный слой слабее связан с макромолекулой, более удален от нее, имеет меньшую плотность и обуславливает гомогенность системы.
При введении небольшого количества электролитов, ионы которых обладают дегидратирующим действием (Cl -, SO42- ) или в состоянии близком к изоэлектрической точке, происходит разрушение диффузного сольватного слоя. Это приводит к возникновению в системе гетерогенности и появлению поверхностной энергии. В системе появляется стремление к уменьшению поверхностной энергии, молекулы ВМС сближаются и образуется общий диффузный слой. При этом полного слияния макромолекул не происходит, так как этому мешает плотная сольватная оболочка и одноименный заряд.
 На первой стадии коацервации из двух макромолекул, объединенных одной диффузной оболочкой, образуется первичная коацерватная (ультрамикроскопическая) капля.
На первой стадии коацервации из двух макромолекул, объединенных одной диффузной оболочкой, образуется первичная коацерватная (ультрамикроскопическая) капля.
Образование первичной ультрамикроскопической капли
На второй стадии из роя первичных капель образуется вторичная капля, видимая в обычный микроскоп. Раствор разделяется на концентрированный и разбавленный.

Вторичная коацерватная капля
При смешивании растворов противоположно заряженных белков наблюдается комплексная коацервация, протекающая с большей скоростью.
Коацервация играет важную роль в биологических процессах, совершающихся на клеточном уровне. Явление коацервации лежит в основе процесса получения лекарственных форм в виде микрокапсул.
Дата добавления: 2016-03-10; просмотров: 1735;
