Биосинтез белка - реализация наследственной информации (экспрессия генов)
Теоретические вопросы молекулярных основ наследственности
Носителями наследственной информации в клетке является нуклеиновые кислоты. Существуют два типа нуклеиновых кислот: ДНК - дезоксирибонуклеиновая и РНК - рибонуклеиновая кислота, они отличаются химическим строением и биологическими свойствами. Нуклеиновые кислоты представляют собой нерегулярные биополимеры, мономерами которых служат нуклеотиды, состоящие из 3-х компонентов: 1) остатка молекулы фосфорной кислоты, 2) моносахарида - пентозы (рибоза или дезоксирибоза) 3) одного азотистого основания (пурина или пиримидина): аденин (А), гуанин (Г), цитозин (Ц), тимин (Т), урацил (У).
В состав ДНК входит моносахарид дезоксирибоза С5Н10О4, в РНК - рибоза С5Н10О5 (с чем и связаны различия в наименовании нуклеиновых кислот).
Азотистые основания А, Г, Ц встречаются в ДНК и РНК, но тимин входит в состав только ДНК, а урацил - только в РНК.
Наследственная информация записывается с помощью генетического кода, она заключена в последовательности нуклеотидов ДНК, одним триплетом или кодоном, кодируется одна аминокислота. Генетический код - это система записи информации в молекулах м-РНК о расположении аминокислот в молекулах белка. Информация «переписывается» в ядре с молекулы ДНК на м-РНК.
Основные биологические функции ДНК заключаются в: 1) хранении, 2) самовоспроизведении (репликации), 3) передаче генетической информации, путем редупликации ДНК дочерними клетками в процессе индивидуального развития и передаче наследственной информации из поколения в поколение через половые клетки, 4) ДНК участвует в качестве матрицы в процессе передачи информации из ядра к месту синтеза белка - репликация м-РНК.
Кроме того, ДНК имеет свойства репарации (восстановления структуры ДНК), рекомбинации и мутации, обусловливающие наследственную изменчивость организмов. Вот такие чрезвычайно важные и необходимые функции и свойства имеет и выполняет ДНК как для поддержания, так и воспроизведения жизни на Земле.
Биологическая роль РНК связана преимущественно с синтезом белка, т.е. с реализацией наследственной информации. Именно м-РНК является посредником (матрицей) между ДНК, находящей в ядре и строящейся белковой молекулой на полирибосоме в цитоплазме, р-РНК входит в состав рибосом, а т-РНК транспортирует аминокислоты к месту синтеза белка. По структуре различают двухцепочечные РНК, являющиеся хранителями генетической информации у вирусов растений и ряда вирусов животных, и одноцепочечные РНК. В цепочку РНК нуклеотиды соединяются путем образования связей между рибозой одного нуклеотида и остатком фосфорной кислоты другого.
Большую часть РНК составляет рибосомальная РНК - р-РНК (80%-90%), входящая в состав рибосом, расположенных в цитоплазме, она включает от
3 до 5 тысяч нуклеотидов. Молекулы информационной РНК - м - РНК могут состоять из 300-30000 нуклеотидов, на ее долю приходится до 5% всей РНК. Транспортные РНК (т-РНК) включают 75-95 нуклеотидов, их количество составляет 5-10 %. Если рибонуклеиновые кислоты преимущественно располагаются в цитоплазме, (от 3% до 7% р-РНК содержится в ядрышке ядра), то ДНК локализована в ядре, в цитоплазме она находится в митохондриях и хлоропла-стах растений.
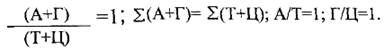 |
Способность ДНК к авторепродукции и способность со бмп. носителем наследственной информации обусловлена особенностью ее строения. Молекула ДНК по Д.Уотсону и Ф.Крику (1953 г.) представляет собой двойную спираль, состоящую из двух закрученных антипараллельных полинуклеoтидных цепей вокруг собственной оси, соединенных водородными связями азотистых оснований, причем спаривание оснований ДНК высоко специфично, адениловый нуклеотид комплементарен только тимидиловому (2-е водородные связи), а гуаниловый - цитидиловому (3-й водородные связи). Аденин и гуанин относится к пуриновым азотистым основаниям, а тимин и цитозин к пиримидиновым, сумма пуриновых оснований Σ(А+Г) равняется сумме пиримидиновых Σ(Т+Ц)
Правило Чаргаффа.
Расстояние между нуклеотидами 0,34 нм, полный виток включает 10 нуклеотидов, его длина 0,34 нм х 10=3,4 нм, диаметр ДНК - 2 нм.
Остов цепи состоит из чередующихся молекул фосфата и сахара. В каждой отдельной цепи нуклеотиды соединяются между собой путем образований фосфодиэфирных связей между дезоксирибозой одного и остатком фосфорной кислоты последующего нуклеотида, так как начало цепи всегда несет фосфатную группу в положении 51, а у третьего атома углерода С-31 имеется гидроксильная группа, это позволяет выделить в ней направление 51—З1 концы и данной цепи, в другой цепи ДНК фосфодиэфирная связь устанавливается в обратном направлении З1→51, поскольку полинуклеотидные цепи антипаралельны 51 конец одной цепи соединяется с З1 концом другой, и наоборот. Отношение (А+Т)/(Г+Ц) специфично для каждого вида организмов (коэффициент специфичности), у кишечной палочки он составляет 0,43; у эукариот 1,50.
В структурной организации молекулы ДНК можно выделить первичную структуру – одну полинуклеотидную цепь, вторичную – две комплементарные друг другу и антипараллельные полинуклеотидные цепи, соединенные водородными связями. Такое состояние обеспечивает прочную и относительную стабильность ДНК, а также сохранение равного расположения между нуклеотидами на всем протяжении молекулы ДНК. И третичная структура – трехмерная спираль ДНК. В одну молекулу ДНК может входить от 106 до 108 и более нуклеотидов, таким образом, ДНК — биополимер с очень большой молекулярной массой.
Как было отмечено выше, одним из свойств наследственного материала является его способность к самокопированию - репликации, или редупликации, что обусловлено особенностями химической организации молекулы ДНК, состоящей их двух комплементарных цепей. С помощью фермента геликазы двойная спираль расплетается и при участии фермента ДНК - полимеразы на каждой цепи материальной молекулы ДНК синтезируется комплементарная ей цепь. В итоге из одной двойной спирали ДНК образуются две идентичные двойные спирали, такой способ удвоение молекул, при котором каждая дочерняя молекула содержит одну материнскую и одну вновь синтезированную цепь, называют полуконсервативным.
В 1958 г. Ф. Крик сформулировал центральную догму молекулярной биологии, указав, что перенос информации протекает следующим образом: ДНК→ РНК→белок. В 1970 г. была открыта обратная транскриптаза X. Теминым и Д. Балтимором и догма приобрела следующий вид: ДИК↔РНК→белок.
Биосинтез белка - реализация наследственной информации (экспрессия генов)
Многообразие свойств белковых молекул определяется их первичной структурой, т.е. последовательностью аминокислот. При биосинтезе белка в живых системах, в отличие от неживой природы, реализуется два ее фундаментальных принципа: 1) принцип коплементарности; 2) принцип матричности, который осуществляется при синтезе ДНК, всех видов РНК, при делении клеток, при биосинтезе белка.
Биосинтез белка делится на несколько этапов: транскрипцию и трансляцию. Транскрипция - переписывание информации путем синтеза на одной из цепей молекулы ДНК молекулы м-РНК,последовательность нуклеотидов которой точно соответствует (комплементарна) последовательности нуклеотидов матрицы - полипептидной цепи ДНК. Существуют механизмы «узнавания» начальной точки синтеза, выбора цепи ДНК, с которой считывается информация, фермент ДНК-зависимая РНК-полимераза садится на ген промотор, и это пусковой механизм, начало транскрипции. РНК - полимераза раскручивает прилежащий виток спирали ДНК, две цепи ДНК в этом месте расходятся, и на одной из них - смысловой, или кодогенной, фермент РНК-полимераза осуществляет синтез м-РНК (и-РНК).
Имеются и механизмы завершения транскрипции, точное переписывание идет до тех пор, пока РНК-полимераза не встречает кодоны - терминаторы транскрипции: УАА, УАГ, УГА - стоп-кодоны, к которым нет т-РНК. В этом участке РНК полимераза отделяется как от матрицы ДНК, которая восстанавливает двухцепочечную структуру, так и от вновь синтезированной м-РНК.
Трансляция - передача или перевод информации, заключенной в последовательности нуклеотидов молекулы м-РНК в последовательность аминокислот полипептидной цепи.
У прокариот (бактерии и цианобактерии), не имеющих оформленного ядра, рибосомы могут связываться с вновь синтезированной молекулой м-РНК сразу же после ее отделения от ДНК или даже до полного завершения ее синтеза.
У эукариот м-РНК сначала должна быть доставлена через ядерную оболочку в цитоплазму. Перенос осуществляется специальными белками, которые образуют комплекс с молекулой м-РНК. Кроме транспорта м-РНК к рибосомам эти белки защищают м-РНК от повреждающего действия цитоплазматических ферментов (комплекс м-РНК с белками в ядре носит название - информоферы, в цитоплазме заменяются белки и название комплекса м-РНК с белками - информосомы).
Для осуществления трансляции необходим процесс рекогниции - узнавание т-РНК своих аминокислот, он проходит в два этапа аминокислоты (А) активируется АТФ и узнающими ферментами (Е) - аминоацил т-РНК синтетазами. В цитоплазме существует целый набор таких ферментов, которые способны к пространственному узнаванию, с одной стороны, своей аминокислоты, а с другой - соответствующего ей антикадона т-РНК
I А+АТФ+Е→АДФ +АфЕ—аминоациладенилат (первый этап);
на втором этапе АфЕ (аминоациладенилат) соединяется с т-РНК (с ОН - группой, находящейся на 3 — конце соответствующей т — РНК, а аминокислота присоединяется своей карбоксильной группой), в итоге образуется аминоациладенилат т-РНК синтетаза.
Транспортные РНК имеют вид клеверного листа (тройчатый сложный лист), на черешке листа - акцепторный участок, содержащий семь пар оснований, имеется и одноцепочечный участок, который заканчивается последовательностью ЦЦА у всех т-РНК (а всего т-РНК в клетке более 60 видов, в связи с вырожденностью генетического кода), со свободной ОН - группой, к этому концу присоединяется транспортируемая аминокислота. Противоположный участок акцепторому черешку листа содержит в центре петли антикодон. Антикодон - это три нуклеотида, комплементарные коду м-РНК, который шифрует аминокислоту, доставляемую т-РНК к месту синтеза белка. Таким образом,с помощью системы т-РНК язык нуклеотидной последовательности м-РНК транслируется в язык аминокислотной последовательности пептида.
Биосинтез белка происходит на полирибосомах. Информационная матричная-РНК проходит по борозде (желобок) между двумя субчастицами рибосом. Полирибосома предоставляет собой м-РНК с нанизанными на ней рибосомами. Рибосомы про- и эукариот очень сходны по структуре и функциям. Они состоят из 2-х субчастиц большой и малой. У эукариот малая субчастица образована одной молекулой р-РНК и 33 молекулами разных белков. Большая субчастица объединяет три молекулы р-РНК и около 40 белков. Прокариотические рибосомы и рибосомы митохондрий и пластид содержат меньше компонентов.
Рибосомы формируются в ядрышке ядра, но обе субчастицы соединяются при участии катионов Mg только во время синтеза белка.
В рибосомах имеются две бороздки, в одной из них располагается м-РНК, в другой удерживается растущая полипептидная цепь. Кроме того, в рибосомах выделяют два участка, связывающих т-РНК: 1) А - участок аминоацильный, где размещается аминоацил - т-РНК, несущая определенную аминокислоту; 2) П -участок пептидильный, в котором происходит сборка аминокислот, соединенных пептидными связями.
Через одну рибосому в данный момент проходит сегмент м-РНК протяженностью 30 или более нуклеотидов, но считывается только два триплета двумя т-РНК, расположенные рядом с м-РНК. В ходе трансляции можно выделить три фазы: 1) инициация (начало синтеза пептида); 2) элонгация (наращивание полипептидной цепи); 3) терминация (завершение синтеза пептида), для инициации трансляции нужен инициирующий кодон-АУГ, несущий информацию об аминокислоте - метионин.
Соответственно антикодон т-РНК, несущий метионин к рибосоме, должен представлять собой УАЦ.
Антикодон инициаторный т-РНК (УАЦ) позволяет малой субчастице присоединиться к старт-кодону АУТ м-РНК, после чего происходит соединение большой и малой субчастиц и формируется функциональная рибосома. Затем молекула инициаторный т-РНК и связанный с ней метионин оказывается в П-пептидильном участке рибосомы. В А-участок рибосомы входит следующий код он м-РНК (например УУУ). За счет комплементарного спаривания нуклеотидов кодона м-РНК - УУУ и антикодона т-РНК - ААА, аминокислота фенилаланин попадает в А-участок.
Таким образом, узнавание комплементарности кода м-РНК антикодону т-РНК происходит через малую субчастицу в ее А-участке. Посредством специального фермента, находящегося в рибосоме, карбоксильная группа метионина (-СООН) присоединяется к аминогруппе фенилаланина (-NH2) и образуется дипептид метионин (CO-NH-) фенилаланин, связанный с т-РНК фенилаланина. Затем кодон УУУ м-РНК переходит в П-участок, а А-участок освобождается для следующего кодона, рибосома прерывисто передвигается по м-РНК, т.е. сделает один шаг после встраивания аминокислоты с т-РНК в полипептидную цепь (либо скользит прерывисто сама м-РНК). В освобожденный А-участок поступает следующий кодон, например ГУГ, несущий информацию об аминокислоте валин.
Снова происходит спаривание кодона ГУГ м-РНК с антикодоном т-РНК -ЦАЦ, т.е. их комплементарное взаимодействие, в случае комплементарности между фенилаланином и валином образуется пептидная связь, фенилаланин теряет связь со своей т-РНК, образуется трипептид с т-РНК валина, а рибосома делает прерывистый следующий шаг, соответствующий одному кодону. Теперь следующий кодон м-РНК приходит в контакт с А-участком рибосомы, где он будет «опознан» специфически антикодоном т-РНК, с соответствующей здесь аминокислотой. И так считывается триплет за триплетом, т.е. происходит удлинение пептида, фаза элонгации. Она включает в себя реакции от момента образования первой пептидной связи до присоединения последней аминокислоты.
Фаза терминации, или завершения синтеза полипептида прекращается когда в А-участок рибосомы входит один из стоп-кодонов (УАА, УАГ или УГА, как указывалось выше, к ним нет т-РНК. Особый белковый фактор освобождения связывается со стоп-кодоном, попавшим в А-участок рибосомы. Прим этом к последней аминокислоте в пептидной цепи присоединяется вода, и ее карбоксильный конец отделяется от т-РНК.
В результате завершения пептидная цепь теряет связь с рибосомой, которая распадается на две субчастицы. Таким образом, на рибосоме синтезируется первичная структура белковой молекулы, обусловленная пептидной или ковалентной взаимосвязью между аминокислотами. Для включения одной аминокислоты в полипептидную цепь необходимо 3 молекулы АТФ. Сборка пептидной цепи у бактерий осуществляется с большой скоростью, зависящей от температуры: при 37°С она выражается в добавлении к полипептиду от 12 до 17 аминокислот в 1 секунду, у эукариот эта скорость ниже и выражается в добавлении двух аминокислот в 1 секунду.
Дата добавления: 2016-03-05; просмотров: 3485;
