ГЛАВА 341. ДИАГНОСТИЧЕСКИЕ МЕТОДЫ В НЕВРОЛОГИИ
К. X. Чиаппа, Дж. Б. Мартин, Р. Р. Янг (К. Н. Chiappa, J. В. Martin, R. R. Young)
В клинической неврологии для постановки диагноза иногда достаточно проанализировать и правильно интерпретировать данные, полученные при тщательном выяснении анамнеза и осмотре больного. Поэтому специальными лабораторными методами нередко лишь подтверждают первоначальный диагноз. Но гораздо чаще при обычном обследовании пациента не удается прийти к окончательному суждению о природе заболевания. Число возможных форм патологии удается ограничить двумя—тремя, но точный диагноз не может быть поставлен. В подобных ситуациях прибегают к лабораторным исследованиям, рассматриваемым ниже.
Следует обратить внимание на то, что лабораторные методы нужно использовать после проведения клинического обследования. Исключением являются неотложные состояния, когда заболевание представляет собой угрозу для жизни больного и времени для детального клинического наблюдения нет. Лабораторные методы представляют собой часть клинического обследования, описанного в гл. 10. Поскольку для проведения многих из этих процедур требуются значительные материальные и временные затраты, а иногда они опасны и болезненны, к ним следует прибегать лишь в тех случаях, когда необходимые данные невозможно получить каким-либо иным путем.
Люмбальная пункция и исследование спинномозговой жидкости
Информация, полученная при исследовании спинномозговой жидкости (СМЖ), часто имеет решающее значение.
Показания к проведению люмбальной пункции. Люмбальная пункция проводится со следующими целями:
1. Измерение ликворного давления и получение пробы СМЖ для клеточного, химического и бактериологического исследования.
2. Как дополнительная лечебная процедура для введения спинальных анестетиков, иногда антибиотиков и противоопухолевых препаратов.
3. Для введения воздуха при воздушной контрастной миелографии или реже — пневмоэнцефалографии; рентгеноконтрастного вещества (пантопак) или водорастворимого контрастного препарата для миелографии; радиоактивного вещества (например, индия или сывороточного альбумина, меченного радиоактивным йодом) с целью исследования ликвородинамики и дополнительной диагностики гидроцефалии и утечки СМЖ.
Проведение люмбальной пункции довольно опасно в случаях значительного повышения давления СМЖ (что подтверждается наличием головной боли и отеком диска зрительного нерва). При этом возрастает риск развития фатального ущемления ствола мозга в вырезке намета мозжечка или в большом затылочном отверстии. В сомнительных случаях до рассмотрения вопроса о люмбальной пункции целесообразно провести компьютерную томографию (КТ) или ЯМР-томографию для исключения объемного образования головного мозга. Однако если у конкретного больного, у которого предполагают повышение внутричерепного давления, данные анализа СМЖ представляются важными, то можно произвести люмбальную пункцию с помощью тонкой иглы (калибра 22—24) как заключительный этап клинического обследования. (Отметим, что если давление ликвора превышает 400 мм рт. ст., то следует получить необходимое количество СМЖ, вывести иглу и затем в соответствии с предполагаемым клиническим диагнозом и состоянием пациента назначить ему адекватную дозу мочевины или маннитола.) Введение дексаметазона (декадрона) рекомендуют начинать с дозы 4—6 мг каждые 4 ч в случаях опухоли, черепно-мозговой травмы, кровоизлияния в мозг и некоторых форм энцефалитов (острый геморрагический лейкоэнцефалит, энцефалит, вызванный вирусом простого герпеса).
Цистернальная и боковая шейная пункции (CґI—СII) безопасны, если их выполняет специалист, однако их проведение нельзя доверить врачу без достаточного опыта. Предпочтительнее проведение люмбальной пункции, за исключением случаев явного спинального блока, при которых необходимо взятие пробы цистернальной жидкости или проведение миелографии над патологическими очагами, либо тех редких ситуаций, когда введение иглы становится опасным в связи с инфекционным поражением кожных покровов и подкожной клетчатки.
Люмбальную пункцию всегда следует проводить в стерильных условиях. Для обезболивания в кожу и подкожную клетчатку вводят новокаин. Если две—три попытки попасть в субарахноидальное пространство оказались неудачными, проведение больному пункции можно осуществить в положении сидя, а затем с помощью ассистента перевести его в положение лежа на боку для измерения давления и взятия пробы СМЖ. «Сухой прокол» гораздо чаще обусловливается неправильным направлением введения иглы, чем патологической облитерацией субарахноидального пространства патологическим очагом, сдавливающим спинной мозг, или хроническим адгезивным арахноидитом. Если проба кровянистая в результате прокола менингеального сосуда, то при неверной интерпретации характера изменений ликвора можно допустить безнадежную диагностическую ошибку, заподозрив кровоизлияние в субарахноидальное пространство и желудочки мозга. С особой осторожностью следует проводить люмбальную пункцию больным с тромбоцитопенией и нарушениями свертывания крови из-за опасности тяжелых кровоизлияний в эпидуральное и интрадуральное пространства.
Процедуры исследования. После успешного проведения люмбальной пункции исследуют следующие свойства СМЖ: 1) давление и ликвородинамические пробы;
2) внешний вид ликвора, при наличии примеси крови провести центрифугирование и определить ксантохромию надосадочной жидкости; 3) число и тип клеток, наличие микроорганизмов; 4) содержание белка, сахара, в особых случаях — анализ пигментов; 5) послойное цитологическое исследование с использованием микрофильтров;
6) реакция Вассермана и соответствующие серологические реакции преципитации;
7) иммуноэлектрофорез белка с целью определения уровней гамма-глобулинов и другие специальные биохимические тесты (для NH3, рН, СO2, ферментов и т. д.);
8) бактериологические посевы и выделение вируса. Нормальные характеристики СМЖ приводятся в приложении.
Радиологическое исследование черепа и позвоночника
Обычная рентгенография черепа и позвоночника составляет неотъемлемую часть подробного обследования в случаях патологии травматического, спондилогенного и неопластического характера, но имеет довольно ограниченное значение при других заболеваниях. Методика относительно проста, и полученные данные могут быть интерпретированы большинством общепрактикующих радиологов. Объем настоящего издания не позволяет проиллюстрировать такие часто встречающиеся нарушения, как переломы, костная эрозия, внутричерепные кальцификаты, преждевременное закрытие или расхождение швов, изменения конфигурации черепа.
Более важное значение в неврологии и нейрохирургии имеют шесть специальных радиологических методов, которые в настоящее время делают возможной визуализацию большинства отделов головного и спинного мозга, а также их сосудов.
Компьютерная томография (КТ). В ходе данной радиологической процедуры проводят компьютерную обработку показателей абсорбции более чем 30 тыс. 2—4 мм рентгеновских лучей мозгом, СМЖ и черепом. В результате этого осуществляется визуализация желудочков, субарахноидального пространства и основных цистернальных щелей и борозд в некоторых горизонтальных плоскостях (рис. 341-1. а—д). КТ проводят во многих медицинских центрах, где этот метод заменил собой обычное рентгенологическое обследование и большинство других контрастных методов, таких как пневмоэнцефалография и артериография. КТ позволяет дифференцировать эпидуральные, субдуральные и внутримозговые кровоизлияния, изменения со стороны желудочковой системы с объемными процессами, а также обнаруживает опухоли, абсцессы, гранулемы [при проведении КТ после внутривенного введения меглумина диатризоата (ренографии) или других контрастных веществ], зоны отека мозга, очаги инфаркта, гидроцефалию и атрофию мозга. Простота этой неинвазивной процедуры, минимальный риск для больных с обширными поражениями, низкая доза рентгеновского облучения поистине революционизировали диагностическую неврологию и нейрохирургию.
ЯМР-томография. Современное применение ядерного магнитного резонанса (ЯМР) позволяет визуализировать поражения мозга, не выявляемые при КТ (рис. 341-2, 341-3, 341-4). Метод ЯМР-томографии неинвазивен и не влечет воздействия ионизирующей радиации. Данное исследование обеспечивает возможность разграничения тканей без контрастного усиления, и, поскольку костная ткань не дает интерференции, метод особенно удобен для визуализации базальных структур мозга, прежде всего в задней черепной ямке. Метод ЯМР уже значительно расширил диагностческие возможности нейрорадиологии, а в перспективе ЯМР-спектроскопия должна стать способом определения метаболитов в мозге. Высокая разрешающая способность ЯМР-томографии в разграничении белого и серого вещества обусловливает ее широкое применение с целью установления локализации поражений в белом вещества, например вследствие демиелинизации. Метод используется также для визуализации спинного мозга, причем как на сагиттальных, так и на поперечных «срезах».
Ангиография. Этот метод совершенствовался на протяжении последних 30 лет до тех пор, пока не стал относительно безопасным и исключительно ценным для диагностики артериальных окклюзий, аневризм и сосудистых мальформаций, опухолей, абсцессов и внутричерепных кровоизлияний. Нр после открытия КТ и ЯМР-томографии он стал использоваться гораздо реже. После местной анестезии осуществляют чрескожное введение иглы или канюли в просвет плечевой или бедренной артерии; возможно введение катетера, проведение его через аорту с канюляцией магистральных артерий в области шеи. Введение контрастного вещества позволяет визуализировать дугу аорты, начальные участки каротидной и вертебральной систем кровоснабжения, ход сосудов через область шеи в полость черепа и при соответствующих показаниях, артерии спинного мозга. В оптимальных условиях возможно четко показать церебральные артерии с диаметром просвета до 0,1 мм, а также мелкие вены аналогичного диаметра, сосудистые аномалии (ангиомы, аневризмы), окклюзированные артерии, замедление скорости кровотока в связи с повышением внутричерепного давления при объемных процессах и закупорках синусов твердой мозговой оболочки и вен, смещение сосудов объемным процессом или невозможность заполнения интракраниальных сосудов при смерти мозга. Дигитальная субтракционная венозная ангиография, при которой контрастное вещество вводится в плечевую вену под давлением, рассматривают как альтернативный или дополнительный метод, особенно при необходимости первичного исследования диаметра просвета крупных экстракраниальных артерий.
Пневмоэнцефалография и вентрикулография. Введение воздуха в субарахноидальное пространство во время люмбальной пункции, выполняемой в положении больного сидя, дает возможность детальной визуализации размеров и расположения желудочков, субарахноидального пространства (вышележащего спинального и церебрального) и, опосредованно, структур, находящихся между желудочками и оболочками мозга. Однако в настоящее время этот метод используют редко. Вместо воздушной миелографии с целью выявления полостей внутри спинного мозга (сирингомиелия)
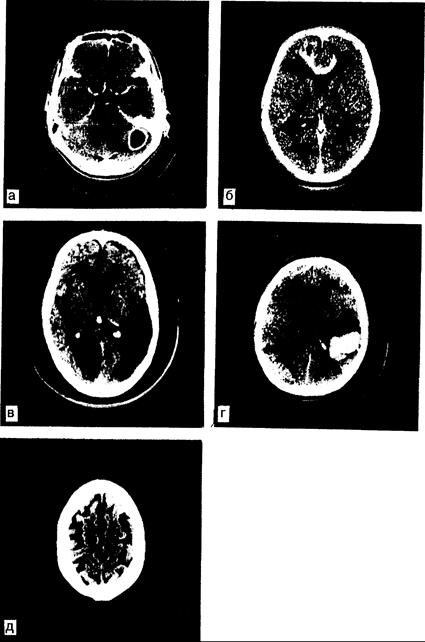
Рис. 341-1. Компьютерные томограммы при различных заболеваниях. Лобные доли расположены выше; правое полушарие находится слева от читателя. а — абсцесс левого полушария мозжечка, развившийся как осложнение инфекции сосцевидного синуса. На снимке с контрастным усилением видно типичное «кольцевидное» контрастирование; б — злокачественная астроцитома с инфильтративным прорастанием в мозолистое тело и белое вещество обеих лобных долей. Видна зона отека вокруг опухоли в лобных долях; в — массивные двусторонние инфаркты мозга: в бассейне правой задней мозговой артерии и бассейне левой средней мозговой артерии; г — внутримозговая гематома в левой теменной доле. Кровь в зоне кровоизлияния выявляется без введения контрастного вещества; д — атрофия коры головного мозга при болезни Альцгеймера.
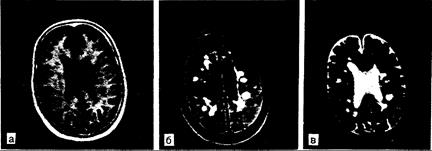
Рис. 341-2. Рассеянный склероз, диагностированный при ЯМР-томографии. В белом веществе видны множественные очаги патологически удлиненного времени релаксации Т1 и Т2. При Т1 (а) бляшки имеют пониженную плотность. При Т2 (б и в) в бляшках обнаруживают усиление интенсивности сигнала. Атрофия мозга умеренной степени выраженности наиболее заметна на рис. в, где самый яркий сигнал дает спинномозговая жидкость. Хотя частота, локализация и распределение таких изменений у большого числа больных с рассеянным склерозом позволяет считать, что эти очаги патологической релаксации соответствуют бляшкам, имеющихся патологоанатомических подтверждений недостаточно. а — исследование по восстановлению инверсии (IR) : TR (время повторения) — 1500, Т1 (время инверсии) — 450, ТЕ (время эха) — 20; б — исследование по спин-эху (SE):TR=2000, ТЕ=60; в — как и в случае б, но ТЕ=120.
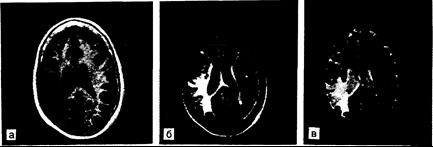
Рис. 341-3. Окклюзия правой внутренней сонной артерии, приведшая к развитию инфаркта в правой теменно-височной области.
При исследовании с восстановлением инверсии (IR) со временем релаксации Т1, временем повторения 1500 мс и временем инверсии 450 мс (а) выявляются области удлинения Т1 (темные) в зонах инфаркта; видны также малые участки с увеличенным временем релаксации в заднефронтальных теменных и височных областях лучистого венца с двух сторон. При времени релаксации Т2 (б и в) обнаруживаются измененные зоны, также характеризующиеся удлиненными показателями Т2 (яркие сигналы); более позднее эхо (ТЕ"" 120 мс) обнаруживает некоторую гетерогенность сигнала, но он имеет неопределенный характер, тогда как области более длительных Т2 (самые яркие зоны) соответствуют инфаркту или отеку. (Последовательности спинового эха: TR=2000, ТЕ=60 в случае б и 120 в случаев.)
сейчас в основном применяют контрастирование с введением метризамида. Вентрикулография, осуществлявшаяся посредством введения воздуха или контрастного препарата непосредственно в боковые желудочки, также имеет главным образом историческое значение. КТ и ЯМР-томография практически заменили как пневмоэнцефалографию, так и вентрикулографию.
Миелография и вентрикулография с иофендилатом (пантопаком). Введение 5—15 мл иофендилата во время люмбальной пункции с последующим изменением положения пациента на наклонном столе дает возможность полностью визуализировать спинальное субарахноидальное пространство и частично — заднюю черепную
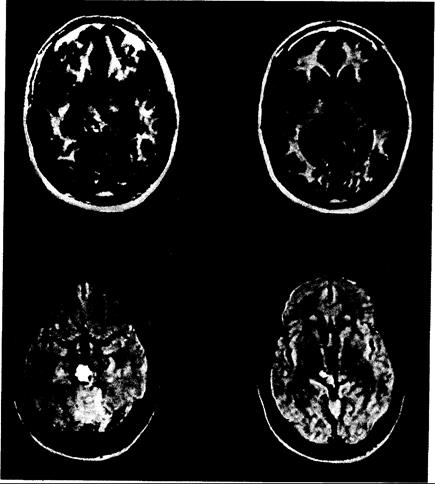
Рис. 341-4. Артериовенозная мальформация (АВМ).
Тромбоз АВМ с вовлечением правой задней субталамической и верхней мезэнцефалической областей. Темные зоны внутри АВМ при исследовании IR, вероятно, представляют собой очаги патологических изменений в мозге и скорее характеризуются удлинением Т1, чем дефектом заполнения («flow void» effects), в сравнении с бассейном средних мозговых артерий. Яркие зоны при исследовании IR характеризуются укорочением Т1 и удлинением показателей Т2; такое сочетание наблюдается при подострых или хронических кровоизлияниях, некоторых жировых поражениях и метастазах меланомы (вверху: исследование IR — TR= 1500, ТЕ=45; внизу: исследование SE — TR=2000, ТЕ=60).
ямку. Эта процедура, как и люмбальная пункция, практически безопасна, так как по окончании исследования иофендилат удаляют через пункционную иглу. Этот метод позволяет точно диагностировать грыжи межпозвонковых дисков на поясничном и шейном уровнях, опухоли спинного мозга. Иногда прибегают к внутрижелудочковому введению иофендилата для визуализации III и IV желудочков мозга, а также сильвиева водопровода при опухолях задней черепной ямки. В настоящее время широко применяют водорастворимые самоабсорбирующиеся контрастные вещества (метризамид). Метризамид, вводимый в СМЖ при люмбальной пункции, обеспечивает дополнительное преимущество при исследовании субарахноидального пространства на компьютерных томограммах тела. КТ тела с использованием метризамида или без такового позволяет четко визуализировать позвоночный канал и спинной мозг. При этом выявляются опухоли, грыжи дисков и другие патологические процессы, сопровождающиеся сдавлением или смещением позвоночного канала и корешков спинного мозга, а также деструкцией позвонков. Последняя определяется и на костных рентгенограммах.
Радиоактивные изотопы. При диагностике опухолей, объемных процессов воспалительного генеза, вирусных энцефалитов и некоторых сосудистых поражений, например инфарктов в зонах смежного кровоснабжения мозга, выявление которых другими способами затруднено, иногда применяют радиоактивные изотопы, например технеций (сканирование мозга). Поскольку этот метод является простым и неинвазивным, единственным ограничением к его применению служит высокая стоимость. Чем значительнее страдает при патологическом процессе гематоэнцефалический барьер, тем четче определяется область поражения при использовании данных методик. С целью выявления смещения срединных структур мозга объемным процессом может также применяться ультразвук.
Позитронная эмиссионная томография
Позитронная эмиссионная томография (ПЭТ) — метод экспериментального исследования, имеющийся сейчас в распоряжении лишь нескольких центров. Процедура включает системное введение позитрон-эмиттирующих радионуклидов кислорода или 18F-дезоксиглюкозы (18ФДГ) с последующим проведением компьютерной томографии. Последняя обеспечивает трехмерную локализацию выделяющихся из ткани позитронов с разрешающей способностью 0.5—1 см. Введение меченых O2, СO2 и 18ФДГ дает возможность количественно оценить регионарное потребление кислорода, кровоток, утилизацию глюкозы. Проведены обследования больных с цереброваскулярными поражениями, судорожными расстройствами, дегенерациями. При инсульте ПЭТ целесообразно выполнять в острой стадии с целью разграничения жизнеспособной и нежизнеспособной ткани. У больных с эпилептическими проявлениями исследование с 18ФДГ в межприступном периоде позволяет выявить зоны сниженного метаболизма глюкозы в эпилептическом очаге и вокруг него, тогда как во время припадка регистрируется усиление метаболизма глюкозы. При изучении обменных процессов с использованием 18ФДГ было продемонстрировано также уменьшение захвата глюкозы в полосатом теле у больных с хореей Гентингтона, у которых при КТ патологических изменений не выявили. Хотя эти работы представляются весьма перспективными в исследовании биохимии функций мозга, стоимость оборудования и требования технологии производства изотопов ограничивают применение ПЭТ наиболее крупными медицинскими центрами.
Электромиография (ЭМГ)
Эту методику осуществляют при клиническом обследовании пациентов с неврологическими заболеваниями, при которых страдает нервно-мышечный аппарат, т. е. с первичными и вторичными поражениями скелетной мускулатуры. Подробнее метод рассматривается в главе, посвященной нервно-мышечным болезням (см. гл. 354). Усовершенствованная методика ЭМГ («центральная ЭМГ») обеспечивает количественный анализ функции двигательной системы.
Электроэнцефалография (ЭЭГ)
ЭЭГ является частью клинического обследования пациента при подозрении на поражение мозга; ее используют также для оценки вовлечения центральной нервной системы (ЦНС) при многих заболеваниях.
Помимо записи в покое, обычно проводятся и так называемые пробы со стимуляцией.
1. Пациенту предлагают делать глубокие дыхательные движения с частотой 20 раз в 1 мин в течение 3 мин. Развивающиеся алкалоз и церебральная вазоконстрикция способны провоцировать характерные признаки судорожной готовности и другие изменения.
2. Перед лицом больного размещается мощный источник света (стробоскоп), который загорается с частотой от 1 до 20 в 1 с, при этом глаза больного открыты, потом закрыты. Вслед за этим у пациентов с фотосенситивностью могут обнаруживаться патологические разряды.
3. Запись ЭЭГ осуществляется после того, как больному дают возможность уснуть естественным образом, или после перорального или внутривенного введения седативных препаратов. Процедуры 1 и 2 используют чаще, но запись во время сна исключительно эффективна для выявления изменений, особенно в случаях височной эпилепсии и некоторых других судорожных состояний. Частым поводом для ночной регистрации ЭЭГ служат предшествующие исследованию нарушения сна.
Для того чтобы ЭЭГ была наиболее результативной, необходимо соблюдать определенные условия. Пациент не должен находиться под воздействием седативных препаратов, оставаться в течение длительного времени без приема пищи, поскольку и седативные средства, и относительная гипогликемия приводят к изменениям нормальной структуры ЭЭГ. То же самое касается состояний психической концентрации, гипервозбудимости и сонливости, каждое из которых способствует угнетению нормального альфа-ритма и усилению мышечных артефактов. При обследовании больных с предположительным диагнозом эпилепсии, которые уже получают лечение по этому поводу, большинство клиницистов предпочитают проводить первую запись ЭЭГ на фоне продолжения приема препаратов.
Типы нормальных записей. В нормальной ЭЭГ у взрослых регистрируются до некоторой степени асимметричные синусоидальные альфа-волны (частота 8—12 Гц, амплитуда 50 мкВ) в затылочных и теменных областях. Эти волны нарастают и убывают спонтанно и обычно быстро исчезают, тогда испытуемый открывает глаза или на чем-то сосредоточивает свое внимание. Более быстрые волны с частотой выше 13 Гц и менее высокой амплитудой (10—20 мкВ), называемые бета-волнами, определяются симметрично в лобных областях. Очень медленные волны (дельта-волны), острые волны и другие необычные колебания в нормальной записи отсутствуют. Когда здоровые испытуемые засыпают, ритм колебаний симметрично выражен и появляются характерные волны (острые волны и сонные веретена в теменных областях); если сон вызван барбитуратами и бензодиазепинами, то определяется усиление высокочастотной активности, которое расценивается как нормальное (см. гл. 20). При избыточной высокочастотной активности следует уточнить, не принимает ли больной какого-либо препарата этих групп.
Во время стробоскопической стимуляции на нормальной ЭЭГ может отмечаться реакция затылочной коры на световые вспышки, называемая вызванной реакцией или при более высокой скорости их повторения — реакцией усвоения ритма фотостимуляции. Клиническая значимость вызванной реакции затылочной коры состоит в том, что она расширяет диагностические возможности ЭЭГ несколькими путями: 1) дает исследователю логическую уверенность в том, что испытуемый по крайней мере воспринимает свет; 2) если вызванная реакция отсутствует в одном полушарии, но определяется в другом, то это служит физиологическим подтверждением наличия поражения, препятствующего нормальному проведению импульсов от зрительного бугра к затылочной доле, локализующегося с той же стороны; 3) если световые вспышки вызывают патологические волны, то это указывает на повышенную возбудимость. При продолжении процедуры активации на ЭЭГ могут провоцироваться истинные судорожные разряды («фотопароксизмальная» реакция); в случае еще более высокой сенситивности могут появиться отчетливые миоклонические подергивания мышц лица и верхних конечностей, генерализованные судороги. Эти явления следует отличать от чисто мышечной реакции, также миоклонического характера, вызываемой в норме в сокращающихся мышцах скальпа и часто заметной при рутинной ЭЭГ (фотомиоклонус).
Типы патологических записей. Наиболее выраженным нарушением является исчезновение кривой ЭЭГ и ее замещение «биоэлектрическим молчанием мозга», означающим, что электрическая активность коры головного мозга, регистрируемая со скальпа, составляет менее 2 мкВ либо отсутствует. Подобная изоэлектрическая ЭЭГ может быть вызвана анестезирующими дозами таких препаратов, как барбитураты, и глубокой гипотермией (менее 70°F). Однако в отсутствие действия препаратов, угнетающих ЦНС, либо глубокой гипотермии «плоский» тип записи (за исключением артефактов) во всех отведениях практически всегда бывает результатом церебральной гипоксии, ишемии или распространенной кортикальной деструкции. Считается, что при отсутствии у больного ЭЭГ-активности, рефлексов, спонтанного дыхания и какой-либо мышечной активности на протяжении 6 ч или более следует говорить о «необратимой коме». У таких больных имеет место обширный некроз мозга. Функцию ЦНС восстановить невозможно, в связи с чем пациента можно считать погибшим, несмотря на сохранность вегетативных (сердечно-сосудистых) функций, поддерживаемых с помощью механических приспособлений, например респираторов. Ни один из более чем 900 больных, обследованных за последние 18 лет в многопрофильной клинике Массачусетса, не стал исключением.
Иногда наблюдаются локальные зоны отсутствия ЭЭГ-активности в случаях обширных инфарктов, массивных поверхностных опухолей мозга или при наличии сгустков, расположенных между корой большого полушария и электродами. Эти изменения позволяют точно установить локализацию патологического очага, но по ним, конечно, невозможно судить о характере процесса. В большинстве случаев размеры патологических очагов слишком малы для непосредственной регистрации с помощью ЭЭГ, но на полученной кривой могут быть зафиксированы патологические волны, исходящие преимущественно из функционально, а не органически измененных участков мозга вокруг зоны поражения. Эти патологические волны медленнее и выше по амплитуде (50—350 мкВ), чем нормальные. Волны с частотой менее 4 Гц называются дельта-волнами, от 4 до 7 Гц — тета-волнами; более высокие по вольтажу и быстрые волны обозначаются как спайки, или острые волны. Иногда быстрые и медленные волны наблюдаются одновременно; когда серии таких волн внезапно, в виде пароксизмов, прерывают относительно нормальную запись ЭЭГ, есть все основания подозревать эпилепсию. Для больных с припадками по типу petit mal (абсансы) характерно появление комплексов «пик-волна» с частотой 3 Гц во всех отведениях ЭЭГ одновременно с последующим внезапным их исчезновением в конце приступа.
Неврологические состояния с патологической ЭЭГ. При нижеперечисленных формах неврологических заболеваний ЭЭГ имеет существенное значение для постановки правильного диагноза.
Эпилепсия. Всем типам генерализованных эпилептических припадков (больших и малых) сопутствуют определенные, периодически регистрируемые электроэнцефалографические изменения. Патологические изменения при ЭЭГ часто выявляются также при более ограниченных типах эпилептических припадков (сложных парциальных, миоклонических, фокальных и джексоновских) (см. гл. 342). Единственным исключением служат некоторые глубокие очаги в височной доле, амплитуда разрядов из которых при приближении к скальпу недостаточна для того, чтобы проявиться на фоне физиологической ЭЭГ-активности, особенно при наличии выраженного альфа-ритма. Определить локализацию эпилептического очага в медиальном отделе височной доли можно с помощью скулового и сфеноидального отведений; обнаруживаемые при этом изменения иногда бывают единственным подтверждением эпилептической активности при ЭЭГ. К числу других исключений, при которых во время припадка иногда не удается зарегистрировать изменений при ЭЭГ, относятся очаговые приступы (сенсорные, джексоновские, миоклонические, epilepsia partiakis continua). Вероятно, данный факт означает, что нейрональный разряд слишком глубок по локализации, дискретен, короток и асинхронен для передачи посредством объемного проведения через череп и записи ЭЭГ-электродами, располагающимися на расстоянии около 2 см от коры больших полушарий. Электроэнцефалографические проявления малых, некоторых миоклонических и больших припадков тесно коррелируют с клиническими формами пароксизмов и могут быть обнаружены в межприступном периоде. Артефакты, обусловленные двигательной активностью во время «приступа», обычно не удается отличить от электрической активности мозга. Разграничение психогенных приступов с истинными эпиприпадками требует тщательного анализа ЭЭГ в начале приступа, когда можно обнаружить характерную высокочастотную активность, или непосредственно после прекращения судорожных движений, когда должны определяться постприступные замедление и угнетение волн в случае расстройства состояния сознания. Нормальный альфа-ритм в постприступном периоде у «нереагирующего» больного позволяет думать о психогенном псевдоэпилептическом припадке.
Важно отметить, что в межприступном периоде у 20% больных с малой и у 40% больных с генерализованной эпилепсией выявляется нормальная ЭЭГ. При лечении антиконвульсантами также наблюдается тенденция к уменьшению выраженности изменений на ЭЭГ. У других 30—40% больных эпилепсией в периоды между приступами выявляют нарушения при записи ЭЭГ, но они носят неспецифический характер, в связи с чем диагноз эпилепсии следует ставить только на основе точной интерпретации клинических данных в совокупности с изменениями на ЭЭГ.
Опухоль, абсцесс мозга и субдуральная гематома. Примерно у 90% больных с проявляющимися клинически внутричерепными объемными образованиями отмечают также изменения на ЭЭГ. Эти изменения зависят'от локализации и формы патологического процесса. Помимо диффузных нарушений, классическими в таких случаях считаются фокальные и локализованные медленные волны (обычно дельта-диапазона), иногда определяется эпилептическая активность со снижением амплитуды и синхронизацией нормального ритма. Самая высокая частота изменений при ЭЭГ наблюдается при более быстро увеличивающихся в размерах, объемных образованиях (абсцесс, некоторые метастазы, глиобластома), в особенности в случае их супратенториальной локализации (в 90—95% случаев при двух последних ив 100% — при абсцессах) . Медленнее растущие опухоли (астроцитомы) и прежде всего новообразования, располагающиеся за пределами больших полушарий мозга (менингиомы, опухоли гипофиза) часто не дают нарушений на ЭЭГ, несмотря на наличие четких клинических проявлений. Электроэнцефалографические изменения имеют четкую латерализацию у 75—90% больных с супратенториальными опухолями и абсцессами, фокальные нарушения на ЭЭГ при метастазе в мозг могут обнаруживаться тогда, когда метастаз еще не виден при КТ. Нормальные результаты ЭЭГ, а также КТ позволяют практически исключить супратенториальную опухоль или абсцесс мозга. Между тем ЭЭГ бывает нормальной у 20—25% больных с субтенториальными опухолями.
Сосудистые заболевания головного мозга. Как диффузные, так и локальные изменения на ЭЭГ, обусловленные сосудистыми поражениями мозга (инфарктами и внутричерепными кровоизлияниями), преимущественно зависят от их локализации и размеров, а не характера патологического процесса. Показано. что ЭЭГ целесообразно проводить при дифференциальной диагностике сосудистой гемиплегии. При локализации поражения в бассейне внутренней сонной или крупной мозговой артерии область снижения нормальной активности или избыточной медленноволновой импульсации практически постоянно четко определяется в соответствующей зоне. Если гемиплегия вызвана поражением сосуда малого калибра, т. е. лакунарным инфарктом, локализующимся в глубинных отделах полушарий или стволе мозга (см. гл. 343), то картина ЭЭГ, как правило, нормальная. Обширные полушарные очаги, при которых отмечается резкое угнетение сознания, также вызывают появление распространенной, диффузной медленноволновой активности неспецифического характера, такой же, какая определяется при ступоре или коме любой этиологии. Разрешение начинается спустя несколько дней, когда уменьшается отек мозга; при этом может отмечаться очаговая активность (медленноволновая активность или угнетение физиологических ритмов). Инфаркты меньших размеров сопровождаются выраженными очаговыми изменениями, которые четко указывают на латерализацию очага, но не позволяют точно локализовать его. В отличие от опухолей разрешение продолжается и в дальнейшем, а спустя 3—6 мес почти у 50% больных с острой цереброваскулярной патологией ЭЭГ нормализуется, несмотря на наличие стойкого неврологического дефекта. В подобной ситуации прогноз неблагоприятный. Выявление в последующем на ЭЭГ умеренно- или высокоамплитудных волн, и в особенности спайков или острых волн, указывает на наличие патологически функционирующей ткани, которая может обладать эпилептогенными свойствами. При остром субарахноидальном кровоизлиянии ЭЭГ может дать полезную информацию о стороне его локализации, при этом выраженность изменений зависит от степени воздействия на подлежащую ткань мозга.
Черепно-мозговая травма. При ушибе или разрыве мозга на ЭЭГ появляются изменения, сходные с таковыми при цереброваскулярной патологии. Диффузные изменения часто уступают место очаговым, особенно при локализации поражений на боковой или верхней стороне полушарий мозга. Если не появляется эпилептической активности, то очаговые изменения обычно исчезают через несколько недель или месяцев. Острые волны или спайки иногда возникают вслед за исчезновением фокальных медленноволновых изменений. Эти нарушения или отсутствие нормализации ЭЭГ обычно предшествуют развитию посттравматической эпилепсии. Поэтому проведение ЭЭГ в динамике после перенесенной черепно-мозговой травмы представляет ценность для определения прогноза эпилепсии.
Заболевания, вызывающие кому и расстройства сознания. Почти при всех состояниях, сопровождающихся какими-либо нарушениями сознания, ЭЭГ имеет патологический характер. При гипотиреозе ритмы нормальной конфигурации, но обычно бывают медленными. В целом, чем глубже расстройства сознания, тем больше изменена картина ЭЭГ. При выраженных нарушениях сознания выявляют билатеральные, высокоамплитудные медленные (дельта) волны, более заметные в записи от лобных областей. Это относится к таким разным состояниям, как острый менингит и энцефалит, резкие изменения газового состава, содержания глюкозы в крови, водно-электролитного баланса, уремия, диабетическая и печеночная кома, нарушения сознания при массивных поражениях мозга. При печеночной коме выраженность изменений на ЭЭГ соответствует стадиям спутанности, ступора или комы. Кроме того, характерны пароксизмы билатеральных синхронных больших острых «трехфазных волн», хотя они также могут присутствовать при других метаболических энцефалопатиях на фоне почечной и легочной недостаточности. Диффузные дегенеративные поражения коры мозга (например, при болезни Альцгеймера) сопровождаются относительно слабо выраженными диффузными медленными волнами тета-диапазона (4—7 Гц). При более быстро прогрессирующих заболеваниях, таких как подострый склерозирующий панэнцефалит (ПСПЭ), болезнь Крейтцфельда—Якоба и в меньшей степени церебральные липидозы, наблюдают, кроме того, очень характерные, почти патогномоничные изменения на ЭЭГ, заключающиеся в повторных комплексных всплесках активности в виде острых и медленных 'волн. Нормальная ЭЭГ у больного, у которого отмечают апатию, вялость, депрессию или снижение памяти, служит одним из свидетельств в пользу диагноза аффективного расстройства или шизофрении.
ЭЭГ может также помочь врачу вести больного, находящегося в коматозном состоянии. По результатам ЭЭГ можно заподозрить такие причины комы, как печеночная энцефалопатия (билатеральные синхронные трехфазные волны), интоксикация барбитуратами или бензодиазепинами (избыточная быстрая активность), не проявляющиеся клинически продолжительные эпилептические разряды, занимающие большой объем очаги поражения, диффузная аноксия-ишемия (признак «вспышка—угнетение» с повторными генерализованными комплексами, разделенными периодами с очень низкой амплитудой кривой ЭЭГ).
Другие поражения мозга. Многие расстройства функций нервной системы вызывают лишь слабые изменения на ЭЭГ или вообще не сопровождаются изменениями. Подобными примерами служат рассеянный склероз и другие демиелинизирующие заболевания, хотя на развернутых их стадиях у 50% больных ЭЭГ носит патологический характер. Алкогольный делирий, болезнь. Вернике— Корсакова и приступы при синдроме отмены сопровождаются незначительными изменениями на ЭЭГ, несмотря на драматический характер клинической картины, причем иногда ЭЭГ может быть вообще не изменена. Некоторая медленноволновая активность обычно сопутствует сумеречным состояниям, обозначаемым как гипокинетический делирий. Следует отметить, что неврозы и психозы, такие как маниакально-депрессивные расстройства и шизофрения, патологические состояния, вызванные галлюциногенными препаратами типа ЛСД, и большинство случаев умственной отсталости сопровождаются незначительными или неспецифическими изменениями.
Специальное применение ЭЭГ. Поскольку ЭЭГ дает информацию о состоянии и функционировании мозга, ее целесообразно использовать для мониторинга в операционной при контроле за жизнеспособностью мозга в ходе современных кардиохирургических вмешательств, которые становятся все более обширными. Долгое время электроэнцефалографическое оборудование применяли для определения уровня анестезии. Использование анестезиологами простого оборудования для мониторинга функций сердца и мозга у больных в процессе хирургических операций не утратило своего значения и поныне.
Обычной практикой является в наши дни непрерывный мониторинг ЭЭГ в ходе каротидной эндартерэктомии — манипуляции, проводимой тщательно отобранным больным, страдающим стенозирующим или ульцеративным поражением сонной артерии. Характерные изменения при ЭЭГ (особенно значительное снижение вольтажа) указывают на необходимость временного анастомотического шунтирования для поддержания достаточного мозгового кровотока, чтобы устранить ишемическое повреждение мозга во время операции.
В нейрохирургических операционных ЭЭГ можно записывать с обнаженного мозга (электрокортикограмма), при этом осуществляется более точная локализация очага эпилептической активности, чем при регистрации со скальпа, благодаря чему становится возможной резекция функционально измененной ткани.
Рутинная ЭЭГ представляет диагностическую ценность при истерической слепоте. Аналогично этому реакция, вызванная шумом во время дневного сна, способна оказать помощь в подтверждении наличия слухового восприятия у пациента, симулирующего тотальную глухоту. Исследование этих реакций может быть полезным также для оценки слуха и зрения у новорожденных.
Вызванные потенциалы
Метод вызванных потенциалов (ВП) представляет собой способ записи электрической активности групп нейронов спинного мозга, ствола мозга, зрительного бугра и больших полушарий после стимуляции той или иной афферентной системы зрительными, слуховыми или тактильными воздействиями. Амплитуда этих потенциалов, записываемых со скальпа с помощью обычных электроэнцефалографических электродов, колеблется от 0,5 и менее до 20 мкВ. В связи с их исключительно малой величиной они редко могут быть зарегистрированы на электроэнцефалографе с чернильными писчиками на фоне основной электрической активности мозга, которая обычно достигает по амплитуде 50 мкВ и более. Поэтому для извлечения из основной кривой ЭЭГ необходимо особое оборудование, включая простые компьютеры, той вызванной волнообразной реакции, которая и интересует исследователя. Эта методика называется «усреднением», поскольку процедура включает в себя повторное 100—1000 точно дозированных по времени стимулов и запись электрической активности в определенном коротком интервале после каждого стимула. Последующая спонтанная активность на ЭЭГ в каждый данный момент времени после стимула может быть отрицательной, а в другие моменты — положительной по своей полярности, имеет тенденцию гаситься при достаточном числе повторений. С другой стороны, вызванная реакция имеет стабильные временные характеристики по отношению к стимулу и в конкретный момент после стимула всегда оказывается одинаковым по форме электрическим сигналом. В связи с этим ВП по мере повторений возрастает, тогда как амплитуда фоновой кривой снижается. Важно использовать особые усилители, с большой аккуратностью располагать электроды на поверхности скальпа, давать стимулы точно по времени и сводить к минимуму сопутствующие электрические артефакты. ВП расширяют возможности клинического неврологического исследования соответствующей афферентной системы, делают его более чувствительным и объективным, но не являются более специфичным методом этиологической диагностики.
Зрительные вызванные потенциалы. Зрительные вызванные потенциалы, получаемые посредством чередования паттерна (ЧПЗВП), имеют наиболее длительную историю клинического применения. В ходе исследования больным демонстрируют реверсивный черно-белый шахматный паттерн, спроецированный на экран. Во время рассматривания пациентом чередования паттерна у него формируется характерный волнообразный импульс, который может быть зарегистрирован со скальпа задней части головы. В норме эта трехфазная волна имеет отличительный положительный пик с латентным периодом 95—115 мс (обычно обозначаемый как Р100; рис. 341-5) от момента реверсии паттерна. Проводят измерение продолжительности этого латентного периода, длительности ответа и амплитуды пика. Латентный период — это самый важный в клиническом отношении параметр. Исследование проводят раздельно для каждого глаза. Чисто монокулярные изменения указывают на наличие дефекта проведения ниже хиазмы.
Многие формы поражений волокон зрительного нерва в его интраокулярном, орбитальном и интракраниальном отделах сопровождаются изменениями ЧПЗВП. Глаукома, компрессия зрительного нерва, хиазмы или тракта различными объемными образованиями, дегенеративные поражения зрительных путей часто вызывают снижение амплитуды и/или увеличение латентности ответа. При значительном поражении зрительной системы не удается зарегистрировать реакции на стимуляцию одного или двух глаз. В клинической практике самой распространенной причиной изменений ЧПЗВП служит неврит зрительного нерва, часто сопутствующий рассеянному склерозу. При демиелинизации волокон зрительного нерва как при первичном демиелинизирующем заболевании, так и при вышеперечисленных патологических процессах обнаруживают замедление проводимости по нервным волокнам и увеличение латентности положительного пика ЧПЗВП (до 115—200 мс). Действительно, почти у всех пациентов с невритом зрительного нерва даже после восстановления остроты зрения до нормы отмечают характерные изменения ЧПЗВП, тогда как при детальном офтальмологическом обследовании нарушений не выявляют. Если у больных с рассеянным склерозом ЧПЗВП находятся в пределах нормы, то при нейроофтальмологическом исследовании отклонений также не обнаруживают. При обследовании более 200 больных нами не установлено исключений из этого правила. Когда ЧПЗВП имеют патологический характер, у значительного числа пациентов не выявлено отклонений со стороны полей зрения, остроты зрения, зрачковых реакций и глазного дна.
Примерно у 50% больных с рассеянным склерозом, у которых зрительная функция никогда не была нарушена, также находят отклонения со стороны ЧПЗВП, что свидетельствует о высокой эффективности этого метода при данном заболевании. Если пациент обращается к врачу по поводу первого эпизода неврологического заболевания, при котором очаг поражения локализуется в стволе мозга или спинном мозге, то в случае обнаружения патологического характера ЧПЗВП или иного не проявляющегося клинически очага поражения в другом отделе ЦНС (зрительных нервах) более вероятным становится диагноз рассеянного склероза, что позволяет освободить больного от необходимости проведения ряда нейрорадиологических исследований.
Изменения остроты зрения не отражаются на ЧПЗВП до тех пор, пока зрение не ухудшается настолько, что больной не в состоянии различить шахматный паттерн; больные с остротой зрения 20/200 и выше могут проходить обследование. Единственным дополнительным требованием является достаточная способность больного к взаимодействию и спокойному пребыванию в положении сидя в течение 20 мин, когда он рассматривает паттерн. Новорожденные и дети также могут подвергаться данному обследованию, но при этом используют специальные методики.
Стволовые слуховые вызванные потенциалы. Стволовые слуховые вызванные потенциалы (ССВП) исследовать сложнее, чем ЧПЗВП, поскольку они гораздо ниже по амплитуде, в пределах 0,5 мкВ. Они вызываются звуковыми щелчками, стимулирующими одно ухо через наушник. Пациент может находиться как в бодрствующем, так и в коматозном состоянии. Необходимо отметить лишь, что избыточные движения и мышечные артефакты затрудняют получение ответа. При обследовании новорожденных и детей регистрируют практически нормальные по конфигурации ССВП. ССВП (стволовые слуховые вызванные потенциалы) представлены сериями из семи волн, которые появляются в течение первых 10 мс после щелчка (см. рис. 341-5). Эти волны (обозначаемые от I до VII) рассматриваются как результат последовательной активации слухового нерва (I) и проводящих слуховых путей ствола мозга (слуховое ядро, II; верхний оливарный комплекс, Ш; боковая петля, IV; нижние холмики, V; высшие слуховые центры, VI, VII). При поражении на определенном уровне или между какими-либо уровнями появление волн от последовательных вышележащих уровней «стирается» или задерживается. При рассеянном склерозе, например, происходит также торможение проведения между всеми уровнями. То же самое справедливо для других форм поражений ствола мозга, таких как поражения мелких сосудов, центральный понтинный миелинолиз, гипоксическое повреждение и т. д. Волны, исходящие из структур, расположенных каудальнее очага поражения, имеют совершенно нормальную латенцию, тогда как волны от структур, находящихся в краниальном направлении от очага, также стерты и запаздывают. Это позволяет очень точно установить уровень поражения на протяжении слуховых проводящих путей ствола мозга и обеспечивает возможность очень точного сопоставления клинических данных с нейрофизиологическими и иногда с патологоанатомическими. Это исследование показано больным с невриномами слухового нерва (у них всегда обнаруживают изменения), пациентам с подозрением на рассеянный склероз, больным, находящимся в коматозном состоянии, у которых не определена локализация поражения в ЦНС, а также другим, у которых важно подтвердить или установить поражение на уровне ствола мозга. Данный метод часто позволяет выявить снижение слуха, поскольку оно дает изменение латенции первой (и, следовательно, последующих) волн, что необходимо принимать во внимание при интерпретации полученных результатов. Межволновые латенции, которые служат параметрами, используемыми для измерения центральной проводимости, не подвержены изменениям за счет снижения слуха или интенсивности стимуляции. Метод полезен также для обследования новорожденных из группы высокого риска по дефектам слуха.
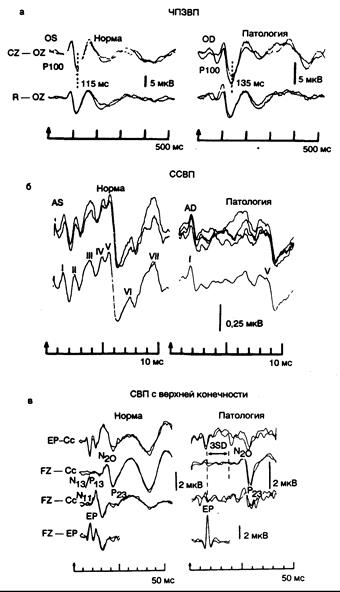
Рис. 341-5. Вызванные потенциалы (ВП). а—ЧПЗВП. Зрительные ВП при чередовании паттерна записаны у больного рассеянным склерозом, у которого обнаружено монокулярное нарушение латентности. Латенция затылочного ответа <Р100) на стимуляцию левого глаза (OS) оказалась нормальной—115 мс; ответ справа (OD) изменен, так как латентность пика Р100 увеличена до 135 мс. Относительная позитивность G2 вызывает наклон записи книзу. Локализация электродов: CZ — верхушечная точка, OZ — срединная затылочная линия, R — линия, соединяющая ушные раковины [источник: Brooks E. В., Chiappa К. Н., Clinical applications of evoked potentials. — Neirology. J. Courjoun et al. (eds), New York, Raven Press, 1982]; б—ССВП. Стволовые слуховые В П у больного рассеянным склерозом обнаруживают выраженную асимметрию при моноауральной щелчковой стимуляции. Ответы при стимуляции левого уха (AS) нормальные. В ответах с правого уха (AD) пропущена III волна (нижний отдел моста) и выявлено, что волны I и V (от улиткового нерва до среднего мозга) отстоят друг от друга на 6,7 мс, что подтверждает дефект проводимости в слуховых путях моста справа. Ответ левого уха при исследовании с наложением (показан выше) может быть вызван при N — 1024 щелчка, правого уха — при N ~ 2048 щелчков. Единичная нижележащая линия представляет собой итоговое усреднение наложенных исследований. Запись производилась от электродов, расположенных на верхушечной точке и мочке стимулированного уха; позитивность в верхушечной точке дает последующий наклон записи книзу (источник: Chiappa К. Н. et al., Ann. Neurol., 1980, 7:135); в — СВП с верхней конечности. Коротколатентные соматосенсорные ВП, полученные при стимуляции срединного нерва в области запястья. Ответы в левом столбце получены у нормального испытуемого, в правом — у больного с рассеянным склерозом, не имевшего расстройств чувствительности. У больного сохранен компонент плечевого сплетения (ЕР) и отсутствуют компоненты шейного отдела спинного мозга (N 11) и нижнего отдела продолговатого мозга (N13—Р13). Латентность таламокортикальных компонентов (N20—Р23) значительно выше нормальной средней плюс три стандартных отклонения, что отражает запаздывание N20) от потенциала плечевого сплетения. Унилатеральная стимуляция 5/с. Каждая запись представляет собой усредненный ответ на 1024 стимула с наложенной повторной записью после 1024 стимулов для демонстрации постоянства волнообразной реакции. Локализация записывающих электродов: FZ—срединная лобная, ЕР — точка Эрба (надключичная), С2—середина задней стороны шеи над позвонком СII, Сс—скальп над проекцией анализатора общей чувствительности теменной коры для контралатеральной стимулированной конечности.
Соматосенсорные вызванные потенциалы. Соматосенсорные вызван ные потенциалы (СВП) вызываются небольшими безболезненными электрическими стимулами, направленными на крупные чувствительные волокна смешанных нервов верхних и нижних конечностей. Афферентный импульс регистрируют на многих уровнях по мере его центростремительного прохождения; могут быть записаны серии волн, которые отражают активность в стволах периферических нервов, проводящих путях спинного мозга, ядрах тонкого и клиновидного пучков, структурах моста и/или мозжечка, а также зрительном бугре, таламокортикальных путях и первичных сенсорполях коры больших полушарий (см. рис. 341-5). Поражение этих проводников на любом уровне приводит к изменениям последующих волн, что позволяет установить или подтвердить локализацию патологического процесса аналогично тому, как это производится при исследовании ссвп.
Метод ВП может использоваться как для однократного обследования больного (поиск патологических изменений на различных уровнях), так и для контроля за развитием заболевания, подтверждения функционального улучшения или ухудшения с течением времени, на фоне лечения и т. д. Метод ВП эффективен также при текущем мониторинге функций зрительного нерва, ствола мозга или спинного мозга во время нейрохирургических вмешательств, в ходе которых производятся манипуляции на данных структурах. Поскольку ССВП и СВП не подвержены воздействию общей анестезии и высоких доз барбитуратов, их исследование целесообразно также для контроля функций ЦНС у больных в коматозном состоянии. В течение ряда лет проводилось исследование ССВП и СВП с удлиненными латенциями. Такие реакции обусловлены главным образом влиянием коры. Сильное воздействие на них оказывают сонливость, рассеянность и другие состояния, слабо поддающиеся контролю, в связи с чем клиническая эффективность их незначительна. Последнее относится и к большинству зрительных вызванных потенциалов, полученных с помощью стробоскопических световых вспышек. Они очень информативны при обследовании зрительных путей у грудных детей и детей младшего возраста, которые неспособны к достаточному взаимодействию, чтобы смотреть на реверсивный шахматный паттерн, и у взрослых во время хирургических операций или находящихся в коме. Однако в остальных ситуациях исследование ЧПЗВП позволяет получать значительно более надежную и воспроизводимую реакцию.
Психометрия, периметрия, аудиометрия и исследование лабиринтных функций
Эти методы используют для количественной оценки и определения природы психического или сенсорного дефицита, вызванного заболеванием нервной системы. Выполнение этих тестов показано, если 1) необходимо получить подтверждения функционального характера, наличия в определенных отделах нервной системы каких-либо нарушений и выяснить их природу и 2) количественно оценить степень поражения с целью определения характера течения заболевания при исследованиях в динамике (см. гл. 23).
Биохимические анализы
Достижения в изучении биохимии болезней обмена веществ сделали доступными различные высокоспецифичные методы исследования сыворотки крови, СМЖ, циркулирующих эритроцитов и лейкоцитов. Соответствующие тесты будут охарактеризованы при описании болезней обмена веществ, при которых они обладают диагностической ценностью.
Дата добавления: 2016-03-05; просмотров: 992;
