ГЛАВА 42. АЦИДОЗ И АЛКАЛОЗ
Норман Г.Левински (Norman G. Levinsky)
Физиологические аспекты. В организме в норме в процессе метаболизма постоянно образуются кислоты. Несмотря на ежедневное образование в тканевых жидкостях около 20000 ммолей угольной и 80 ммолей сильных кислот, концентрация свободных ионов водорода находится в узком диапазоне. В норме рН внеклеточной жидкости составляет 7,35—7,45 (45—35 нмоль/л). Определить точно рН во внутриклеточных жидкостях невозможно. По данным, полученным с помощью большинства существующих методов, эта величина в среднем составляет 6,9. Концентрация ионов водорода внутри клетки неоднородна. Она различна в органеллах одной клетки. Даже при небольшой концентрации водородные ионы (протоны) в жидких средах до такой степени реактивноспособны, что кратковременное изменение их концентрации влияет на работоспособность ферментов и физиологические процессы. Мгновенная защита от неблагоприятных колебаний рН обеспечивается буферной системой, которая может связать или, наоборот, освободить протоны сразу же в ответ на изменение кислотности жидкой среды, В конечном счете на уровне организма регуляция рН зависит от функции легких и почек.
Основным эквивалентным продуктом обмена потенциальной угольной кислоты служит двуокись углерода. С помощью легких ее концентрация в жидких средах организма удерживается на уровне 1,2 ммоль/л (Рсо2 = 40 мм рт. ст.). При этой концентрации выведение двуокиси углерода равно ее метаболической продукции. Несмотря на то что двуокись углерода во время перехода из клеток в легочные альвеолы реагирует с водой и тканевыми буферными системами, истинного изменения состава жидких сред не происходит, поскольку двуокись углерода выводится через легкие в количестве, равном ее образованию в клетках. При образовании в процессе метаболизма сильных кислот их протоны сразу же реагируют с буферными веществами и исчезают из жидких сред организма. Во внеклеточной жидкости гидрокарбонат превращается в двуокись углерода и воду, экскретирующиеся через легкие. Несмотря на то что этот механизм сводит к минимуму колебания кислотности среды, он связан с разрушением гидрокарбоната и уменьшением буферной емкости клетки (общая буферная емкость жидких сред организма составляет примерно 15 мэкв/кг). Следовательно, если бы не способность почек удалять протоны, секретируя их в мочу и тем самым восстанавливая буферную емкость клеток, то нормальной скорости продукции сильных кислот оказалось бы достаточно для полного истощения буферной системы организма в течение 10—20 дней.
Основным источником появления сильной (серной) кислоты служит метаболизм метионина и цистина, входящих в состав белков пищи. К другим источникам относят неполное окисление углеводов и жиров до органических кислот, обменные превращения нуклеопротеинов с образованием мочевой кислоты, метаболизм фосфорорганических веществ, в процессе которого высвобождаются протоны и неорганические фосфаты. В рационе питания количество готовых кислот или щелочей обычно невелико, но может содержаться достаточное количество потенциальных кислот (например, избыток катионных кислот, таких как лизин) или щелочей (например, цитрат).
Основные функции почек в кислотно-основном метаболизме заключаются в накоплении уже существующего гидрокарбоната и генерации новых количеств для восполнения затрат, обусловленных противодействием сильным кислотам. Гидрокарбонат реабсорбируется как в проксимальном, так и дистальном сегментах нефронов посредством секреции протонов в канальцевую жидкость. Дополнительное его количество образуется в результате секреции протонов для буферной системы мочи. В норме /з ионов водорода связывается с фосфатом, превращая НРО42– в Н2РО4–. остальная часть переходит в аммиак, образуя ионы аммония. Количество свободной кислоты, которое может быть экскретировано с мочой, невелико даже при минимальном значении рН (4,8). Однако закисление мочи существенно для связывания кислоты фосфатом и аммонием. Изменения рН жидких сред организма вызывает ответную регуляторную реакцию со стороны почек. Ацидоз активирует почечную секрецию ионов водорода. Увеличивается продукция аммиака, в связи с чем большее число протонов может экскретироваться почками в виде аммония. При крайней степени ацидоза продукция аммиака, в норме составляющая 40—50 мэкв/сут, усиливается в 10 раз и более. В действительности концентрация гидрокарбоната во внеклеточной жидкости определяется скоростью секреции протонов в почках (реабсорбция и генерация гидрокарбоната). Если его концентрация в плазме увеличивается без усиления реабсорбирующей способности почки, то этот анион быстро экскретируется и его нормальная концентрация в плазме быстро нормализуется. Например, длительное потребление гидрокарбоната натрия даже в большом количестве обычно приводит лишь к минимальному стойкому увеличению его концентрации в плазме. На скорость секреции протонов в почках влияют многие причины, среди которых важны напряжение двуокиси углерода в жидких средах организма, величина внеклеточного объема, концентрация альдостерона, запасы калия в тканях. Реабсорбция гидрокарбоната прямо связана с концентрацией двуокиси углерода. Так, при гиперкапнии отмечается тенденция к активированию, а при гипокапнии, наоборот, к торможению процессов накопления гидрокарбоната в результате работы почек. Сокращение объема внеклеточной жидкости усиливает его реабсорбцию в почечных канальцах, а увеличение объема сопровождается противоположным эффектом. Альдостерон стимулирует почечную секрецию протонов. В этом смысле гиперальдостеронизм вызывает метаболический алкалоз, тогда как гипоальдостеронизм — ацидоз. В экспериментах на животных было показано, что реабсорбция гидрокарбоната в почках находится в обратной зависимости от запасов калия в организме. У человека эта зависимость менее четкая, однако выраженный дефицит калия в тканях связан с усиленной реабсорбцией гидрокарбоната и метаболическим алкалозом.
Респираторная система реагирует на изменения рН крови почти мгновенно. Ацидоз стимулирует, а алкалоз угнетает легочную вентиляцию. Дыхательный центр, локализованный в продолговатом мозге, вероятно, реагирует на среднюю величину рН в крови и спинномозговой жидкости.
Определение кислотно-основного равновесия. На практике нарушения кислотно-основного равновесия классифицируют на основании их измерений в системе гидрокарбонат—угольная кислота (основная буферная система внеклеточной жидкости). Поскольку внутри- и внеклеточная буферные системы функционально связаны между собой, измерение только концентрации гидрокарбоната в плазме позволяет получить информацию об общей буферной системе организма. Взаимосвязь отдельных элементов гидрокарбонатной системы обычно описывают уравнением Гендерсона—Гассельбаха:
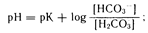
где рК угольной кислоты составляет 6,1. Величина [Н2СОз] рассчитывается как произведение a•Рсo2, где a—коэффициент растворимости двуокиси углерода в жидких средах организма, равный 0,031 ммоль/л на 1 мм рт. ст. парциального давления двуокиси углерода. При нормальном Рсо2 (т. е. 40 мм рт. ст.) расчетная величина [Н2СО3] будет составлять 40•0,031=1,2 ммоль/л.
Ацидозом называют нарушение, при котором в жидких средах организма проявляется тенденция к накоплению кислоты или удалению щелочи. Алкалоз—любое нарушение, связанное с-тенденцией к уменьшению содержания в жидких средах организма или накоплению в них оснований. Поскольку компенсаторные механизмы могут свести до минимума или совсем предотвратить изменение концентрации водородных ионов в плазме, некоторые авторы предпочитают использовать термины «ацидемия» и «алкалемия» для описания состояний, при которых изменения рН плазмы незначительны. К дыхательным относят нарушения, при которых основной сдвиг касается концентрации двуокиси углерода (угольная кислота). Как можно видеть из уравнения Гендерсона—Гассельбаха, уменьшение ее концентрации вызывает алкалемию, а повышение — ацидемию. К метаболическим нарушениям относят состояния, при которых основные изменения происходят в концентрации гидрокарбоната. В связи с тем что в уравнении Гендерсона—Гассельбаха концентрация гидрокарбоната в буферном отношении соль/кислота вынесена в числитель, то увеличение концентрации гидрокарбоната приведет к алкалемии, а уменьшение — к ацидемии.
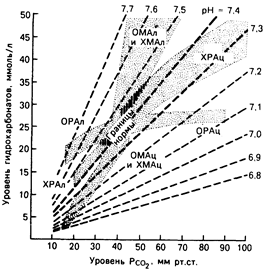
Рис. 42.1. Номограмма у здорового человека при неосложненном дыхательном или метаболическом нарушении кислотно-основного равновесия. Доверительные интервалы значений составляют ±2SD при компенсаторной реакции на первичное нарушение v здорового или больного. ОМАц и омал — соответственно острый метаболический ацидоз и алкалоз, ХМАц и ХМАл – соответственно хронический метаболический ацидоз и алкалоз, ОРАц и ОРАл — соответственно острый респираторный ацидоз и алкалоз, ХРАц и ХРАл — соответственно хронический респираторный ацидоз и алкалоз. лоз.
Основную проблему в оценке нарушений кислотно-основного равновесия представляют компенсаторные реакции со стороны легких и почек. Первоначальное изменение концентрации двуокиси углерода вызывает компенсаторную реакцию почек, в результате которой в том же направлении изменяется концентрация гидрокарбоната плазмы. И, наоборот, первичное изменение концентрации гидрокарбоната в плазме вызывает компенсаторное изменение концентрации угольной кислоты. Например, у больного с хронической дыхательной недостаточностью показатели кислотно-основного равновесия следующие: рсо2 = 70 мм рт. ст., [НСО3–]=31 ммоль/л; рН = 7,25. Клиницисту следует знать, обусловлено ли увеличение концентрации гидрокарбоната в плазме только реакцией почек на первичную гиперкапнию или же на этот процесс влияют метаболические нарушения кислотно-основного равновесия. Никакие расчеты и предположения не позволяют получить ответ на этот ключевой вопрос. Подобную информацию можно получить только при непосредственном наблюдении за больным, в процессе которого определяют обычную компенсаторную реакцию организма на определенную степень хронической гиперкапнии.
Клинические и экспериментальные наблюдения были проведены при всех наиболее известных основных нарушениях кислотно-основного равновесия. Полученные результаты обобщены и с помощью статистического метода доверительных интервалов представлены в виде графического материала, предназначенного для клинического анализа нарушений кислотно-основного равновесия (рис. 42-1). Каждый доверительный интервал представляет собой среднюю величину ±2SD, т. е. в него входят 95% результатов наблюдений за компенсаторной реакцией на каждый основной тип нарушения. Вернемся к примеру с больным. Анализ доверительного интервала, обозначенного на рис. 42-1 как «хронический дыхательный ацидоз», свидетельствует о том, что у 95% лиц с хроническим повышением Рсо2 до 70 мм рт. ст. концентрация ионов гидрокарбоната в плазме составит 34—44 ммоль/л в связи с почечной компенсацией. Следовательно, величину [НСО3–], равную в нашем примере 31 ммоль/л, нельзя рассматривать только как результат компенсаторной реакции почек на хроническую гиперкапнию. На нее, по всей видимости, должно влиять еще одно нарушение кислотно-основного равновесия, предположительно, метаболический ацидоз. Конечно, использование этого графика не решает все вопросы и не исключает необходимости проведения в качестве альтернативы обычного клинического обследования больного. Например, если у него гиперкапния развилась недавно, величина [НСО3–], равная 31 ммоль/л, оказалась бы слишком большой для чисто компенсаторной реакции на острый респираторный ацидоз и ее можно было бы объяснить наложением эффекта метаболического алкалоза. Различие между двумя крайними интерпретациями одной и той же величины [НСО3–] целиком зависит от клинической диагностики длительности основного респираторного заболевания. О том, как пользоваться рис. 42-1 в каждом конкретном случае нарушения кислотно-основного равновесия, сообщается в соответствующих разделах главы .
Дата добавления: 2016-03-05; просмотров: 1264;
