Механизмы специфической регуляции каталитической активности ферментов.
К основным способам регуляции каталитической активности молекул ферментов относят:
1). Аллостерическую регуляцию;
2). Регуляцию с помощью белок-белковых взаимодействий;
3). Регуляцию путем фосфорилирования/дефосфорилирования молекулы фермента;
4). Регуляцию частичным протеолизом.
Два последних способа относится к ковалентной модификация фермента. Регуляция происходит в результате или ковалентного присоединения фрагмента к ферменту или отщепления фрагмента от фермента.
1). Аллостерическая регуляция.
Аллостерическими ферментами называют ферменты, активность которых регулируется обратимым нековалентным присоединением модулятора (активатора и ингибитора) к специальному аллостерическому центру. Аллостерические ферменты являются олигомерными белками или имеют доменное строение. Эти ферменты играют важную роль в регуляции т.к. чрезвычайно быстро реагируют на изменения среды. Ингибиторами аллостерических ферментов часто являются конечные продукты метаболических путей, активаторами – их начальные субстраты. Активирование происходит по принципу прямой положительной связи, а ингибирование - по принципу отрицательной обратной связи.
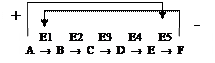
Например, конечный продукт катаболизма глюкозы АТФ ингибирует аллостерически ферменты гликолиза фосфофруктокиназу и пируваткиназу. Накапливаемая в гликолизе фруктоза-1,6-ф активирует пируваткиназу, что ускоряет реакции гликолиза.
2). Регуляция каталитической активности ферментов с помощью белок-белковых взаимодействий. Выделяют 2 механизма:
а). Активация ферментов в результате присоединения регуляторных белков. Например, аденилатциклаза (Ац), которая катализирует превращение цАМФ из АТФ, активируется присоединением α-субъединицы G-белка. Этот механизм регуляции обратим.
б). Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров. Например, протеинкиназа А, активируется при диссоциации ее тетрамера на 4 субъединицы и инактивируется при обратном соединении 4 субъединиц в тетрамер.
3). Регуляция каталитической активности ферментов путем их фосфорилирования/дефосфорилирования. Фосфорилирование осуществляется протеинкиназами, а дефосфорилирование – фосфопротеинфосфатазами. Введение отрицательно заряженной фосфорной группы приводит к обратимому изменению конформации и активности фермента.
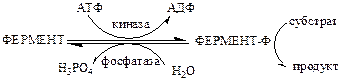
Например, под действием глюкагона в клетках происходит уменьшение синтеза жира, гликогена и усиление его распада, вызванного фосфорилированием ключевых ферментов этих процессов. А под действием инсулина, наоборот, активируется синтез гликогена и ингибируется его распад, так как инсулин вызывает дефосфорилирование тех же ключевых ферментов.
4). Регуляция каталитической активности ферментов путем частичного протеолиза. При участии активаторов и протеолитических ферментов происходит отщепление части молекулы фермента и его необратимая активация. Эти ферменты функционируют мало, а затем разрушаются. Характерно для внеклеточных ферментов ЖКТ (пепсин, трипсин, химотрипсин и др.) и ферментов свертывания крови (тромбин, фибрин, плазмин др.). Например, трипсиноген, синтезируемый в поджелудочной железе, поступает в двенадцатиперстную кишку, где энтеропептидаза кишечника отщепляет у него с N-конца гексапептид. В результате в оставшейся части молекулы фермента формируется активный центр.

III. Механизмы регуляции количества ферментов: индукция, репрессия, дерепрессия.
Количество фермента в клетке зависит от скорости его синтеза и распада, процессов необходимых для обновления фермента. Синтез и распад ферментов регулируется независимо. Наиболее изучен механизм регуляции синтеза ферментов на уровне транскрипции, который осуществляется определенными метаболитами, гормонами и рядом биологически активных веществ.
Индукция – запуск синтеза ферментов под действием специфических низкомолекулярных соединений – индукторов. Например, у бактерий ферменты синтезируются только при наличии для них субстратов, которые являются для этих ферментов индукторами (у E. coli лактоза индуктор β-галактозидазы).
Индуцируемые ферменты – ферменты, концентрация, которых зависит от добавления индукторов (органоспецифические ферменты).
Конститутивные ферменты – ферменты, концентрация которых постоянна и не регулируется индукторами (ферменты гликолиза, синтеза РНК и т.д.).
Базовый уровень – концентрация фермента при отсутствии индуктора. При индукции базовый уровень фермента может быть превышен от 2 до 1000 раз.
Репрессия – остановка синтеза фермента под действием репрессора (точнее корепрессора).
Дерепрессия – возобновление синтеза ферментов или после удаления из среды репрессора или при истощении его запасов.
Часто один индуктор или репрессор регулируют синтез сразу нескольких ферментов участвующих в одном метаболическом пути. Гены этих ферментов собраны в оперон.
Оперон – участок молекулы ДНК, который содержит информацию о группе функционально взаимосвязанных структурных генов и регуляторную зону, промотор, контролирующую транскрипцию этих генов. Индукция и репрессия синтеза ферментов оперона называется координированной.
Координированная индукция – все ферменты, кодируемые генами оперона, индуцируются одним индуктором.
Координированная репрессия – остановка синтеза ферментов оперона одним репрессором.
В промоторе оперона имеется участок оператор, необходимый для присоединения репрессора. Репрессор синтезируется с гена-регулятора.
1). Индукцияоперона. Репрессор присоединяется к оператору и препятствует присоединению к промотору РНК-полимеразы – транскрипции мРНК нет. Индуктор, присоединяясь к репрессору, вызывает отделение последнего от оператора, РНК-полимераза присоединяется к промотору и начинается транскрипция мРНК с оперона. С этой мРНК синтезируются сразу несколько ферментов.
рисунок
2). Репрессия оперона. Репрессор не присоединяется к оператору самостоятельно. Присоединение к оператору репрессора происходит только в комплексе с корепрессором. Комплекс репрессор-корепрессор присоединяясь к оператору, препятствует присоединению РНК-полимеразы к промотору, что блокирует транскрипцию мРНК с оперона и синтез ферментов.
рисунок
Катаболическая репрессия – более выгодный субстрат окисления ингибирует ферменты окисления менее выгодного субстрата.
Распад ферментов идет под действием гидролитических ферментов, регуляция этого процесса мало изучена.
Дата добавления: 2016-02-13; просмотров: 952;
