Изотермы Ван-дер-Ваальса
Для фиксированных значений Р и Т уравнение (2) есть уравнение третьей степени относительно объема газа V и, следовательно, оно может иметь либо три вещественных корня (V1, V2, V3), либо один вещественных корень (V1) и два комплексно-сопряженных корня (комплексно-сопряженные корни отбрасываем). Поэтому на диаграмме PV (см.рис.2) прямая, параллельная оси V может пересекать изотерму ВдВ либо в трех точках В, D, F, либо в одной K или L. Построение по точкам изотерм ВдВ для трех характерных температур приводит к кривым, изображенным на рис.2. Сначала проведем анализ нижней изотермы ABCDEFG.
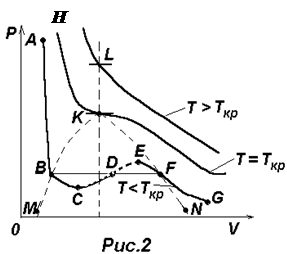 Левая, круто спадающая часть ее АВ соответствует жидкому состоянию, правая пологая часть FG – газообразному. Переход из жидкого состояния в газообразное и обратно при обычных условиях происходит не вдоль участка ВСDEF, а вдоль изобары BF, которая одновременно является и реальной изотермой. Такой изобаре-изотерме BF соответствуют двухфазные состояния вещества – жидкость + газ (пар). Чем ближе к точке В, тем больше жидкости, и чем ближе к точке F–тем больше в системе пара (газа). Заметим, что пар и газ – это одно и то же. Когда говорят о паре какой-либо жидкости, то этим желают подчеркнуть, что речь идет о газе, полученном испарением этой жидкости.
Левая, круто спадающая часть ее АВ соответствует жидкому состоянию, правая пологая часть FG – газообразному. Переход из жидкого состояния в газообразное и обратно при обычных условиях происходит не вдоль участка ВСDEF, а вдоль изобары BF, которая одновременно является и реальной изотермой. Такой изобаре-изотерме BF соответствуют двухфазные состояния вещества – жидкость + газ (пар). Чем ближе к точке В, тем больше жидкости, и чем ближе к точке F–тем больше в системе пара (газа). Заметим, что пар и газ – это одно и то же. Когда говорят о паре какой-либо жидкости, то этим желают подчеркнуть, что речь идет о газе, полученном испарением этой жидкости.
Ветви ВС и EF изображают метастабильные состояния вещества (т.е. относительно устойчивые состояния): перегретую жидкость и пересыщенный пар и могут быть осуществлены при определенных условиях. Участок СДЕ ни при каких условиях осуществлен быть не может.
 С ростом температуры область горбов и впадин на изотерме ВдВ уменьшается и при температуре ТКР – критической температуре – превращается в точку перегиба К с горизонтальной касательной. В точке К исчезают различия между жидкой и газообразной фазой (однородная среда).
С ростом температуры область горбов и впадин на изотерме ВдВ уменьшается и при температуре ТКР – критической температуре – превращается в точку перегиба К с горизонтальной касательной. В точке К исчезают различия между жидкой и газообразной фазой (однородная среда).
При Т>ТКР газ никаким сжатием нельзя перевести в жидкость.
Возвращаясь к анализу изотерм ВдВ, изображенных на рис.2, делаем заключение, что область, ограниченная сверху изотермой НК и справа линией КВМсоответствует жидкой фазе. Область, ограниченная сверху кривой МВКFN, соответствует жидкой и газообразной фазе (жидкость + пар) и область, расположенная правее линии НКFN, соответствует газообразной фазе.
При Т>>ТКР и относительно малых давлениях реальные газы ведут себя как идеальные газы.
Внутренняя энергия моля реального газа
U=CVТ –a/V, (4)
т.е. меньше энергии идеального газа U=CVТ. Для произвольной массы реального газа
U=n(CVТ –a/V). (5)
Дата добавления: 2016-03-04; просмотров: 1070;
