Биохимия соединительной ткани
| Краткое содержание | Конспект |
| 1. Организация и функции межклеточного матрикса. Общие сведения о структуре коллагеновых белков. Фибриллообразующие коллагены. Коллагены, ассоциированные с фибриллами. Нефибриллярные (сетевидные) типы коллагена. Коллагены, образующие микрофибриллы | |
Межклеточный матрикс вместе с клетками разного типа, которые в нём находятся (фибриллы, хондро- и остеобласты, тучные клетки и макрофаги), часто называют соединительной тканью.
Строение соединительной ткани:
 Функции межклеточного матрикса:
- образует каркас органов;
- является универсальным «биологическим» клеем;
- участвует в регуляции водно-солевого обмена;
- образует высокоспециализированные структуры (кости, зубы, хрящи, сухожилия, базальные мембраны).
Основные компоненты межклеточного матрикса – структурные белки коллаген и эластин, гликозамингликаны, протеогликаны, а также неколлагеновые структурные белки (фибронектин, ламинин, тенасцин, остеонектин и др.).
Коллаген
Характерным компонентом структуры соединительной ткани являются коллагеновые волокна. Они построены в основном из своеобразного белка – коллагена. Коллаген составляет 25–33% от общего количества белка организма взрослого человека, или 6% от массы тела. Коллаген – полиморфный белок (известно 19 типов коллагена). Тропоколлаген – основная структурная единица коллагена. Молекулярная масса тропоколлагена около 285000.
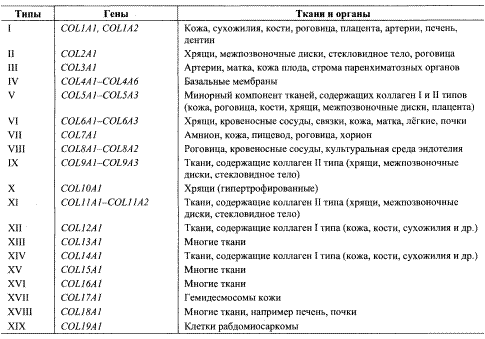
Классификация коллагенов по видам структур, которые они образуют:
Функции межклеточного матрикса:
- образует каркас органов;
- является универсальным «биологическим» клеем;
- участвует в регуляции водно-солевого обмена;
- образует высокоспециализированные структуры (кости, зубы, хрящи, сухожилия, базальные мембраны).
Основные компоненты межклеточного матрикса – структурные белки коллаген и эластин, гликозамингликаны, протеогликаны, а также неколлагеновые структурные белки (фибронектин, ламинин, тенасцин, остеонектин и др.).
Коллаген
Характерным компонентом структуры соединительной ткани являются коллагеновые волокна. Они построены в основном из своеобразного белка – коллагена. Коллаген составляет 25–33% от общего количества белка организма взрослого человека, или 6% от массы тела. Коллаген – полиморфный белок (известно 19 типов коллагена). Тропоколлаген – основная структурная единица коллагена. Молекулярная масса тропоколлагена около 285000.
Классификация коллагенов по видам структур, которые они образуют:
 95 % всего коллагена в организме человека составляют коллагены I, II и III типов, которые образуют очень прочные фибриллы. Эти типы коллагенов называют интерстициальными, поскольку являются основными структурными компонентами органов и тканей, которые испытывают постоянную или периодическую механическую нагрузку (кости, сухожилия, хрящи, межпозвоночные диски, кровеносные сосуды).
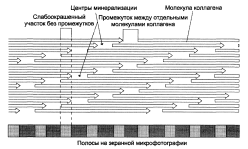
Схема ступенчатого расположения молекул коллагена в коллагеновой фибрилле:
95 % всего коллагена в организме человека составляют коллагены I, II и III типов, которые образуют очень прочные фибриллы. Эти типы коллагенов называют интерстициальными, поскольку являются основными структурными компонентами органов и тканей, которые испытывают постоянную или периодическую механическую нагрузку (кости, сухожилия, хрящи, межпозвоночные диски, кровеносные сосуды).
Схема ступенчатого расположения молекул коллагена в коллагеновой фибрилле:
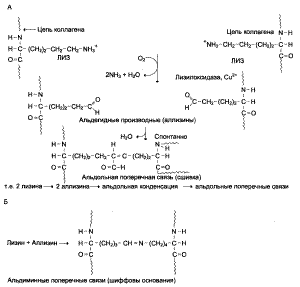
 Образование поперечных связей в коллагене:
Образование поперечных связей в коллагене:
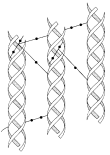
 Внутри- и межмолекулярные поперечные связи в коллагене:
Внутри- и межмолекулярные поперечные связи в коллагене:
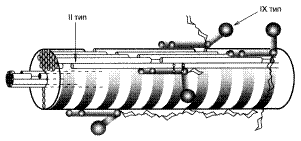
 Коллагены, ассоциированные с фибриллами(структура коллагеновых фибрилл II типа и ассоциированного с ним коллагена IX типа):
Коллагены, ассоциированные с фибриллами(структура коллагеновых фибрилл II типа и ассоциированного с ним коллагена IX типа):
 Образование коллагена IV типа:
Образование коллагена IV типа:
 Образование коллагена VI типа:
Образование коллагена VI типа:
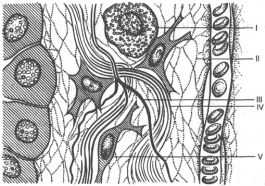
|
I - тучная клетка; II - ретикулиновые волокна;
III - эластическое волокно;
IV – коллагеновые волокна;
V - фибробласт.
Распределение коллагена в тканях и органах
 А – образование альдольной поперечной сшивки из двух боковых цепей лизина;
Б – образование шиффовых оснований из боковых цепей лизина и аллилизина.
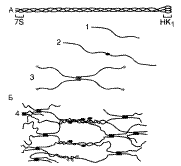
А –тройная спираль мономера коллагена : 7S – N-конец; НК1 – С-конец.
Б – полимеризация коллагена IV типа: 1 – мономер; 2 – димеры, образованные соединением мономеров в области НК1-доменов; 3 – тетрамеры, образованные соединением мономеров в области 7S-сегментов в параллельном и антипараллельном направлениях; 4 – образование сетчатой структуры из олигомерных форм коллагена IV типа.
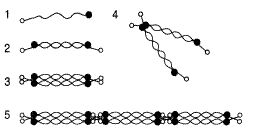
1 – мономер; 2 – димер; 3 – тетрамер, соединённый полностью; 4 – тетрамер, соединённый частично; 5 – микрофибриллы, соединённые «конец в конец».
А – образование альдольной поперечной сшивки из двух боковых цепей лизина;
Б – образование шиффовых оснований из боковых цепей лизина и аллилизина.
А –тройная спираль мономера коллагена : 7S – N-конец; НК1 – С-конец.
Б – полимеризация коллагена IV типа: 1 – мономер; 2 – димеры, образованные соединением мономеров в области НК1-доменов; 3 – тетрамеры, образованные соединением мономеров в области 7S-сегментов в параллельном и антипараллельном направлениях; 4 – образование сетчатой структуры из олигомерных форм коллагена IV типа.
1 – мономер; 2 – димер; 3 – тетрамер, соединённый полностью; 4 – тетрамер, соединённый частично; 5 – микрофибриллы, соединённые «конец в конец».
|
| 2. Синтез коллагена. Этапы внутриклеточного синтеза: транскрипция, трансляция, посттрансляционная модификация, роль аскорбиновой кислоты. Нарушения синтеза коллагеновых белков у человека | |
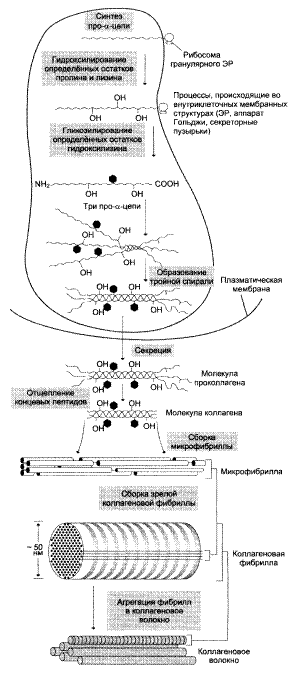
Синтез коллагена:
- гидроксилирование пролина и лизина с образованием гидроксипролина (Hyp) и гидроксилизина (Hyl);
- гликозилирование гидроксилизина;
- частичный протеолиз – отщепление «сигнального» пептида, а также N- и С-концевых пропептидов;
- образование тройной спирали.
Синтез полипептидных цепей коллагена происходит на полирибосомах, связанных с мембранами ЭПР в виде белков-предшественников.
Посттрансляционная модификация коллагена заключается в гидроксилировании пролина и лизинас помощью оксигеназ:
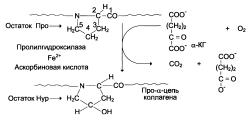 Необходимыми компонентами этой реакции являются α-кетоглутарат, О2 и витамин С (сохраняет атома железа, расположенный в активном центре ферментов гидроксилаз, в ферроформе).
Гликозилирование гидроксилизина происходит при участии гликозилтрансфераз с образованием 0-гликозидной связи.
Необходимыми компонентами этой реакции являются α-кетоглутарат, О2 и витамин С (сохраняет атома железа, расположенный в активном центре ферментов гидроксилаз, в ферроформе).
Гликозилирование гидроксилизина происходит при участии гликозилтрансфераз с образованием 0-гликозидной связи.
 После гидроксилирования и гликозилирования происходит образование проколлагенаи его секреция в межклеточное пространство.
Образование тропоколлагена происходит в межклеточном матриксе с помощью тропоколлагенпептидаз.
Катаболизм коллагена
Коллаген – медленно обменивающийся белок (Т1/2 составляет недели или месяцы).
Разрушение коллагеновых волокон осуществляется активными формами кислорода и/или ферментативно (гидролитически).
Основной фермент катаболизма коллагена – коллагеназа (2 типа):
1) тканевая коллагеназа (синтезируется фибробластами и макрофагами, содержит цинк, известны 4 изоформы этого фермента);
2) бактериальная коллагеназа (синтезируется некоторыми микроорганизмами – Clostridium histolyticum – возбудитель газовой гангрены).
Коллагеназа используется в медицинской практике для лечения ожоговой болезни в хирургии и для лечения гнойных заболеваний глаз в офтальмологии.
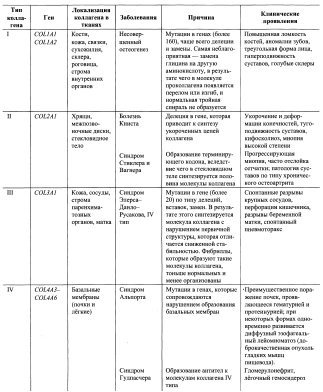
Заболевания, связанные с нарушением синтеза и созревания коллагена
Среди многих поражений соединительной ткани особое место занимают коллагенозы. Для них характерно повреждение всех структурных составных частей соединительной ткани: волокон, клеток и межклеточного основного вещества. К коллагенозам обычно относят ревматизм, ревматоидный артрит, системную красную волчанку, системную склеродермию, дерматомиозит и узелковый периартериит. Каждое из этих заболеваний имеет своеобразное течение и сугубо индивидуальные проявления. Среди многочисленных теорий развития коллагенозов наибольшее признание получила теория инфекционно-аллергического происхождения.
Наконец, необходимо отметить, что нарушение процесса гидроксилирования коллагена – один из биохимических дефектов при цинге. Коллаген, синтезированный в отсутствие или при дефиците аскорбиновой кислоты, оказывается недогидроксилированным и, следовательно, имеет пониженную температуру плавления. Такой коллаген не может образовать нормальные по структуре волокна, что и приводит к поражению кожи и ломкости сосудов, столь четко выраженных при цинге.
Заболевания, связанные с нарушением синтеза и созревания коллагена:
После гидроксилирования и гликозилирования происходит образование проколлагенаи его секреция в межклеточное пространство.
Образование тропоколлагена происходит в межклеточном матриксе с помощью тропоколлагенпептидаз.
Катаболизм коллагена
Коллаген – медленно обменивающийся белок (Т1/2 составляет недели или месяцы).
Разрушение коллагеновых волокон осуществляется активными формами кислорода и/или ферментативно (гидролитически).
Основной фермент катаболизма коллагена – коллагеназа (2 типа):
1) тканевая коллагеназа (синтезируется фибробластами и макрофагами, содержит цинк, известны 4 изоформы этого фермента);
2) бактериальная коллагеназа (синтезируется некоторыми микроорганизмами – Clostridium histolyticum – возбудитель газовой гангрены).
Коллагеназа используется в медицинской практике для лечения ожоговой болезни в хирургии и для лечения гнойных заболеваний глаз в офтальмологии.
Заболевания, связанные с нарушением синтеза и созревания коллагена
Среди многих поражений соединительной ткани особое место занимают коллагенозы. Для них характерно повреждение всех структурных составных частей соединительной ткани: волокон, клеток и межклеточного основного вещества. К коллагенозам обычно относят ревматизм, ревматоидный артрит, системную красную волчанку, системную склеродермию, дерматомиозит и узелковый периартериит. Каждое из этих заболеваний имеет своеобразное течение и сугубо индивидуальные проявления. Среди многочисленных теорий развития коллагенозов наибольшее признание получила теория инфекционно-аллергического происхождения.
Наконец, необходимо отметить, что нарушение процесса гидроксилирования коллагена – один из биохимических дефектов при цинге. Коллаген, синтезированный в отсутствие или при дефиците аскорбиновой кислоты, оказывается недогидроксилированным и, следовательно, имеет пониженную температуру плавления. Такой коллаген не может образовать нормальные по структуре волокна, что и приводит к поражению кожи и ломкости сосудов, столь четко выраженных при цинге.
Заболевания, связанные с нарушением синтеза и созревания коллагена:

| Синтез и созревание коллагена
|
| 3. Эластин. Изменения в структуре эластина при патологических процессах | |
Эластин –основной белок эластических волокон (кожа, стенки кровеносных сосудов, связки, лёгкие).
В межклеточном пространстве молекулы эластина образуют волокна и слои, в которых отдельные пептидные цепи связаны жёсткими поперечными сшивками. Такие структуры называются десмозинами.
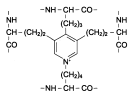 Десмозин (образован четырьмя остатками лизина)
Молекулы эластина связаны ковалентными сшивками в обширную сеть: Десмозин (образован четырьмя остатками лизина)
Молекулы эластина связаны ковалентными сшивками в обширную сеть:
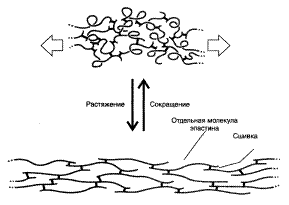
| Причины нарушений структуры эластина: 1) снижение активности лизилоксидазы, вызванное дефицитом меди или пиридоксина; 2) дефицит лизилоксидазы при наследственных заболеваниях; 3) синдром Менкеса – нарушение всасывания меди. При снижении образования десмозинов у эластических тканей снижается предел прочности на разрыв и появляются нарушения: истончённость; вялость; растяжимость; утрачиваются резиноподобные свойства. Следствия: аневризмы и разрывы аорты, дефекты клапанов сердца, частые пневмонии, эмфизема лёгких. Катаболизм эластина происходит при участии эластазы нейтрофилов. |
| 4. Протеогликаны и гликозаминогликаны. Протеогликаны, ассоциированные с клетками. Мукополисахаридозы | |
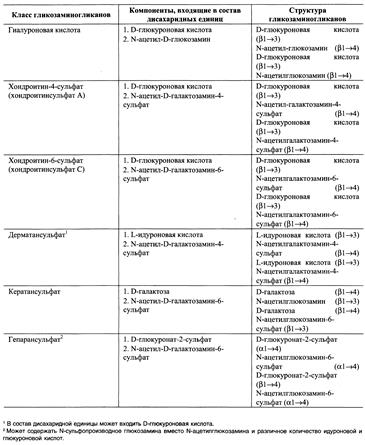
Гликозамингликаны (мукополисахариды)
Гликозаминогликаны соединительной ткани – это линейные неразветвленные полимеры, построенные из повторяющихся дисахаридных единиц. В настоящее время четко расшифрована структура шести основных классов гликозаминогликанов:
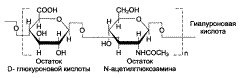
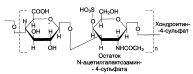
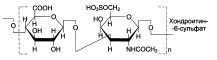
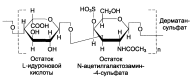
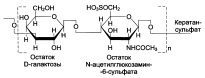
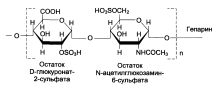 Гликозамингликаны – быстро обменивающиеся белки (Т1/2 – 3-10 дней, кератансульфат – 120 дней).
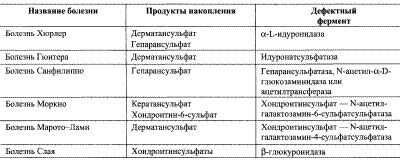
Мукополисахаридозы –тяжёлые наследственные заболевания, возникающие вследствие дефектов гидролаз, принимающих участие в катаболизме гликозамингликанов. В результате – накапливаются гликозамингликаны в тканях (происходят деформации скелета, увеличение органов, наблюдается умственная отсталость, поражаются сосуды, происходит помутнение роговицы).
Протеогликаны
Протеогликаны – высокомолекулярные углеводно-белковые соединения. Они образуют основную субстанцию межклеточного матрикса соединительной ткани. На долю протеогликанов приходится до 30% от сухой массы соединительной ткани.
Основной протеогликан хрящевого матрикса – агрекан:
Гликозамингликаны – быстро обменивающиеся белки (Т1/2 – 3-10 дней, кератансульфат – 120 дней).
Мукополисахаридозы –тяжёлые наследственные заболевания, возникающие вследствие дефектов гидролаз, принимающих участие в катаболизме гликозамингликанов. В результате – накапливаются гликозамингликаны в тканях (происходят деформации скелета, увеличение органов, наблюдается умственная отсталость, поражаются сосуды, происходит помутнение роговицы).
Протеогликаны
Протеогликаны – высокомолекулярные углеводно-белковые соединения. Они образуют основную субстанцию межклеточного матрикса соединительной ткани. На долю протеогликанов приходится до 30% от сухой массы соединительной ткани.
Основной протеогликан хрящевого матрикса – агрекан:
 
|
Структура различных классов гликозамингликанов:
 Типы мукополисахаридозов:
Типы мукополисахаридозов:
|
| 5. Адгезивные и антиадгезивные белки. Базальная мембрана. Протеогликаны базальных мембран | |
Специализированные белки межклеточного матрикса:
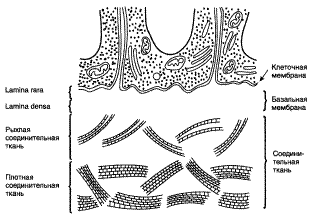 Основные компоненты базальной мембраны – коллаген IV типа, ламинин, гепарансульфатсодержащие протеогликаны.
Нерастворимость и механическую стабильность базальных мембран обеспечивают молекулы коллагена IV типа, которые организуются в специализированную опорную сеть. Эта эластичная трёхмерная сеть образует структурный остов, к которому прикрепляются другие компоненты базальных мембран.
Функции базальных мембран: в почечных клубочках – полупроницаемый фильтр, препятствующий переходу макромолекул из плазмы в первичную мочу; прикрепление и ориентация клеток в пространстве; процессы эмбрионального развития; тканевая регенерация.
Основные компоненты базальной мембраны – коллаген IV типа, ламинин, гепарансульфатсодержащие протеогликаны.
Нерастворимость и механическую стабильность базальных мембран обеспечивают молекулы коллагена IV типа, которые организуются в специализированную опорную сеть. Эта эластичная трёхмерная сеть образует структурный остов, к которому прикрепляются другие компоненты базальных мембран.
Функции базальных мембран: в почечных клубочках – полупроницаемый фильтр, препятствующий переходу макромолекул из плазмы в первичную мочу; прикрепление и ориентация клеток в пространстве; процессы эмбрионального развития; тканевая регенерация.
|
Дата добавления: 2016-03-04; просмотров: 6293;
