Сохранение стабильности иммобилизованных ферментов
Для иммобилизованных ферментов число возможных инактивационных механизмов значительно меньше, чем для нативных ферментов. Так, иммобилизация подавляет агрегацию и автолиз, сорбцию на стенках реактора, нивелирует действие протеаз, фосфорилаз и фосфатаз. Носитель механически защищает молекулы ферментов от деформаций в потоке.
Инактивация ферментов может быть физической и химической. Молекулярные механизмы инактивации ферментов можно представить в виде двух стадий:
N 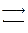 D
D 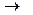 I,
I,
где N – нативная форма белка;
D – обратимо денатурированная форма белка;
I – необратимо инактивированная форма белка.
Стадия (N 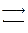 D)– это чаще всего обратимое конформационное изменение.
D)– это чаще всего обратимое конформационное изменение.
На стадии (D 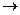 I) инактивация ферментов усиливается при длительной инкубации, высокой температуре, экстремальных значениях рН, в присутствии химических денатуратов и т.д.
I) инактивация ферментов усиливается при длительной инкубации, высокой температуре, экстремальных значениях рН, в присутствии химических денатуратов и т.д.
Инактивация ферментов сопровождается изменением первичной структуры за счет разрыва полипептидной цепи или химической модификации отдельных функциональных групп. Возможна рацемизация аминокислот, дезаминирование аспарагина, десорбция кофакторов из активного центра, сорбция белка на стенках реактора, инактивация в потоке и др.
Соиммобилизация
Вариантом иммобилизации является соиммобилизация – совместная иммобилизация различных биокатализаторов (двух или более ферментов, видов клеток, комбинаций ферментов и клеток и т.д.). Соиммобилизация позволяет осуществлять многостадийные процессы in vitro. Важно учитывать функциональную совместимость биокаталитических систем. Например, превращение крахмала во фруктозу с применением соиммобилизованных глюкоамилазы и бактериальных клеток с глюкоизомеразной активностью не удается. Это объясняется несовпадением оптимумов рН для двух биокатализаторов.
Вопросы для самоконтроля
1) Принцип химической иммобилизации ферментов.
2) Реакция образования амидной связи.
3) Реакция образования карбамидных связей.
4) Реакции образования вторичных аминов.
5) Реакции тиол-дисульфидного обмена.
6) Модификация аминогрупп с образованием азометиновых связей.
7) Сохранение стабильности иммобилизованных ферментов.
8) Молекулярные механизмы инактивации ферментов.
9) Соиммобилизация.
СПИСОК ЛИТЕРАТУРЫ
Основная
1. Биотехнология: учебное пособие для вузов, в 8 кн., под ред. Егорова Н.С., Самуилова В.Д. – М., 1987.
2. Блинов, В.А. Общая биотехнология: курс лекций. В 2-х частях. Ч. 1 / В.А. Блинов. – Саратов, 2003.
3. Тарантул, В.З. Толковый биотехнологический словарь русско-английский: справочное издание / В.З. Тарантул. – М.: Языки славянских культур, 2009. – 936 с. – ISBN: 978-5-95-51-0342-6
Дополнительная
1. Журналы: Биотехнология, Вестник СГАУ, Прикладная биохимия и микробиология, Журнал микробиологии, эпидемиологии, иммунологии, Фармацевтическая промышленность, Кондитерское и хлебопекарное производство, Масложировая промышленность, Молочная промышленность, Переработка молока, Мясные технологии, Сыроделие и маслоделие, Пиво и напитки, Пищевая технология.
2. http://www.biotechnolog.ru
3. Биотехнологический портат Bio-X (ссылка доступа - http://bio-x.ru)
4. Интернет-журнал «Коммерческая биотехнология» (ссылка доступа – http://cbio.ru)
5. Оn-line-журнал «Биотехнология. Теория и практика» (ссылка доступа – http://www.biotechlink.org)
Лекция 11
Дата добавления: 2016-02-27; просмотров: 1548;
