Частная технология антибиотиков
Пенициллины и цефалоспорины - большая группа лекарственных препаратов, имеющих определенное сродство химического строения, механизмов действия, фармакологических, клинических эффектов. Эти препараты называют р-лактамными антибиотиками, что обусловлено наличием в их структуре общего для всей группы четырехчленного лак-тамного кольца.
Все пенициллины имеют одинаковое строение основной группы, которая представлена тиазолидиновым кольцом, соединенным с р-лак-тамным кольцом, и имеющим аминогруппу - 6-аминопеницилановая кислота (6-АПК).
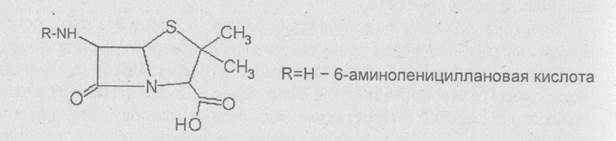
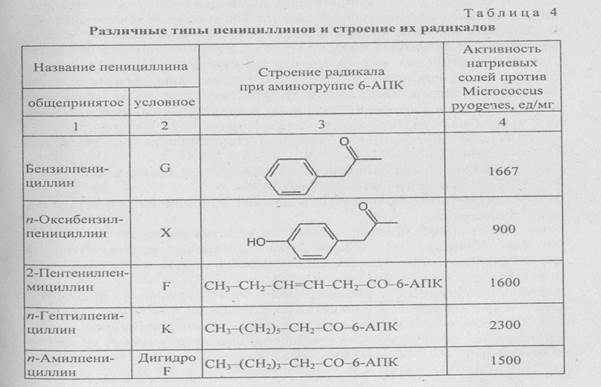
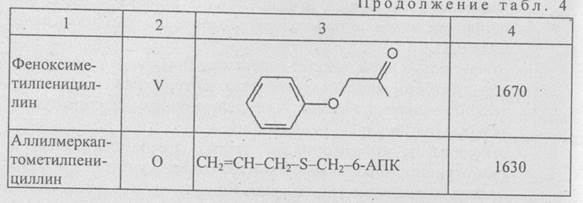
Различные пенициллины (G, X, F, К и др.) отличаются строением радикала молекулы боковой цепи (табл. 4), активностью и спектром действия. Важные, с точки зрения клинического использования, представители пенициллинов можно разделить на несколько групп:
-обладающие наивысшей активностью в отношении грамполо-жительных микроорганизмов и слабой в отношении грамотри-цательных видов, а также гидролизуемые р-лактамазам (пенициллин G);
-относительно резистентные к действию Р-лактамаз стафилококков, но с более низкой активнолстью в отношении грамположи-тельных микроорганизмов и не действующие на грамотрица-тельные (нафициллин, метациллин);
-относительно высокоактивные против грамположительных и грамотрицательных микроорганизмов, но разрушаемых Р-лакта-мазами (карбенициллин, тикарциллин);
-препараты с относительной киелотоустойчивостью и пригодные для перорального применения (пенициллин V, ампициллин, клоксациллин).
Структурное единство ядра 6-АПК существенно для проявления биологической активности молекул. При ферментативном расщеплении р-лактамного кольца бактериальными р-лактамазами (пенициллиназа-ми) с образованием неактивной пенициллановой кислоты антибиотик лишается своих антимикробных свойств. Задачей получения новых пе-нициллинов является разработка препаратов, устойчивых к Р-лакта-мазам или со сниженной способностью к индукции синтеза Р-лактамаз. Для предотвращения возникновения резистентных форм бактерий к Р-лактамным антибиотикам получены липосомальные формы этих антибиотиков (защита антибиотика происходит в результате включения Р-лактама в положительно заряженные липосомы). Комплекс антибиотик— липосома обладает рядом преимуществ:
-снижается токсичность препарата за счет направленного транспорта;
-повышается проникновение антибиотиков через внешнюю мембрану грамотрицательных бактерий;
-антибиотик, включенный в липосомы, защищен от действия Р-лактамоз;
-повышается химическая стабильность антибиотика Для промышленного производства антибиотика используют культуру Penicillium chrysogenum и среду, содержащую кукурузный экстракт, гидрол, лактозу и минеральные соли.
Вместо кукурузного экстракта может быть применена арахисовая мука, жмыхи, мука из хлопковых семян и другие источники; возможность широкого использования продуктов растительного происхождения обусловлена тем, что у P. chrysogenum имеются сильные протеоли-тические ферменты. В качестве углеводов часто используют сахарозу или смесь лактозы с глюкозой в соотношении 1:1. Глюкоза может снижать биосинтез антибиотика; на средах, содержащих лактозу или сахарозу (в условиях депрессии), биосинтез антибиотика идёт активнее. Важную роль в процессе биосинтеза пенициллина играет сера, которая содержится в структуре антибиотика. В качестве источников серы используются натрия сульфат и натрия тиосульфат. Избыток ионов меди не влияет на рост гриба, но подавляет биосинтез пенициллина. Эффект торможения биосинтеза снимается добавлением в среду ионов железа. P. chrysogenum в качестве источника фосфора может использовать не только фосфаты, но и фитаты (соли инозитфосфорных кислот): этот продуцент содержит фермент, разрушающий фитин с освобождением неорганического фосфора.
Температура в период первой фазы должны быть 30 °С, во вторую фазу 20 °С, рН в период роста гриба - ниже 7,0, потребление углеводов должно быть медленным, что достигается использованием лактозы, либо дробным внесением глюкозы.
Синтез того или иного пенициллина зависит от наличия специфичного вещества в среде, иначе говоря, предшественника, который микроорганизм включает в молекулу антибиотика без предварительного расщепления. Следует отметить, что предшественники биосинтеза пенициллина (фенилуксусная кислота, фенилацетамид, феноксиуксусная кислота) при определённых концентрациях и рН среды оказывают токсическое влияние на продуцента. Фенилуксусная кислота наименее токсична. Добавление её в среду в концентрации выше 500 мкг/мл угнетает рост мицелия, особенно в первые 24 ч его развития. Фенилуксусная кислота добавляется в концентрации от 100 до 500 мкг/мл через 24 ч развития P. chrysogenum, При таких условиях обеспечивается наибольший выход бензилпенициллина, который через 72 ч развития может достигать 500-1000 мкг/мл.
При развитии гриба без внесения предшественника образуется около 45% бензилпенициллина (пенициллин G) и около 53% пенициллина К (радикал - и-гептилпенициллин). При добавлении к среде фени-луксусной кислоты (С6Н5СН2СООН) меняется соотношение образующихся компонентов в сторону резкого увеличения бензилпенициллина, количество которого в зависимости от возраста достигает 75—99% от смеси пенициллинов. В процессе культивирования P. chrysogenum в среде, не содержащей фенилуксусной кислоты, в ней накапливаются серосодержащие соединения не Р-лактамного характера, близкие к цис-теину и метионину. Добавление в среду фенилуксусной кислоты способствует более интенсивному метаболизму серосодержащих компонентов в соединения Р-лактамного характера.
При развитии продуцента пенициллинов - гриба P. chrysogenum -на кукурузно-лактозной среде выделяют три фазы.
Первая фаза — рост мицелия, выход антибиотика низок. Всегда присутствующая в кукурузном экстракте молочная кислота потребляется продуцентом с максимальной скоростью, лактоза используется медленно. Потребление кислорода высокое. Усиливается азотный обмен, в результате в среде появляется аммиак и резко поднимается значение рН.
Вторая фаза - максимальное образование пенициллина, это связано с быстрым потреблением лактозы и аммонийного азота. рН среды остаётся почти без изменений, увеличение массы мицелия незначительное, потребление кислорода снижается.
Третья фаза - снижение концентрации антибиотика в среде в связи с начавшимся автолизом мицелия и выделением в результате этого процесса аммиака, что сопровождается повышением рН среды.
В настоящее время описано шесть условно выраженных возрастных фаз продуцента пенициллина. Заметное количество пенициллина начинает образовываться с IV возрастной фазы гриба, максимум накопления приходится на VI фазу - в период автолиза.
Определение возрастных фаз путём микроскопического контроля позволяет установить: 1) ход общего темпа развития гриба, его состояние, пригодное для использования посевного материала, контроль за ходом образования антибиотика; 2) дефекты развития и возможные причины этих дефектов; 3) момент окончания развития гриба в реакторе.
По мере развития гриба меняется и химический состав мицелия. Количество общего азота и белка в мицелии уменьшается, содержание моносахаров в период максимального биосинтеза пенициллина (96 ч) увеличивается почти в 6 раз по сравнению с начальным периодом, количество дисахаридов уменьшается. Изменяется количество отдельных аминокислот.
Процесс биосинтеза пенициллина ведётся при самом тщательном соблюдении стерильности всех операций, так как загрязнение культур посторонней микрофлорой резко снижает накопление антибиотика. Это связано с тем, что многие бактерии воздуха способны образовывать пе-нициллиназу. Особенно активно продуцируют этот фермент В. subtilis и В. cereus. Одним из активных продуцентов пенициллиназы является туберкулёзная палочка (Mycob. tuberculosis). Предположительно именно с этим свойством связана резистентность этого микроорганизма к
пенициллину.
Механизм биосинтеза молекулы пенициллина представлен на схеме.

Современная промышленная микробиология получает культураль-ные жидкости, содержащие свыше 55 тыс. ед/мл. Выделение пенициллина начинается с фильтрации или центрифугирования (отделения мицелия гриба).
Из культуральной жидкости антибиотик, где он находится в виде кислоты, выделяют путём экстракции неполярными органическими растворителями (амилацетатом, хлороформом, бутилацетатом, бутано-лом и др.). Очистку антибиотика проводят путём замены растворителей, поскольку соли пенициллина плохо растворимы в органических растворителях. Экстрагированный пенициллин в виде кислоты переводят в водный раствор в виде соли, добавляя щёлочь. Повторяя эти операции, пенициллин концентрируют и очищают. Большинство пенициллинов производят в виде натриевых или калиевых солей. Новокаиновые и бен-затиновые соли являются основой пролонгированных препаратов пенициллина для внутримышечного введения.
В сухой кристаллической форме пенициллиновые соли достаточно стабильны в течение длительного времени при температуре 4 °С. Растворы быстро теряют активность (в течение 24 часов при температуре 20 °С), их готовят непосредственно перед введением.
В настоящее время большое практическое значение имеет полусинтетический (биологический + химический) способ получения аналогов природного пенициллина. Исходным продуктом служит 6-аминопени-циллановая кислота (6-АПК).
6-АПК получают в результате биосинтеза при развитии P. chryso-genum при отсутствии предшественника в среде или путём ферментативного дезацилирования бензилпенициллина или феноксиметилпени-циллина при участии фермента пенициллинацилазы (пенициллинамида-зы). Второй способ наиболее перспективен. Используется иммобилизованная пенициллинацилаза, которая гидролизует бензилпенициллин с образованием 6-АПК и фенилуксусной кислоты. Пенициллинацилаза образуется различными группами микроорганизмов, в том числе она образуется всеми продуцирующими пенициллин грибами. В настоящее время предложен способ получения иммобилизованных клеток Е. coli с высокой пенициллинацилазной активностью, пригодных для многократного применения.
Сама по себе 6-АПК не активна. Её подвергают химическому аци-лированию и получают аналоги пенициллина с улучшенными или новыми свойствами; некоторые из них: оксациллин, ампициллин, мети-циллин, амоксициллин и другие. Всего в настоящее время используется порядка четырёх десятков таких препаратов.
В настоящее время бензилпенициллин необходим не только как медицинский препарат, но и как вещество, являющееся исходным продуктом для получения 6-АПК и в дальнейшем полусинтетических пени-циллинов. Из общего количества природных пенициллинов примерно 35% используется как медицинские препараты, а 65% - для получения 6-АПК.
В начале 60-х гг. были предприняты попытки химического синтеза пенициллинов, в частности был синтезирован феноксиметилпеницил-лин, но практического значения эти попытки не имели.
Большинство пенициллинов производят в виде натриевых и калиевых солей. Новокаиновые и бензокаиновые соли являются пролонгированными формами для внутримышечного введения. В сухой кристаллической форме пенициллиновые соли достаточно стабильны при температуре 4 °С. Растворы быстро теряют активность (в течение 24 ч при температуре 20 °С), их готовят непосредственно перед введением. Пероральные пенициллины применяют за 1 ч до или через 2 ч после приема пищи, чтобы снизить связывание компонентами пищи и кислотную инактивацию препаратов.
Цефалоспорин — антибиотик из грибов рода Cepholosporium. Основным продуцентом является С. acremonium.
Впервые сообщение было сделано Джузеппе Бротцу в 1948 г. В культуральной жидкости было обнаружено несколько цефалоспоринов, основной из которых — цефалоспорин С. На основе этого антибиотика в дальнейшем были созданы многочисленные полусинтетические цефа-лоспорины с ценными свойствами.
По химическому строению цефалоспорин принадлежит к Р-лактам-ным соединениям, но Р-лактамное кольцо конденсировано не с пяти, а с шестичленным гетероциклом. Цефалоспорины в отличие от пеницил-линов устойчивы к р-лактамазе, подавляют развитие и грамположи-тельных и грамотрицательных бактерий, но активность этого антибиотика ниже пенициллина.
Цефалоспорин не инактивируется пенициллиназой. Но имеется аналогичный фермент, гидролизующий Р-лактамное кольцо цефалоспорина
— цефалоспориназа.
В процессе развития С. acremonium наряду с цефалоспорином С синтезируется и пенициллин N. Его образование идёт тем же путём, что и образование изопенициллина N в процессе биосинтеза бензилпени-циллина. Через ряд стадий из изопенициллина N образуется цефалоспорин С.
Все пенициллины и цефалоспорины являются селективными ингибиторами синтеза клеточной стенки. Первый этап действия препаратов заключается в их связывании с клеточными рецепторами; такими рецепторами являются пенщиллинсвязывающие протеины (ПСП), количество которых составляет от 3 до 6 тыс. у различных бактерий. Отдельные ПСП могут иметь неодинаковый аффинитет к препарату, и каждый из них может опосредовать различное действие. Так, присоединение пенициллина к одному ПСП может вызывать аномальное увеличение клетки, присоединение к другому - приводить к дефекту на поверхности клеточной стенки без последующего лизиса клетки. ПСП контролируется хромосомами, мутации могут изменить их количества и аффинитет к отдельным Р-лактамным препаратам. После связывания /?-лактамнного препарата с рецепторами ПСП ингибируется реакция транспепдидирования и останавливается синтез пептидогликана. Следующий этап - устранение или инактивация ингибитора аутолити-
ческих энзимов (гидролаз) в клеточной стенке, что сопровождается активизацией литического фермента у некоторых микроорганизмов и может привесити к лизису клетки.
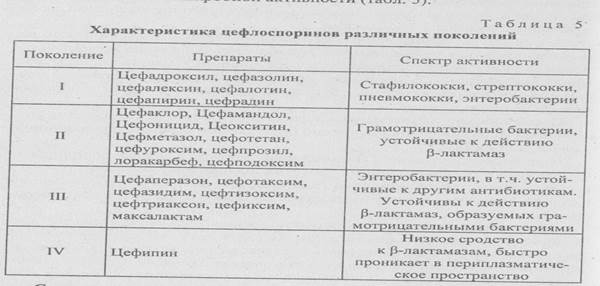
В последние годы методом смешанного (биологического и химического) синтеза удалось получить около 50 тыс. аналогов цефалоспори-на. Примерно 50 антибиотиков имеет практическое клиническое значение. Цефалоспорины традиционно делят на четыре поколения по спектру действия и антимикробной активности (табл. 5).
Стрептомицин принадлежит к группе аминогликозидных антибиотиков.
Актиномицет, синтезирующий стрептомицин Streptomyces griseus впервые был выделен в лаборатории микробиологии Ратжерского университета в 1943 г. С появлением стрептомицина медицина получила мощное оружие для борьбы с таким тяжёлым и достаточно широко распространённым заболеванием, как туберкулёз. Поэтому детально разрабатывались вопросы применения стрептомицина в терапии различных инфекционных заболеваний и его промышленного производства.
Стрептомицин продуцируют ряд видов актиномицетов рода Streptomyces. Однако основным продуцентом стрептомицина признан S. griseus, способный синтезировать до 10—20 тыс мкг/мл антибиотика. Культуры актиномицетов весьма вариабельны и каждому штамму должна соответствовать определённая среда и свой режим для развития микроорганизма. На их изменчивость влияют условия культивирования и особенно состав сред (на более богатых по составу средах наблюдается и более быстрая изменчивость). Изменчивость продуцентов стрептомицина - результат генетической нестабильности этих микроорганизмов, обусловленный существенными перестройками ДНК, которые затрагивают многие гены, в том числе и гены биосинтеза антибиотиков и гены устойчивости к ним.
Для стабилизации признаков, связанных с антибиотикообразовани-ем, при хранении и поддержании штамма иногда в среды добавляют антимутагены - вещества, способные стабилизировать процессы, приводящие к хромосомным перестройкам и регуляции экспрессии генов. Среди антимутагенов — пуриновые нуклеотиды, ионы марганца, L-метионин, гистидин, полиамины, кофеин и другие соединения. В контроле биосинтеза стрептомицина S. griseus принимает участие плазмид-ная ДНК, в процессе биосинтеза - 20-30 генов.
При промышленном производстве стрептомицина используются штаммы, хорошо развивающиеся на соевых средах, их основными компонентами является соевая мука, гидрол, аммонийные соли. Существенную роль в биосинтезе стрептомицина играют жиры соевой муки и её минеральный состав. Белок сои и его кислотный гидролизат малопригодны для биосинтеза антибиотика.
Аэрация среды имеет существенное значение, так как S. griseus -высокоаэробный организм и поглощает значительное количество кислорода, которое зависит от состава среды и стадии развития продуцента. В ранний период развития актиномицета потребление кислорода воздуха более интенсивное, а затем оно падает до нуля. Увеличение степени аэрации повышает выход стрептомицина. В анаэробных условиях продуцент стрептомицина развивается слабо. Мицелий,- выращенный в аэробных условиях и перенесённый затем в анаэробные, стрептомицина не образует. Для максимального накопления антибиотика культура должна находиться в условиях непрерывной аэрации.
Оптимальная температура для развития антибиотика 27-29 °С. Повышение её до 30 °С и выше резко снижает и даже прекращает его образование. Оптимальную температуру меняют в зависимости от штамма продуцента и состава среды.
Лучшим начальным рН для развития актиномицета является 7,0. Стрептомицин образуется при значении рН от 7,5 до 8,5. В кислых средах активность стрептомицина снижается, в щелочных - максимальная. Так, активность стрептомицина при рН 5,8 в 20-80 раз меньше, чем при рН 8,0. Для проявления максимальной антимикробной активности стрептомицина оптимальное значение рН 7,5-8,0.
Наличие некоторых веществ в среде влияет на антибиотическую активность стрептомицина. Если к этой среде прибавить 0,5-3% натрия хлорида, калия хлорида или натрия сульфата, Е. coli развивается в присутствии 10 мкг/мл стрептомицина. Имеется два объяснения этому факту: в присутствии натрия хлорида уменьшается скорость и степень диффузии стрептомицина, или натрия хлорид снижает адсорбцию антибиотика бактериальной клеткой. При концентрации пировиноградной, фумаровой кислот до 1% продуцент развивается в присутствии 10 мкг/мл стрептомицина, если концентрацию солей повысить до 3%, рост бактерий наблюдается при концентрации антибиотика 150 мкг/мл. Защитные свойства этих кислот по-разному проявляются по отношению к различным микроорганизмам. В отношении Е. coli защитные свойства проявляются в большей степени, в отношении Staph. aureus защитных свойств не наблюдается. Сильно снижается активность стрептомицина в присутствии цистеина и гидроксиламина (цистеин полностью инакти-вирует антибиотик в течение нескольких часов).
При развитии продуцента различают две основные стадии. На первой стадии идёт быстрый рост и развитие микроорганизма с энергичным использованием основных компонентов субстрата, максимальное потребление кислорода. В цитоплазме высокое содержание РНК, ДНК вначале отсутствует и обнаруживается только через 12 ч развития. В среде происходит некоторое увеличение аммонийного азота, связанное с разложением белков соевой муки. рН вначале несколько снижается, затем повышается с 6,8 до 7,9. Образование стрептомицина незначительное.
Через 28 ч масса мицелия прекращает увеличиваться, начинается вторая стадия — процесс образования стрептомицина. На третьи сутки рН с 7,9 падает до 6,7, а на четвёртые и пятые - вновь возрастает до 7,7. Вторая стадия характеризуется медленным потреблением оставшихся в среде питательных веществ, замедлением роста актиномицета, снижением потребления кислорода, автолизом мицелия, максимальным образованием стрептомицина. Максимальное накопление стрептомицина наблюдается, когда автолитические процессы начинают преобладать над процессами роста. Количество аммонийного азота продолжает возрастать, что, по всей вероятности, связано с разложением белков соевой муки и автолизом мицелия. В культуральной жидкости находятся минеральные вещества, белки, нуклеиновые кислоты, аминокислоты, полисахариды, жиры, стрептомицин и другие вещества.
S. griseus при определённых условиях развития культуры образует ещё один антибиотик - маннозидострептомицин (стрептомицин В), в чистом виде выделенный в 1947 г. из культуры актиномицета методом противоточной хроматографии. Маннозидострептомицин отличается от стрептомицина наличием в молекуле маннозы. Он менее активен, чем стрептомицин. Культуры S. griseus содержат фермент, превращающий маннозидострептомицин в стрептомицин. При соответствующем контроле развития культуры актиномицета можно добиться минимального образования маннозидострептомицина.
Основная часть стрептомицина выделяется в культуральную среду, но часть его остаётся в мицелии и на его поверхности. С целью извлечения стрептомицина из микроорганизма культуральную жидкость вместе с биомассой обрабатывают минеральной кислотой. При этом весь антибиотик переходит в раствор. Мицелий отделяют прессованием или центрифугированием. Свободную от мицелия культуральную жидкость обрабатывают щавелевой кислотой. Этим достигается удаление белков и органических оснований, ионов металлов (кальция, магния, железа), далее ведётся выделение стрептомицина в чистом виде.
Стрептомицин - сильно полярное соединение и его основание и соли неорганических кислот хорошо растворимы в воде. Соли же органических кислот стрептомицина нерастворимы почти во всех органических растворителях.
Для выделения стрептомицина из культуральной жидкости в чистом виде используются методы адсорбции на активированном угле и метод ионообменной хроматографии.
В основу первого метода положена адсорбция стрептомицина на активированном угле при нейтральном или слабощелочном рН среды. При рН 2-4 стрептомицин остаётся в растворе, в то время как примеси адсорбируются на сорбент. После удаления примесей на активированный уголь адсорбируют из подщелоченной среды антибиотик, его десорбцию осуществляют этанолом, подкисленным кислотой хлороводородной. Далее в раствор добавляется диэтиловый эфир — стрептомицин выпадает в осадок.
Стабильность стрептомицина имеет значение для производства и хранения антибиотика. Она зависит от чистоты препарата, влажности, температуры, рН растворителя. Химически чистый стрептомицин устойчив в сухом состоянии и в виде растворов. Соли стрептомицина при хранении при комнатной температуре инактивируются лишь в незначительной степени на протяжении нескольких лет. Максимальная стабильность растворов стрептомицина сульфата и гидрохлорида находится при рН от 3,0 до 7,0 при температуре от 7 до 25 °С.
По отношению к стрептомицину микроорганизмы условно делятся на 3 группы:
1.Чувствительные, рост которых подавляется при концентрации стрептомицина 10 мкг/мл, это роды Bacillus, Bordetella, Brucella, Klebsiella, Mycobacterium, Staphylococcus и некоторые другие.
2.Умеренно чувствительные, для подавления которых in vitro необходима концентрация антибиотика от 10 до 100 мкг/мл, сюда относят многие бактерии из родов Enterobacter, Corinebacterium, Diplococcus, Proteus, Streptococcus, Vibrio.
3.Устойчивые, для подавления которых необходима концентрация стрептомицина, превышающая 100 мкг/мл. К этой группе относят роды Bacteroides, Clostridium, некоторые виды Proteus, многие виды грибов, дрожжей, риккетсии, вирусы.
К стрептомицину легко возникает вторичная резистентность. Повышение устойчивости к нему в 1000 раз возникает у золотистого стафилококка всего лишь через три пассажа на бульоне с возрастающими концентрациями антибиотика, а у Salmonella typhi повышение устойчивости после 14 пассажей наблюдается в 22 600 раз.
При лечении стрептомицином необходимо учитывать его побочные эффекты, могут появиться глухота, вестибулярные и другие нарушения функций. Их развитие определяется длительностью периода лечения, дозой антибиотика, методами введения, степенью очистки. Токсичность менее очищенных препаратов стрептомицина первого периода получения и применения стрептомицина была более высокой, что связано с наличием в препаратах гистаминоподобных веществ, которые сами достаточно токсичны.
Грамицидин С. Продуцент Bacillus brevis способен синтезировать полипептидные антибиотики, к числу которых относят грамицидины А, В, CD, D, С. Последний иногда обозначают как грамицидин S (советский грамицидин). Все они отличаются как по аминокислотному составу, так и по пространственной структуре молекулы.
Для производства грамицидина С (S) предложены среды на основе мясного и дрожжевого гидролизатов, содержащие сбалансированный набор минеральных и органических солей.
В процессе культивирования необходимо подобрать сбалансированное сочетание интенсивности аэрации среды (от 0,38 до 4,38 г O2(л/ч)) и концентрации входящих в неё веществ. Температура культивирования -40 °С. Развитие продуцента и синтез антибиотика может идти и при температуре 28 °С, но в этом случае максимальный биосинтез антибиотика наблюдается в первые 24 ч, в то время, как при температуре 40 °С - между 24 и 48 ч.
При выделение грамицидина С культуральную жидкость подкисляют кислотой хлороводородной до рН 4,5-5,0. В осадок выпадает ди-хлоргидрат грамицидина С вместе с бактериальными клетками продуцента. Из осадка антибиотик экстрагируют этанолом. Концентрат, содержащий 4 % грамицидина, используется в медицинской практике.
Неомицины. В 1949 г. 3. Ваксман и X. Лешевалье из культуры Streptomyces fradiae выделили неомицин. В дальнейшем было установлено, что это комплекс, состоящий из семи антибиотиков аминоглико-
зидного строения.
На синтетической среде актиномицет развивается лучше, чем на среде с соевой мукой, но биосинтез неомицина на синтетической среде почти в 8 раз ниже, чем на натуральной среде неопределённого состава. Некоторые вещества способствуют повышению выхода неомицина на 50%. К ним относятся ауксин, а-нафтилуксусная кислота. Наиболее эффективная доза ауксинов - семь частей на миллион, внесённая в среду перед стерилизацией. Стимулирующий эффект ауксинов проявляется при продолжительности процесса 138-162 ч, в ранние сроки развития культуры эффект отсутствует.
В процессе образования антибиотика существенную роль играет цинк. Степень аэрации культуры должна быть несколько ниже, чем при выработке стрептомицина.
Неомицины - основания, хорошо растворимые в воде и нерастворимые в органических растворителях, наибольшая их антибиотическая активность проявляется в щелочной среде.
Неомициновый комплекс не теряет антимикробных свойств при длительном хранении (до 2-х лет) как в виде растворов, так и в твёрдом состоянии.
Антимикробный спектр сходен со спектром стрептомицина. Но не-омицин подавляет развитие устойчивых к стрептомицину штаммов Му-cobacterium tuberculosis. Он малоактивен в отношении большинства видов Clostridium, Streptococcus, грибов, а также против вирусов и про-тозоа.
Чувствительные к неомицину микроорганизмы приобретают устойчивость к нему в меньшей степени, чем к стрептомицину.
При использовании неомицина следует учитывать его токсичность. Для человека неомицин более токсичен, чем стрептомицин. Степень токсичности колеблется в зависимости от состава неомицинового комплекса и чистоты препарата.
Тест-контроль к главе 7 Выберите правильные ответы:
1.Антибиотики являются".
А - первичными метаболитами;
Б — вторичными метаболитами.
2.Биологическая роль антибиотиков:
А — они необходимы для деления клеток;
Б — это одна из форм микробного антагонизма;
В - являются кофакторами ферментов, принимающих участие в
синтезе клеточной мембраны;
Г - являются кофакторами ферментов, принимающих участие в
формировании клеточной стенки.
3. Цель стадии предварительной обработки культуральной жидкости в производстве антибиотиков:
А - освободить культуральную жидкость от кислорода;
Б ~ освободить культуральную жидкость от продуцента;
В - освободить культуральную жидкость от окислителей;
Г - освободить культуральную жидкость от азотистых соединений.
4.Процессы, НЕ характерные для тропофазы стадии биосинтеза
антибиотиков:
А — интенсивное накопление биомассы продуцента;
Б - интенсивное поглощение кислорода;
В - снижение уровня рН;
Г - интенсивное образование антибиотика.
5.Автолиз мицелия продуцента в процессе биосинтеза антибиотиков характерен для стадии:
А-тропофазы;
Б - идиофазы.
6. Натуральные среды как правило не используются:
А - для поддержания культуры микроорганизма;
Б - для накопления биомассы;
В - для диагностических целей;
Г - для изучения обмена веществ.
7. Источник углерода подбирается с таким расчётом, чтобы:
А - продуцент активно развивался и в идиофазу, и в тропофазу;
Б - накопление антибиотика максимально шло и в идиофазу, и в
тропофазу;
В - продуцент активно развивался в идиофазу и максимально
синтезировал антибиотик в тропофазу;
Г - эффективно шло использование источника азота.
8.При биосинтезе какого антибиотика необходим источник хлора:
А - ампициллина;
Б - стрептомицина;
В - левомицетина;
Г — грамицидина С.
9. При использовании в качестве источника азота калия нитрата субстрат будет:
А - подщелачиваться;
Б - подкисляться;
В - среда остаётся нейтральной.
10. При использовании в качестве источника азота аммония сульфата в присутствии ионов кальция субстрат будет:
А — подщелачиваться;
Б - подкисляться;
В - среда остаётся нейтральной.
11. Антибиотик, нарушающий синтез клеточной стенки микроорганизмов:
А - эритромицин;
Б - хлортетрациклин;
В - хлорамфеникол;
Г - феноксиметилпенициллин.
12. Антибиотик, к которому медленно развивается у микроорганизмов вторичная резистентность:
А - эритромицин;
Б - стрептомицин;
В - хлорамфеникол;
Г — канамицин.
13.Не вводят в культуральную среду на стадии биосинтеза антибиотика:
А — стерильный воздух;
Б — пеногасители;
В - пенообразователи.
14. Перекись водорода может вводиться в культуральную среду на стадии биосинтеза антибиотика с целью:
А - подкисления среды;
Б - подщелачивания среды;
В - разжижения среды;
Г — ликвидации кислородного голодания продуцента.
15. В производстве антибиотиков при культивировании микроорганизмов используется:
А — поверхностное культивирование;
Б - глубинное культивирование.
16.В производстве антибиотиков при культивировании микроорганизмов используются питательные среды:
А - твёрдые;
Б - жидкие;
В — мягкие;
Г - газообразные.
17.Какая цель НЕ преследуется при перемешивании среды в реакторе:
А - удаление с поверхности клеток продуктов обмена и лизиса
клеток;
Б - распыление воздуха, выходящего из барботёра;
В - равномерное распределение питательных веществ;
Г - отделение культуральной среды от продуцента.
18.Микроорганизмы, которые НЕ используются в процессе биосинтеза антибиотиков:
А - вирусы;
Б - бактерии;
В - актиномицеты;
Г - грибы.
19. Широкое применение для промышленного выделения и очистки антибиотиков находит:
А - хроматография в тонких слоях;
Б - ионообменная хроматография;
В - высокоэффективная жидкостная хроматография;
Г - бумажная хроматография.
20. Требование, неприемлемое для кормовых антибиотиков:
А — не должны всасываться из желудочно-кишечного тракта;
Б - не должны загрязнять продукты животного происхождения;
В - должны использоваться в медицине;
Г-не должны обладать способностью образовывать у микроорганизмов множественную резистентность.
21. Грамицидан С из культуральной жидкости осаждают:
А - кислотой хлороводородной;
Б - сернокислым аммонием;
Г - этанолом.
22. Для выделения полимиксинов из культуральной среды используется:
А - гель-фильтрация;
Б - катеониты;
В - аниониты;
Г — силикагель.
23.При промышленном производстве стрептомицина используются штаммы, хорошо развивающиеся на средах:
А - кукурузных;
Б - гороховых;
В - хлопковых;
Г - соевых.
24. Токсичность плохо очищенных препаратов стрептомицина связана:
А - с наличием в препаратах гистаминоподобных веществ;
Б — с образованием токсичных веществ из стрептомицина;
В — с повышенной скоростью проникновения стрептомицина в
ткани организма;
Г — с пониженной скоростью проникновения стрептомицина в ткани организма и, таким образом, повышенным его содержанием в крови.
Дата добавления: 2016-02-24; просмотров: 2387;
