ЗАДАНИЯ К ЛАБОРАТОРНОЙ РАБОТЕ 3
ЗАДАНИЕ 1,2. Определение содержания ионов в растворе фотоколориметрическим методом.
Цель работы.
1. Освоить методику фотоколориметрического метода определения концентрации растворов (стр. 156-158).
2. Определить содержание ионов меди или железа (Ш) в заданном растворе методом калибровочной кривой .
3. Рассчитать относительную ошибку работы и сделать выводы.
ЗАДАНИЕ 3, 4. Подбор длины волны по максимальному светопоглощению для растворов содержащих ионы Fe3+ или Сu2+ .
Цель работы.
1. Освоить методику измерения абсорбции света (стр.158-159).
2. Определить абсорбцию (оптическую плотность) в растворе Cu SO4 или Fe2 (SO4 )3 при различных длинах волн.
3. Построить графическую зависимость абсорбции света от длины волны ( спектр поглощения ).
4. Сделать вывод, при какой длине волны наблюдается максимальное светопоглощение.
МЕТОДИКА ПРОВЕДЕНИЯ РАБОТЫ 1,2
1. Готовят 5-6 стандартных растворов исследуемого вещества согласно заданию ( см. методику приготовления растворов для задания 1,2 - с. 157-158).
2. Измеряют адсорбцию света в каждом из растворов с помощью фотоэлектрокалориметра (см. правила работы на приборе), при этом используют соответствующий светофильтр. Измерения проводят в 2-3 кратной повторности. Кювету после каждого определения промывают 2 раза дистиллированной водой и ополаскивают следующим раствором. Данные записывают в таблицу 3.1.
Таблица 3.1 Результаты измерений абсорбции света
| № п/п | V -объемы исходных растворов, см3 | С – концентрация приготовленного раствора, 10-x г/см3 | Значения Dl | Примечание | ||
| среднее | ||||||
3. Строят калибровочный график Dl = f(C) в соответствии с рис. 3.1.
4. Получают у преподавателя испытуемый раствор, проводят с ним необходимые подготовительные операции, доводят объем до метки и дважды измеряют абсорбцию света.
Данные заносят в табл. 3.1.
5. Определяют по калибровочному графику концентрацию исследуемого раствора Сx, г/см3.
6. Общее содержание определяемых ионов (m) рассчитывают, умножив найденную концентрацию на объем мерной колбы (V).
| m = Cx × V | 3.58 |
7. Сравнив свой результат с истинным значением (mo – взять у преподавателя), рассчитывают ошибки эксперимента:
а) абсолютную А = /mo – m/ ,
б) относительную q = 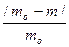 · 100% .
· 100% .
8. Делают выводы и оформляют работу.
ЗАДАНИЕ 1. Определение ионов меди.
Готовят исходные стандартные растворы. Для этого из бюретки на титровальной полке в отдельные пронумерованные мерные колбы объемом 50 см3 отбирают по 5, 10, 15, 20, 25 см3 исходного раствора CиSO4×5H2O концентрацией 1×10-3 г/см3.Затем приливают в каждую колбу по 10 см3 раствора NH4OH (1:3) для образования окрашенного комплексного соединения:
2CuSO4+ 2 NH4OH = [Cu2(OH)2]SO4 + (NH4)2SO4 + 6 NH4OH =
= 2 [Cu (NH3)4]SO4 + 8H2O
Дата добавления: 2016-02-20; просмотров: 749;
