Термодинамические основы рабочих процессов
В природе вещество в зависимости от условий может находиться твердом, жидком или газообразном агрегатном состоянии.
Расстояние между атомами и, молекулами газа при атмосферном давлении во много раз превышает линейные размеры самих части, а средняя кинетическая энергия молекул превосходит среднюю потенциальную энергию взаимодействие между ними. По этой причине газ способен, неограниченно расширятся, так как силы притяжения могут удержать молекулы или атомы друг возле друга.
В жидкостях молекулы расположены почти вплотную. Средняя кинетическая энергия их меньше средней потенциальной, и молекулы могут лишь изменять свое положение в веществе. Движение молекул совершается преимущественно в направлении действия силы (например, силы притяжения Земли), что обусловливает текучесть жидкости и принятие ею формы сосуда, в который она заключена.
Средняя кинетическая энергия атомов или молекул твердых тел намного меньше средней потенциальной энергии взаимодействия молекул. Здесь элементарные частицы твердых тел могут только кол баться около^ определенных пол жений равновесия, образуя геоме рически правильные пространственые формы, называемые кристалл ческими. По этим причинам тверд! тела в отличие от жидкостей г стоянно сохраняют не только объем, но и форму.
Каждое агрегатное состояние вещества возможно только в onpeделенных пределах температур и давлений. По мере изменения условии постепенно меняется и соотношение между средними значениями кинетической и потенциальной энергии, пока количественное изменение не перейдет в качественное.
При нагревании твердого тела средняя кинетическая энергия атомов или молекул и амплитуда их колебаний относительно своих центров будут возрастать. Достигнув определенной температуры, называемой температурой плавления, амплитуда колебаний увеличивается настолько, что изменяет порядок в расположении частиц. Кристаллы теряют свою форму. Процесс превращения кристаллического вещества в жидкое протекает постепенно по мере разрушения отдельных кристаллов. Вся энергия, подводимая к телу при плавлении, тратится только на разрушение кристаллов, поэтому средняя кинетическая энергия частиц, а значит и температура вещества в процессе плавления остаются постоянными, меняется только средняя потенциальная энергия взаимодействия частиц.
При температуре плавления внутренняя энергия единицы массы вещества в жидком состоянии больше внутренней энергии этого же количества вещества в твердом состоянии на некоторое значение, называемое удельной теплотой плавления. Например, внутренняя энергия 1 кг воды при О °С на 340 кДж больше внутренней энергии 1 кг льда при той же температуре. Удельную теплоту плавления льда в холодильной технике называют холодо-производительностью единицы массы льда. Удельная теплота плавления каждого вещества имеет свое значение.
Процесс отвердевания вещества происходит в обратном порядке: в охлаждаемом теле средняя кинетическая энергия и скорость молекул уменьшаются до тех пор, пока силы притяжения смогут удержать частицы в изначальном состоянии.
Затвердевание вещества, за некоторым исключением, происходит при той же температуре, что и плавление твердых тел.
Ранее отмечалось, что температуры жидкости твердого и газообразного веществ зависят от средней кинетической энергии молекул. Каждой температуре соответствует вполне определенное значение этой энергии молекул, но отдельные частицы жидкости имеют большее или меньшее значения кинетической энергии, отличное от среднего значения. Если молекула, обладая достаточной кинетической энергией, окажется у поверхности жидкости, она преодолеет притяжение соседних молекул и оторвется от поверхности тела. Вылетевшие с поверхности жидкости молекулы образуют над жидкостью пар. Процесс перехода молекул со свободной поверхности жидкости в пар называют испарением. Поскольку из жидкости в пар выходят частицы с высокой кинетической энергией, то среднее значение кинетической энергии остающихся в жидкости молекул уменьшается, испаряющаяся жидкость охлаждается, а ее температура понижается.
Каждым температуре и давлению соответствует вполне определенная максимальная плотность пара над жидкостью. При максимальной плотности количество молекул, покидающих поверхность жидкости, будет равно количеству молекул пара, возвращающихся в нее. Пар максимально возможной плотности для данной температуры называется насыщенным.
В результате нагрева жидкости средняя кинетическая энергия молекул повышается, и интенсивность испарения с ее поверхности увеличивается. Наконец, при некоторой температуре по всему объему жидкости начинают образовываться центры парообразования в виде пузырьков, внутри которых также происходит испарение. Когда давление насыщенного пара внутри пузырьков сравнивается с внешним давлением, они всплывают на поверхность и жидкость закипает. Таким образом, кипение представляет собой процесс испарения не только с поверхности жидкости, но и внутри пузырьков, по всему объему жидкости.
Температуру, при которой жидкость кипит, называют температурой кипения. Она не изменяется при постоянном давлении на протяжении всего процесса кипения.
Одно и то же давление насыщенного пара в пузырьках у различных жидкостей образуется при разных температурах кипения. Так, например, температура кипения воды при атмосферном давлении равна +100°С, а у аммиака она намного ниже и равна -33,4 °С.
В процессе кипения жидкости энергия расходуется частицами, которые участвуют в парообразовании. Кипение будет продолжаться, если будут возникать новые частицы с высокой кинетической энергией, для чего требуется дополнительный подвод теплоты извне. В холодильной технике используются вещества, способные при низких температурах в центрах парообразования создавать высокое давление насыщенного пара, а значит и кипеть. Если температура кипения жидкости, например аммиака, ниже температуры окружающей среды, то необходимое количество теплоты для кипения может подводиться непосредственно из охлаждаемого помещения, чем и создается охлаждающий эффект. Количество теплоты, необходимое для превращения в пар единицы массы жидкости, нагретой до температуры кипения, называют удельной теплотой парообразования. Она измеряется в килоджоулях на килограмм (кДж/кг). Таким образом, при одинаковой температуре внутренняя энергия единицы массы вещества в газообразном состоянии больше внутренней энергии этого же количества вещества в жидком состоянии на удельную теплоту парообрзования.
Температура кипения зависит только от жидкости, но и от внешнего давления. Чем выше внешние давление, тем больше давление в пузырьках насыщенного пара при закипании жидкости и больше энергии подводится для совершения работы против сил внешнего давлении. Увеличение энергии вызывает повышение температуры жидкости, и этому при повышении внешнего давления температура кипения растет. Так, при давлении, в 3 раза превышающем атмосферное, температура кипения воды будет +130 °С, а у аммиака -20 °С. Наоборот, уменьшение внешнего давления приводит к понижению температуры кипения.
Отвод теплоты от насыщенного пара вызывает процесс, обратный кипению,- конденсацию пара, превращение пара в жидкость. Koнденсация пара происходит при постоянной температуре с выделение теплоты, равной удельной теплоте парообразования. Температура конденсации повышается с ростом внешнего давления и понижается при его уменьшении.
Некоторые твердые веществ, как и жидкости, имеют частиц (атомы и молекулы), кинетическая энергия которых значительно превосходит среднее значение и достаточна для преодоления потенциальной энергии взаимодействия молекул и атомов. Подобные частиц отрываются от других молекул и непосредственно переходят в пар. При этом средняя кинетическа энергия тела, а, следовательно, и его температура, уменьшаются. Подобное явление называется сублимацией.
Количество теплоты, необходимое для перехода единицы массы твердого тела в пар, минуя жидкую фазу, при постоянной температур называется удельной теплотой сублимации. Она измеряется в килоджоулях на килограмм (кДж/кг). Примером испаряющихся твердых тел являются йод и сухой лед (твердая двуокись углерода).
В холодильной технике термодинамические процессы принято изображать на диаграммах sT (энтропия - температура), ilg p (энтальпия - давление, рис. 1.1, а, б). На диаграммах нанесены левая пограничная кривая (х=0), отделяющая жидкость от области насыщенного пара, и правая (х=1), разграничивающая области насыщенного и перегретого паров. Перегретый пар образуется при нагреве насыщенного пара в состоянии, характеризуемом правой пограничной кривой (сухой, насыщенный пар).
Точка К, в которой сливаются левая и правая пограничные кривые, называется критической, а параметры, ей соответствующие, критическими. При критической температуре различие между паром и жидкостью исчезает, а теплота парообразования становится равной нулю. При температурах выше критической невозможна конденсация пара ни при каких условиях.
Между кривыми х=0 и х=1 расположена область влажного пара, на которую нанесены линии постоянного паросодержания (х=const). Каждая точка кривой х=const характеризует одинаковое количество пара, приходящегося на единицу массы парожидкостной смеси. На диаграмме sT показаны горизонтальные линии постоянных температур (t=const), изотермы, и вертикальные линии постоянных энтропий (s=const)-адиабаты. Ломаными линиями изображены изобары (р=const), т. е. линии, каждая точка которых соответствует одинаковому давлению. В области жидкости все они практически совпадают с левой пограничной кривой, в области насыщенного пара проходят параллельно изотермам, а в области перегретого пара круто идут вверх. Кроме этих кривых, на диаграмме нанесены линии постоянных значений энтальпий i=const (изоэнтальпы) и линии постоянных значений удельных объемов v = const (изохоры).
Диаграмма ilgp образована горизонтальными изобарами (р = = const) и вертикальными изоэнтальпами (i=const). Учитывая, что давление при более высоких температурах увеличивается с ростом температуры быстрее, чем при низких, с целью удобства изображения процессов для давлений ввели логарифмическую шкалу. На диаграмме ilgp наиболее сложную форму имеют изотермы t=const, круто поднимающиеся вверх по кривым в области перегретого пара, в области влажного пара идут параллельно изобарам, а в области
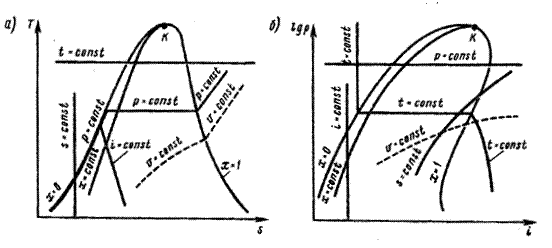 |
Рис. 1.1. Термодинамические диаграммы
жидкости почти вертикально поднимаются вверх.
Диаграмму sT используют для первоначального изучения процессов, а диаграмму ilgp - при расчетах и исследованиях.
Рассмотренные процессы кипения и конденсации называются изотермическими, так как протекают при постоянной температуре и в тепловых диаграммах изображаются изотермами в области насыщенного пара.
В холодильной технике кроме рассмотренных большую роль играют процессы, связанные с изменением состояния газа. Состояние газа, близкого к идеальному, описывается уравнением Клапейрона – Менделеева
pv/T=R
где R - газовая постоянная, Дж/(кг*К).
Полагая, что в уравнении Клапейрона - Менделеева р=const, получаем процессы при постоянном давлении, характерные для конденсаторов и испарителей. Такие процессы называются изобарическими и на тепловых диаграммах изображаются изобарами. Для газов в изобарических процессах удельный объем изменяется пропорционально абсолютной температуре, т. е. v/T =const.
Для газов в изотермических процессах, когда Т=const, произведение давления на удельный объем будет постоянным, т. е. pv=const.
При описании процессов сжатия газа и расширения жидкости часто предполагают, что они проходят без теплообмена с окружающей средой. Поэтому вся работа, совершаемая над газом, превращается во внутреннюю энергию газа. Такие процессы называются адиабатическими и в тепловых диаграммах изображаются адиабатами, т. е. протекают при постоянной энтропии.
Допустим также, что адиабатический процесс сжатия протекает настолько медленно, что в любой момент времени температура и давление газа по всему объему цилиндра будут одинаковыми. Тогда, если после медленного сжатия предоставить газу возможность медленно расширяться, то он пройдет ту же последовательность равновесных состояний, что и при сжатии. Процессы, в которых состояния газа одинаковы в обоих направлениях, называют обратимыми. К обратимым можно отнести процессы конденсации и кипения, протекающие при очень малой разности температур теплообмена. Когда теплообмен совершается при некоторой разности температур, потери неизбежны. Следует отметить, что не вся подводимая энергия при сжатии превращается во внутреннюю энергию газа, часть ее расходуется на нагрев деталей компрессора и рассеивается в окружающую среду. Поэтому, расширяясь, газ не проходит через ту же последовательность равновесных состояний, что и при сжатии. Такие процессы называются необратимыми и протекают с увеличением энтропии.
Фактически все процессы в природе необратимы. Необратимость процессов сформулирована Клаузиусом во втором законе термодинамики: теплота не может сама собой переходить от холодного тела к теплому. Поэтому, если в круговом процессе холодное рабочее тело передает теплоту более горячему, то обязательно должна затрачиваться энергия. Подобные круговые процессы называются обратными циклами в отличие от прямых, где, наоборот, тело передает теплоту более холодному, совершая работу.
Чем больше разность температур, тем интенсивней при прочих равных условиях протекает процесс теплопередачи от горячего тела к холодному. В зависимости от агрегатного состояния тел и их взаимного расположения теплота может передаваться теплопроводностью, конвекцией и лучеиспусканием.
В твердых телах теплота проводится путем передачи энергии движения соседним молекулам без механического перемещения частиц. Она характеризуется теплопроводностью, которая зависит от химической природы среды и ее состояния. Теплопроводность показывает, какое количество теплоты передается через плоскую стенку толщиной 1 м за единицу времени через площадь 1 м2 при разности температур 1 К, (Единица теплопроводности - ватт на метр-кельвин (Вт/м*К).
В жидкостях и газах передача теплоты осуществляется конвекцией, т. е. механическим перемещением частиц. При естественной конвекции, более нагретые частицы с меньшей плотностью поднимаются вверх, а охладившиеся опускаются вниз. Если этих течений оказывается недостаточно, прибегают к принудительному перемещению жидкостей и газов, т. е. принудительной конвекции. При ее отсутствии этот вид теплообмена в жидкостях и газах резко замедляется вследствие их малой теплопроводности.
Интенсивность теплообмена между жидкостью и поверхностью твердого тела характеризуется коэффициентом теплоотдачи, который показывает, какое количество теплоты передано в единицу времени через 1 м2 площади при разности температур между поверхностью и жидкостью 1 К. Единица измерения коэффициента теплоотдачи - ватт на квадратный метр-кельвин [Вт/ (M2-K)].
У нагретых тел часть энергии передают с помощью электромагнитного излучения. При попадании на другие тела она частично поглощается и превращается в тепловую. В результате двойного превращения энергии и осуществляется лучистый теплообмен.
В реальных условиях при передаче теплоты от одного тела к другому участвуют все виды теплопередачи (см. также гл. 3). Величиной, количественно характеризующей этот процесс, служит коэффициент теплопередачи, показывающий количество теплоты, переданной от одной жидкости (газа) к другой через 1 м2 площади, разделяющей стенки в единицу времени при разности температур между ними 1 К. Единица измерения коэффициента теплопередачи - ватт на квадратный метр-кельвин [Вт/(м2-К)].
Дата добавления: 2016-02-11; просмотров: 1382;
