Теория и схема кроветворения
Обеспечение кроветворения, строго адекватного запросу, возможно благодаря сложной системе его регуляции. Установлено, что более 95% всех клеток кроветворной ткани (костный мозг, селезенка, и лимфоузлы), хорошо изученных морфологически, не участвуют в постоянных регуляторных процессах, так как их гистогенез уже определен на предыдущих этапах дифференцировки. Качественная и количественная регуляция кроветворения осуществляется клетками-предшественниками гемопоэза последовательно в несколько этапов.
Прямое экспериментальное изучение этих клеток стало возможным благодаря развитию с начала 60-х годов ХХ столетия клональных методов исследования (введение смертельно облученным мышам костного мозга здоровых мышей с обнаружением через 7-10 дней в селезенке облученных животных колоний, состоящих из развивающихся кроветворных клеток). Эти и другие постоянно совершенствующиеся методы изучения кроветворных клеток, в том числе радиобиологические, иммунологические, электронномикроскопические, генетические, позволили зарубежным и отечественным исследователям накопить важные фактические данные, характеризующие кинетику клеточных популяций в процессе кроветворения. Отражением достигнутого уровня знаний явилось построение схем кроветворения, которые в отличие от предыдущих вносят уточнение в представление о ранних стадиях гемопоэза, когда морфологическое разделение клеток еще невозможно.
Наиболее признанные современные схемы кроветворения И.Л. Черткова и А.И. Воробьева (1973, 1981) и Аstaldi с соавторами (1973) исходят из представления о происхождении всех клеток крови из единого источника, что составляет сущность унитарной теории кроветворения, сформулированной в 20-е годы А.А. Максимовым и получившей в настоящее время экспериментальное подтверждение и дальнейшее развитие. Родоначальным элементом клеток крови служит полипотентная стволовая клетка (см. таблицу №2) (колониеобразующая единица в селезенке – КОЕс), способная к разнообразным дифференцировкам и обладающая свойством самоподдержания (пролиферации без видимой дифференцировки) в течение всей жизни индивидуума. В отделе стволовых клеток, число которых в кроветворной ткани менее 1%, осуществляется качественная регуляция кроветворения, т.е. снабжение его всеми видами предшественников, в том числе и лимфоцитарных. Без участия стволовых клеток отделы коммитированных (с выбранным направлением дифференцировки) предшественников, имеющих ограниченное время существования, не способны поддержать постоянно обновляющиеся популяции клеток крови в течении длительного срока. Пролиферация и дифференцировка стволовых клеток происходит только в кроветворной ткани в соседстве со стромальными клетками, создающие для них необходимое микроокружение. В настоящее время нет данных, свидетельствующих о возможности перехода стромальных клеток в стволовые гемопоэтические и поддержании таким образом непрерывного кроветворения. Напротив, показано, что стволовые клетки сами способны к безграничному самоподдержанию и признание этого факта составляет принципиальное отличие всех современных схем кроветворения от предыдущих, допускающих происхождение кроветворных клеток (гемоцитобластов) из стромальных ретикулярных клеток (гемогистобластов). Несмотря на то, что стволовая клетка, видимо, способна проделывать около 100 митозов, ее пролифиративная активность в условиях нормального кроветворения невелика; основная масса стволовых клеток находится вне клеточного цикла и лишь 10-20% их медленно пролиферирует с периодом генерации до 10 дней. Регуляция темпа пролиферации и поддержания числа стволовых клеток обеспечивается близкодействующими механизмами при участии специального индуктора микроокружения, вероятность ухода стволовых клеток в дифференцировку при стабильном кроветворении равняется примерно 50%. Имеющиеся экспериментальные данные показывают, что первый этап дифференцировки стволовых клеток, приводящий к образованию самых ранних предшественников того или иного ряда, не зависит от запроса, частота соответствующих дифференцировок стабильна и, видимо, закреплена генетически.
Таблица 2.Схема гемопоэза (по Воробьеву и И.Л. Черткову)
| Классы | |||||||||||||||||||
| I.Полипотентные |                Стволовая клетка Стволовая клетка
| ||||||||||||||||||
| I.Ограничено полипотентные |  Клетка-
предшественница Клетка-
предшественница
                            лимфопоэза лимфопоэза
|  Клетка-
предшественница Клетка-
предшественница
             миелопоэза миелопоэза
| |||||||||||||||||
| III.Унипотентные |    предшественница
Т-лимфоцитов предшественница
Т-лимфоцитов
 
| предшественница
 В-лимфоцитов В-лимфоцитов
|               КОЭ-ГМ КОЭ-ГМ
|                       КОЭ-ГЭ КОЭ-ГЭ
|               КОЭ-МГЦЭ КОЭ-МГЦЭ
| ||||||||||||||
| IV. |
Т-лимфобласт

|
 В-лимфобласт В-лимфобласт
|
 Монобласт Монобласт
|   Миелобласты Миелобласты
|
    Эритро-бласт Эритро-бласт
|  Мегакариобласт Мегакариобласт
| |||||||||||||
 Т-пролимфоцит Т-пролимфоцит
| В-пролимфоцит
 
|  Промоноцит Промоноцит
|    Промиелициты Промиелициты
|       Пронорм-оцит Пронорм-оцит
| Промегакариоцит | ||||||||||||||
Т-лимфоцит

| В-лимфоцит

|  Миелоциты Миелоциты
|  Нормо-цит Нормо-цит
   базофильный базофильный
|   Мегакарио-цит Мегакарио-цит
| |||||||||||||||
 Т-иммунобласт Т-иммунобласт
|  В-иммунобласт В-иммунобласт
|  Метамиелоциты (юные) Метамиелоциты (юные)
| Нормо-цит
  полихроматофильный полихроматофильный
| ||||||||||||||||
 Плазмобласт Плазмобласт
|  Палочкоядер-ные Палочкоядер-ные
|  Нормо-цит
оксифильный Нормо-цит
оксифильный
| |||||||||||||||||
| V.Созревающие |  Проплазмоцит Проплазмоцит
|     Ретикулоцит Ретикулоцит
| |||||||||||||||||
| VI.Зрелые | Активированный Т-лимфоцит | Плазмоцит | Моноцит | Сеггментоядер-ные
        Б Эо Н Б Эо Н
| Эритро-цит | Тромбоцит | |||||||||||||
Примечание: Б – базофилы,
Эо – эозинофилы,
Н – нейтрофилы.
Ближайшей ступенью дифференцировки стволовой клетки является класс (II) частично детерминированных полипотентных клеток-предшественников миелопоеза и лимфопоэза. Существование клетки-предшественницы миелопоеза доказано на примере ряда лейкозов, прежде всего хронического миелолейкоза, при котором приобретенный дефект генетического аппарата – появление укороченной хромосомы в 22-й паре, обнаружен в трех ростках кроветворения (гранулоцитарном, мегакариоцитарном, эритроцитарном), но не в лимфоцитарном. Точно так же исключительно в клетках этих трех ростков выявлено повреждение, наблюдаемое при пароксизмальной гемоглобинурии с постоянной гемосидеринурией – болезни Маркиафавы-Микели. Разработаны методы, позволяющие обнаружить клетку-предшественницу миелопоэза (КОЕ-ГЭММ) человека в культуре (в присутствии специального стимулятора). Частично детерминированные полипотентные клетки-предшественницы могут тормозить пролиферацию стволовых клеток и имеют ограниченные возможности к самоподдержанию (3-4 нед.)
В процессе дальнейшей дифференцировки образуются унипотентные предшественники (III класс), которые также не способны к длительному самоподдержанию, однако при прохождении через этот этап количество клеток, ушедших в дифференцировку, возрастает в десятки тысяч раз, так как на стадии унипотентных предшественников возможное число проделываемых ими митозов равняется 10-15, а доля пролиферирующих клеток составляет 60-100%. В данном отделе осуществляется основная количественная регуляция кроветворения, т. е. обеспечение необходимого количества клеток нужного типа в ответ на конкретные потребности (запрос) организма. Существуют гуморальные регуляторы кроветворения – поэтины (гормоны), один из которых, эритропоэтин, хорошо изучен. Поэтины не только вызывают дифференцировку унипотентных предшественников в морфологически распознаваемые элементы, но и определяют число митозов совершаемых в процессе дифференцировки клетками данного класса. В результате III класс поэтинчувствительных клеток-предшественниц оказался подразделенным на два подкласса – клеток, способных к дифференцировке в направлении двух ростков, и клеток, дифференцирующих лишь в одном направлении.
К этому классу отнесены следующие клетки: клетка-предшественница грануло- и моноцитопоэза (КОЕ-ГМ), способная дифференцироваться как в моноциты-макрофаги, так и гранулоциты; смешанная гранулоцитарно-эритроцитарная клетка-предшественница (КОЕ-ГЭ); мегакариоцитарно-эритроцитарная колониеобразующая единица (КОЕ-МГЦЭ); самостоятельная клетка-предшественница гранулоцитов (КОЕ-Г); отдельная клетка-предшественница моноцитопоэза (КОЕ-М); клетка-предшественница эозинофилов (КОЕ-Э); клетка-предшественница базофилов (КОЕ-Б), которая однако допускается по аналогии с предыдущей, так как пока нет метода ее выявления (предполагают существование и клетка-предшественница тучной клетки, близкой по своей гепаринопродуцирующей функции к базофилам); клетка-предшественница мегакариоцитов (КОЕ-МГЦ).
Клетки, учавствуют в эритропоэзе – это уже упоминавшаяся КОЕ-ГЭ; бурстообразующая («бурсты» – большие колонии) эритроидная единица (БОЕ-Э), зрелая и незрелая; эритроидная колониеобразующая единица (КОЕ-Э). Эритропоэз в обычных условиях проходит стадии БОЕ-Э→КОЕ-Э или КОЭ-ГЭ→БОЕ-Э→КОЕ-Э и затем стадию морфологически распознаваемых эритробластов – проэритробласт (пронормобласт), но в определенных условиях, например при напряженном эритропоэзе, может, по-видимому миновать стадии КОЕ-Э и БОЕ-Э. В настоящее время можно считать доказанным, что при повышенной потребности в отдельных клетках крови наряду с основным кроветворением происходит и параллельно шунтовое, обеспечивающее дополнительную быструю продукцию каждого из рядов кроветворения и имеющие самостоятельные клетки-предшественницы.
Перечисленные выше классы клеток, начиная со стволовых клеток и кончая унипотентными поэтинчувствительными клетками морфологическими методами не различаются, известно лишь, что все они могут находиться в двух состояниях: лимфоцитоподобном-спокойном, и бластном-активном (бласты – клетки, имеющие нежно-структурное, равномерномерноокрашенное ядро с нуклеолами и беззернистую неширокую цитоплазму).
Очередными ступенями дифференцировки клеток-предшественниц кроветворной ткани является класс (отдел) морфологически распознаваемых пролиферирующих клеток (миелобласт, пронормобласт, мегалобласт, монобласт), затем класс созревающих клеток (миелоцит, нормобласты и др.), наконец, класс зрелых клеток (эритроцит, тромбоцит, гранулоциты). В процессе дифференцировки морфологически распознаваемые клетки эритроцитарного ряда проходят 5-6 митозов, гранулоцитарного – 4 митоза, в процессе моноцитопоэза от монобласта до макрофага – 7-8 митозов, клетки мегакариоцитарного ряда проделывают 4-5 эндомитозов (деление ядер без деления всей клетки – процесс полиплоидизации). Последними клетками, способными к делению, среди гранулоцитов являются миелоциты, среди ядерных эритроидных клеток – полихроматофильные нормобласты (нормоциты), дальнейшее созревание этих клеток идет без деления. Время созревания гранулоцитов в костном мозге, по данным разных авторов, равняется 60-204 ч, генерационное время клеток красного ряда – в среднем 42-60 ч, время созревания мегакариоцидов – 120 ч (весь жизненный цикл мегакариоцитов исчисляется 10-ю днями).
В отличие от миелопоэза, сведения о котором получают из поведения клеток в различных условиях культивирования, представление о лимфопоэзе основывается главным образом на изучении антигенных клеточных маркеров (поверхностных и цитоплазматических), которые не одинаковы как для Т- и В- лимфоцитов, так и для различных стадий дифференцировки этих двух основных направлений лимфопоэза. По выявления соответствующих маркеров в настоящее время оказалось возможным идентифицировать клетки-предшественницы В-лимфоцитов (пре-В-клетки) и клетки-предшественницы Т-лимфоцитов (претимоциты), а также отдельные субпопуляции Т-лимфоцитов (супрессоры, хелперы), однако в схеме дана преимущественно морфологическая дифференцировка В- и Т-лимфоцитов. Имеется принципиальная разница в поведениии на конечных этапах дифференцировки клеток лимфоидного и миелоидного рядов. Если развитие клеток миелоидного ряда строго детерминировано вплоть до гибели, то в лимфоидном ряду под влиянием специфических индукторов (антиген) возможен переход морфологически зрелых лимфоцитов в соответствующие бластные формы (например, В-лимфоцит – В-иммунобласт – плазматические клетки). Поэтому в схеме кроветворения разделены лимфобласты и иммунобласты: лимфобласт – морфологически распознаваемый предшественник лимфоцита, иммунобласт представляет собой стадию существования активированного лимфоцита (бласттранформация, синтез ДНК), предшествующую проявлению его функциональной активности (в частности, для В-лимфоцитов – секреция иммуноглобулинов).
Все тканевые макрофаги имеют костномозговое происхождение циркулирующие в крови моноциты служат промежуточной стадией между ними и костномозговыми предшественниками. Поскольку клетки, обладающие способностью к фагоцитозу, пиноцитозу и прикреплению к стеклу, не имеют, таким образом, гистогенетической общности ни с ретикулярными клетками (фибробластами), ни с эндотелием, то систему, выполняющую в организме эту функцию, обозначают как систему фагоцитирующих мононуклеаров вместо ретикулоэндотелиальной системы – РЭС.
Таким образом, наиболее примитивная из клеток в костном мозге, которая обязательно превратится в зрелый эритроцит – пронормобласт (проэритробласт). Он развивается путем деления и дифференцировки, проходя хорошо различимые стадии: нормобласт, ретикулоцит, и ,наконец, зрелый эритроцит. Это развитие от стволовой клетки до зрелого эритроцита характеризуется следующими чертами:
§ постепенным уменьшением размера;
§ потерей ядра, и следовательно, способностью к делению;
§ потерей внутриклеточных органелл.
Последняя стадия созревания (ретикулоцита в эритроцит) происходит как в костном мозге, так и в периферической крови; обычно 1-3% циркулирующих эритроцитов являются ретикулоцитами.
В ретикулоцитах продолжается биосинтез белка (глобина), гема, пуринов, пиридиннуклеотидов, липидов, фосфатидов. Превратившись через 1-3 дня в зрелые эритроциты, они длительно циркулируют в переферической крови. Созревание ретикулоцита сопровождается существенными изменениями в обмене веществ; прекращается значительная часть синтетических процессов (синтез белка гема), почти полностью утрачивается способность к дыханию свойственная ядросодержащим эритроидным клеткам. Никаких более ранних форм эритроцитов в норме кровь не содержит.
Продолжительность жизни эритроцитов составляет около120 дней. Необходимо их постоянное обновление: каждую секунду в костном мозге воспроизводится с среднем около 2,3 млн эритроцитов. Этот процесс регулируется эритропоэтином, о котором уже говорилось выше – гормоном, который синтезируется в клетках почек. В ответ на снижение уровня кислорода в крови почка высвобождает эритропоэтин в кровоток для транспортировки его в костный мозг. Здесь эритропоэтин стимулирует воспроизводство эритроцитов. Как только количество эритроцитов повышается, содержание кислорода в крови возрастает и продукция эритропоэтина в почке снижается.
Существуют и другие регуляторы эритропоэза, в частности стимулирующим продукцию эритроцитов действием обладают андрогены, благодаря способности повышать биосинтез эритропоэтина, но также вероятно, путем непосредственного воздействия на клетки-предшественницы в костном мозге (противоположное действие на эритропоэз оказывают эстрогены, по-видимому, вследствие подавления образования эритропоэтина).
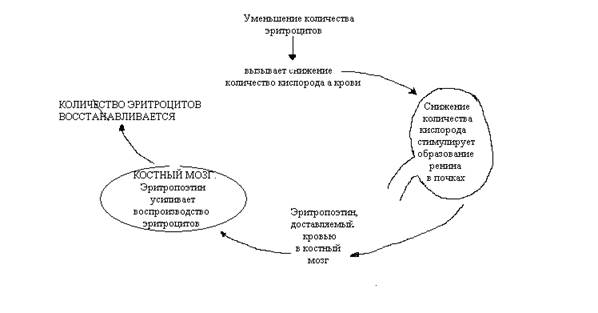
Рис. 1Схема нормального гемостаза
В условиях экспериментальной полицитемии были обнаружены ингибиторы эритропоэза: ими могут быть эритроцитарные кейлоны – клеточные регуляторные субстанции, ингибирующие митоз (пролиферацию) эритробластов.
Дата добавления: 2015-11-26; просмотров: 3566;


