Иммобилизованные ферменты. В клетках ферменты обычно находятся не в растворенном состоянии, а локализованы в органеллах клеток
В клетках ферменты обычно находятся не в растворенном состоянии, а локализованы в органеллах клеток. Это связано с тем, что ферменты являются нестабильными соединениями и при химическом воздействии могут быстро инактивироваться, они достаточно чувствительны к рН среды, температуре. Кроме того, свободные ферменты могут быть использованы лишь один раз, и цена их достаточно высока.
Поэтому актуальным является производство иммобилизированных (связанных) ферментов.
Идея создания «нерастворимых», или «связанных» ферментов, которые позднее стали называть иммобилизованными возникла еще в 1950-х годах. К ее реализации имел отношение бывший президент Израиля Э. Качальский-Катцир. Мы привыкли, что президентами становятся политики, хозяйственники, юристы. Но этот человек до своего избрания был ученым-биохимиком и после пребывания на президентском посту вернулся в науку и до своей смерти в 1995 г. возглавлял институт биотехнологии в Тель-Авиве.
Иммобилизация - это прикрепление фермента к нерастворимому носителю, причем таким образом, чтобы фермент мог обмениваться с раствором молекулами субстрата и продукта.
При этом появляется про
стая возможность отделять и многократно использовать такой иммобилизованный фермент. Кроме того, оказалось, что закрепленный фермент сохраняется в активном состоянии гораздо дольше, чем свободный, растворенный.
Методы иммобилизации ферментов
1. Адсорбция на носителе (рис. 10.А). Носителями могут быть неорганические материалы (стекло, силикагель, бентонит, оксид алюминия, диоксид титана и др.), природные полимеры (целлюлоза, коллаген) и синтетические полимеры (нейлон, полиэтилен, полипропилен).
2. Включение в гель агар-агара, альгинатов, карагинана (типа желе) (рис. 10.Б).
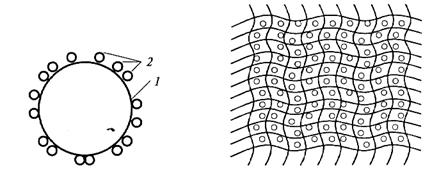
А Б
Рис. 10. Иммобилизация фермента методом адсорбции (А), методом включения в гель (Б): 1– гранула носителя; 2 – молекула фермента.
Молекулы фермента сидят в порах геля. Гель проницаем для молекул субстрата и продуктов реакции за счет молекулярной диффузии.
3. Ковалентное связывание с носителем. Носителем в этом случае является полимерный материал, длинные молекулы которого в разных местах связаны химическими ковалентными связями с молекулами фермента (рис. 11.А).
4. Поперечная «сшивка» молекул фермента при помощи бифункциональных реагентов. Молекулы фермента, свободно перемещающиеся в растворе, соединяются между собой различными своими участками с помощью определенных реагентов (рис. 11.Б).
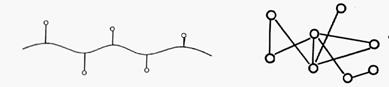
А Б
Рис. 11. Иммобилизация фермента методом ковалентного связывания с носителем (А); методом поперечной «сшивки» (Б).
Получается некое пространственное образование, включающее активные молекулы фермента и довольно большие пространства между ними, удобные для диффузии молекул субстрата и продукта реакции.
5. Адсорбция на носителе с последующей поперечной «сшивкой». Этот способ сочетает в себе способы 1 и 4.
По сравнению с обычной адсорбцией на носителе получается более глубокий слой молекул фермента, доступных для субстрата и продукта, а по сравнению с обычной «сшивкой» - более прочная гранула, имеющая жесткий остов в центре (рис. 12.А).
6. Включение в полупроницаемые капсулы. Внутри капсулы (рис. 12.Б) как бы существует коллоидный раствор фермента. Внешняя оболочка капсулы довольно прочная, непроницаема для фермента, но проницаема для продукта и субстрата.
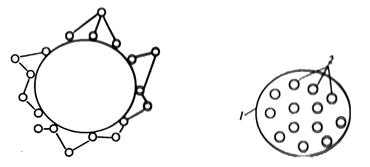
А Б
Рис. 12. Иммобилизация фермента методом адсорбции на носителе с последующей поперечной «сшивкой» (А); методом включения в полупроницаемые капсулы:1 – капсула с полупроницаемой стенкой; 2 – молекулы фермента, взвешенные в растворе внутри капсулы
7. Сополимеризация фермента и полимера-носителя. Напоминает включение в гель, но матрица создается путем сополимеризации полифункционального реагента и фермента (т.е. фермент не просто находится в «клетке» геля, но и сцеплен с ней). Этот способ является сочетанием способов 2 и 4 (рис. 13).
Примером является широко распространенный полиакриламидный гель, в котором в качестве реагента используется глутаровый альдегид.
 Рис. 13. Иммобилизация фермента
Рис. 13. Иммобилизация фермента
Дата добавления: 2016-02-09; просмотров: 1560;
