Принцип действия ферментов
Механизм действия ферментов состоит в снижении энергии активации, необходимой молекуле субстрата, чтобы вступить в реакцию. Согласно существующим теориям (промежуточных соединений, адсорбционной, цепных реакций) снижение энергии активации происходит в результате адсорбции реагирующих веществ на поверхности фермента с образованием промежуточного нестойкого соединения – фермент-субстратного комплекса, что приводит реагирующие вещества в напряженное состояние и способствует быстрому протеканию реакции. Фермент является начальным, или «запальным» фактором, в дальнейшем катализируемая им реакция протекает самостоятельно. Поэтому основная роль биокатализатора состоит в преодолении молекулами субстратов активационного барьера на более низком энергетическом уровне (рис. 9).
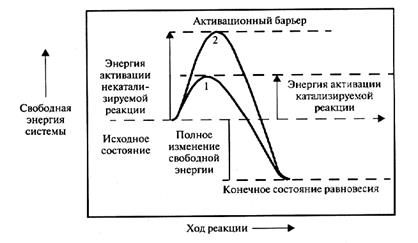
Рис. 9. Характеристика энергетического состояния катализируемой (1) и некатализируемой (2) реакции
Кроме того, в активном центре сосредоточено много неполярных групп, и эта область действует как органический растворитель. Здесь же находится небольшое число заряженных полярных боковых групп аминокислот, реакционная способность которых выше в органическом растворителе, чем в водной среде. Имея большую гибкую молекулу, ферменты способны сосредоточить на небольшом участке необходимые группы для осуществления конкретной реакции с субстратом.
У сложных ферментов, имеющих кофакторы, возможности взаимодействия с субстратом значительно увеличиваются. Соединение фермента с субстратом в каталитическом центре может происходить с помощью ковалентных связей, при участии электронов, с помощью водородных связей или более слабых взаимодействий, например сил Ван-дер-Ваальса. Причем фермент и субстрат в районе активного каталитического центра должны сблизиться до расстояния 1,5-2 нм. В этих условиях внутренние связи в молекуле субстрата ослабляются, и создается возможность для реакции с ферментом.
В водном растворе вещества реагируют только при столкновении. Если бы не было ферментов, эти столкновения были бы крайне редки. Как известно, ферменты обладают очень высокой каталитической активностью. Одна молекула фермента за 1 мин может прореагировать с тысячами и даже миллионами молекул специфического субстрата. Так, алкогольдегидрогеназа, катализирующая превращение ацетальдегида в этиловый спирт, превращает в 1 мин 4700 молекул субстрата, а фосфотриозоизомераза -500 тыс. молекул.
Для действия каждого фермента характерна оптимальная температура, при которой скорость реакции максимальна. Так, α-амилаза культуры Aspergillus oryzae имеет оптимум температуры 50-55°С. Оптимум температуры большинства используемых в биотехнологии ферментов микроорганизмов 30-40 °С. Оптимум действия одних ферментов, например пепсина, наблюдается в кислой среде (рН 2,0), других - в щелочной, а у большинства ферментов - в нейтральной.
Активаторами многих ферментов являются цистеин и глутатион. Эти вещества восстанавливают дисульфидную связь, образуя SH-группы, которые входят в состав каталитических центров и часто определяют ферментативную активность. Ингибиторы ферментов могут быть неспецифическими (например, соли тяжелых металлов, которые при связывании с белками осаждают их из растворов) или специфическими (например, синильная кислота, которая реагирует с определенными химическими группами ферментов и ингибирует железосодержащих дыхательных ферментов).
Дата добавления: 2016-02-09; просмотров: 2372;
