Второй закон термодинамики. Второй закон термодинамики определяет:
Второй закон термодинамики определяет:
- какие процессы в рассматриваемой системе при заданной температуре, давлении, концентрации и пр. могут протекать самопроизвольно, то есть без затраты работы извне;
- каково количество работы, которое может быть получено при этом;
- каков предел возможного самопроизвольного течения процесса, т.е каково состояние равновесия в данных условиях.
Второй закон термодинамики дает возможность определить, какими должны быть внешние условия, чтобы интересующий нас процесс проходил в нужном направлении и в требуемой степени.
Второй закон носит статистический характер и применим лишь к системам, состоящим из большого количества частиц, то есть к таким, поведение которых может быть выражено законами статистики.
Второй закон был изложен в работах Клаузиуса (1850 г.) и В. Томсона (1851 г.). Можно дать разные формулировки второго закона. В качестве исходного постулата можно принять одно из следующих утверждений:
- теплота не может переходить сама собой от более холодного тела к более теплому;
- невозможен процесс, единственным результатом которого было бы превращение теплоты в работу;
- невозможно построить такую машину (такой вечный двигатель второго рода), все действие которой сводилось бы к производству работы и соответствующему охлаждению теплового источника.
Энтропия
Второй закон термодинамики позволяет разделить все процессы на обратимые и необратимые. Мера необратимости процесса определяется изменением функции состояния - энтропии.
Энтропия – это термодинамическая функция, которая является функцией состояния и изменение которой для обратимого изотермического перехода теплоты равно приведенной теплоте процесса.
Обозначается энтропия буквой S.
Для обратимого изотермического перехода теплоты
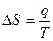
 (19)
(19)
Для обратимого изотермического перехода бесконечно малого количества теплоты:
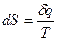 (20)
(20)
Энтропия является функцией состояния, следовательно, для перехода из состояния 1 в состояние 2 изменение энтропии определяется уравнением:
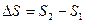 .
.
Согласно уравнению (19)
в обратимых изотермических процессах изменение энтропии равно тепловому эффекту процесса, деленному на абсолютную температуру.
Процессы, которые протекают самопроизвольно являются необратимыми процессами (например, переход теплоты от более нагретого тела к менее нагретому, переход газа из сосуда с большим давлением в сосуд с меньшим давлением).
Необратимые процессы, протекающие в изолированных системах, всегда сопровождаются возрастанием энтропии системы.
При необратимом процессе
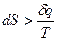 , (21)
, (21)
Это неравенство означает, что по мере самопроизвольного развития необратимого процесса его энтропия возрастает и достигает максимального значения в состоянии равновесия.
В общем случае для обратимых и необратимых процессов:
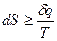 . (22)
. (22)
Величина энтропии изменяется с температурой. Энтропия вещества при любой температуре может быть рассчитана по формуле:
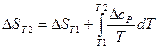 . (23)
. (23)
При протекании химических реакций изменение энтропии рассчитывается аналогично расчету теплового эффекта реакции (11) и изменению теплоемкости (17) по уравнению:
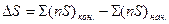 , (24)
, (24)
где n – количество молей вещества, участвующего в реакции, S – энтропия вещества при температуре реакции.
Дата добавления: 2016-02-04; просмотров: 842;
