Фрактальная размерность электронных оболочек
В [2] определена энергия электронной оболочки К, которая выражена следующим соотношением:
WK = DKWатом (2.12)
где DK — фрактальная размерность электронной оболочки К; Wатом — потенциальная энергия атома в электронвольтах (эВ), которая представлена как:
Wатом = 13,6 • Z2,
(2.13)
a Z — порядковый номер элемента в периодической таблице. Фрактальная размерность К-оболочки представлена выражением:
DK = (Z - S)1/2/(2 . lnZ).
(2.14)
Число (Z — S)l/2 называют показателем интенсивности внешних электронов, причем Z — S определяет число внешних электронов. Для второго периода элементов это число соответсвует номеру группы периодической таблицы. Фрактальная размерность зависит от количества заполненных электронных оболочек атома, и поэтому S изменяется от 2, начиная с третьего элемента (Li), до S = 9, начиная со 102-го элемента (No). Исходя из определения фрактальной размерности, данная размерность (2.14) является глобальной.
Поясним: энергия Wатом по абсолютной величине равна работе, которую нужно затратить для отделения всех электронов от атома. Зная Wатом, можем определить уровни энергий для электронных оболочек, причем по абсолютной величине энергия оболочки равна работе, которую необходимо затратить для отделения электрона от электронной оболочки. Чтобы отделить электрон от данной оболочки, прежде всего необходимо затратить работу по переносу внешних электронов на высшие энергетические уровни. Поэтому энергия оболочки зависит от числа переносимых внешних электронов.
Фрактальная размерность электронной оболочки L (с 3-го периода по 7-й включительно для элементов с 11Nа по 104Db) определяется как:
DL = (Z - 10)1/2lnn*/(5 • (3)1/2 • ln(Z/3) • ln3), (2.15)
где n — номер периода элементов в периодической таблице, а n* показывает, что n определяется как среднее геометрическое значение между номером предыдущего периода n-1 и периода расположения n для элементов, расположенных в верхних рядах больших периодов, 4, 5, 6 — большие периоды. Энергия этой оболочки для указанных элементов определяется по указанной выше формуле (2.15), т. е. путем умножения размерности оболочки, аналогично с (2.12), на Wатом = 13,6 • Z2.
Для оболочки М определены следующие выражения фрактальных размерностей:
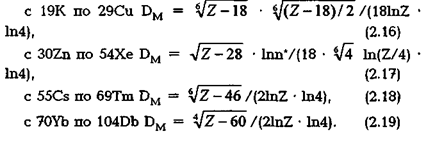
Четвертая оболочка N элементов периодической таблицы описывается следующими выражениями фрактальных размерностей:
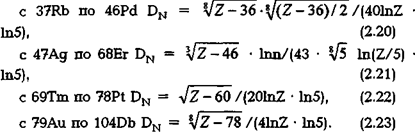
Приведем пример расчета энергетического уровня электронной оболочки L атома радона 86Rn (см. (2.15)):
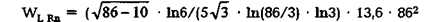
|

|
| Известное табличное значение этого уровня |
составляет 50004 эВ [46, 47]. Для электронной оболочки L атома натрия 11Na значение — 146,2 эВ, а табличное — 147,4 эВ. Подобные результаты можно получить для любого элемента, и все они с точностью до 10% соответствуют табличным.
Следует заметить, что значениям энергетических уровней должен быть присвоен отрицательный знак. От -рицательный знак появляется из-за определения нулевой энергии. Потенциальная энергия может быть определена только относительно произвольного нуля, и для атомов принято, что она равна нулю, когда электрон находится на бесконечном удалении от ядра. Отрицательно заряженный электрон притягивается положительно заряженным ядром, так что необходимо затратить энергию, чтобы переместить электрон из положения равновесия в бесконечность. Таким образом, электрон, находящийся на соответствующем уровне, имеет отрицательную энергию.
Мы уже знаем [2, 3, 9], что по абсолютной величине энергия оболочек равна работе, которую нужно затратить для перемещения электрона с электронной обо-
лочки. Поэтому для атома водорода и гелия эта работа по удалению электрона с К-оболочки совпадает с первым ионизационным потенциалом. Начиная с лития, чтобы отделить электрон с внутренней К-оболочки, необходимо сначала затратить работу по переносу внешних электронов на высшие энергетические уровни. Вследствие этого энергия К-оболочки будет меньше ионизационного потенциала номера Z-1 для данного элемента. Это особенно важно для понимания потенциальной энергии атома, которая совпадает с ионизационным потенциалом порядка Z для данного элемента. Исходя из физической сущности измерения энергии ионизации элементов, затраченная работа по удалению электрона возрастает с увеличением кратности ионизации, т. е. числа электронов, вырванных из атома. Из атома освобождается не один, а несколько электронов — в зависимости от величины ускоряющего электрического поля. Это обусловлено тем, что с увеличением энергии ионизации сначала отрывается наиболее слабо связанный первый электрон, затем второй, третий и т. д. и образуется многозарядный положительный ион. Поэтому номер ионизационного потенциала указывает кратность ионизации. Вот почему ионизационный потенциал порядка Z равен работе, которую нужно затратить для отделения всех электронов от атома.
Потенциальная энергия атома для всех элементов периодической таблицы определена как Wатом = 13,6 . Z2 (см. (2.13)) и явилась фундаментом для определения энергий электронных оболочек. Мы помним, что по определению эта энергия равна работе, которую нужно затратить для отделения всех электронов от атома. Правомерность данных положений доказана рекомендованными экспериментальными данными [46, 47], основанными на спектроскопических и других наблюдениях. Однако во всей научной литературе по вопросу кратной ионизации имеется неясность и неопределенность, и поэтому его трактуют, к примеру, так: «Вторая
энергия ионизации определяется как энергия, необходимая для переноса в бесконечность электрона из однократно заряженного иона...» [48]. Это коснулось и русской научной литературы [49]: «Для отрыва обоих электронов от атома гелия достаточно энергии 79 эВ...». В действительности для отрыва двух электронов достаточно 54,4 зВ, ибо второй ионизационный потенциал для атома равен этой величине и определяет работу по отрыву двух электронов от атома гелия.
Дата добавления: 2016-02-02; просмотров: 690;
