МЕТОД РІВНОВАЖНОГО ДІАЛІЗУ
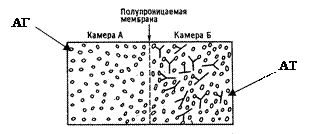
Суть методу полягає в тому, що антиген вносять у дві камери, розділені напівпроникною мембраною (а) Між ними встановлюється концентраційна рівновага (досить довготривалий процес –до 24 год). Це один із недоліків методу, також треба враховувати неспецифічну сорбцію на поверхні мембрани.
 |
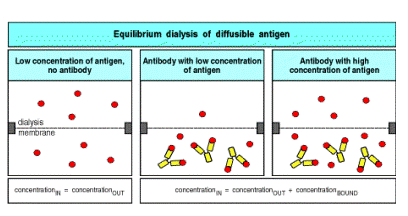
За відсутності антитіл, ліганд, доданий в камеру В, проникає через мембрану у камеру А, таким чином встановлюється рівновага (рис. 6.2 а).
За умови експерименту проводили внесення антитіл до камери А, а радіоактивно мічені антигени, які є достатньо малими для можливого проникнення через мембрану, до камери В. Ініціюється переніс вільного антигену із камери В в камеру А і встановлюється рівновага.
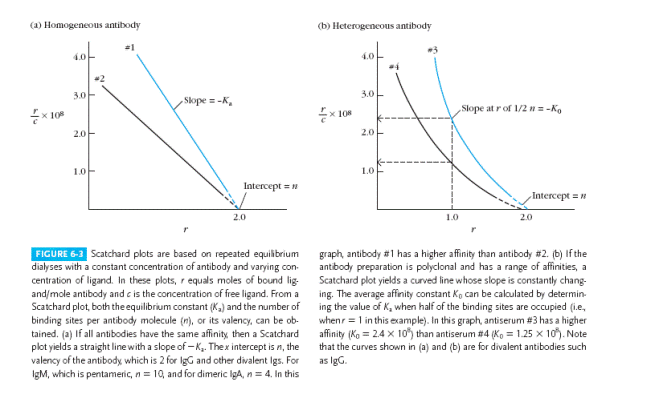
В цьому випадку антигени, проникаючи у камеру А, зв’язуються з активними центрами антитіл, в той час як незв’язані ліганди рівномірно розподіляються між обома камерами. Отже, загальна концентрація антигена буде вищою у камері А (рис.б), а різниця між концентраціями антигена в обох камерах після встановлення рівноваги і є величиною В з рівняння Скетчерда= концентрація антигена, зв’язаного з антитілами [АГ·АТ]. Величина незв’язаного антигена в обох камерах –це (F ). При тому, що концентрація антитіл в камері є відомою , можна визначити κа : κа = В/ F · (n –B).
Самі значення В і Fможна оцінити шляхом повтору методу рівноважного діалізу з однаковою концентрацією антитіл, але з різними концентраціями антигенів (дописати з паперового варіанту).
Суттєвим недоліком методу є те, що він використовується лише для визначення концентрації низькомолекулярних антигенів (гаптенів), які вільно проникають через мембрану. Саме таким чином було вперше розраховано Кa для мієломних антитіл.
 | |||||
 | |||||
 |
Флуоресцентні методи, зокрема метод гасіння флуоресценції, використовують тоді, коли зв'язування антигена змінює оптичні параметри антитіл, наприклад, гасить флуоресценцію залишків триптофану в активному центрі. Для білків це спостерігається при Е збудження 280 нм, а Е емісії- 330-360 нм. Кожному значенню концентрації антигену відповідає своє значення флуоресценції і можна розрахувати концентрації вільного і зв'язаного антигену. Переваги- простота і швидкість (до 30 хв), недоліки-тільки чисті АТ і строгі вимоги до структури досліджуваних антигенів.
Таким чином, у представлених вище методах, вимірявши концентрацію вільного і розрахувавши (вимірявши) концентрацію зв’язаного антигену у декількох точках титрування антитіл антигеном, будують графік Скетчарда згідно із рівнянням Скетчарда та визначають як Ка ,так і розраховують навіть концентрацію антитіл.
Аналізуючи взаємодію АГ-АТ треба обов’язково зазначити:
1) Оптимальна концентрація солей для таких реакцій є 0.85%, а іонна сила розчинів – 0.1-0.5. Значне підвищення концентрації солей приводить до розпаду комплексів АГ- АТ, так 15% розчин NaCl використовують для отримання компонентів реакції у вільному стані.
2) Сила зв’язування не порушуються за значень рН в інтервалі 6.4-8.6. При зміні рН вище 9.0, чи нижче 5.0 відбувається зсув реакції в сторону дисоціації комплексів, що також використовують при елюції антитіл чи антигенів.
3) Оптимальною для взаємодії температурою є 370С, проте утворення комплексів АГ-АТ відбувається досить ефективно і при більш низьких температурах. Наприклад, реакції аглютинації (для первинного тестування) ставлять при кімнатній (18-200С) температурі. Підвищення температури до 40 0С не впливає на ефективність взаємодії, проте вже підвищення до 600С стимулює розпад комплексів. Вважають, що температурний параметр реакції більше залежить від антитіл, ніж від антигенів, оскільки у ссавців виявлено ходові антитіла, які взаємодіють з антигенами тільки при температурі нижче 370С та можуть бути причиною розвитку гемолітичної анемії, якщо є аутоантитілами.
4) При постановці реакцій АГ-АТ in vitro видимі результати виявляються не відразу, а через певний проміжок часу. Тому реакцію АГ-АТ умовно поділяють на дві частини – фазу взаємодії та фазу проявлення. Умовність цього поділу полягає в тому, що власне взаємодія між пара- топом АТ та епітопом АГ є досить швидким процесом, проте до кінця фази проявлення може пройти від кількох хвилин до декількох діб.
Методи визначення Кa є частиною великої групи методів вивчення взаємодії антигену з антитілом, які використовуються також для визначення присутності і кількості антигенів і антитіл у біологічних сумішах. Вони необхідні, наприклад, для діагностики різних фізіологічних станів організму. Так, діагностика вагітності - це часто визначення трофобласт-специфічного глобуліну у крові чи сечі жінки. Діагностика багатьох ендокринних порушень потребує точного визначення рівня того чи іншого гормону. При інфаркті міокарду однією із найбільш ранніх ознак некротичного процесу, що відбувається, є поява в крові міоглобіну серцевого м'язу, рівень якого корелює із об'ємом ураження. Використання для цього саме імунохімічних методів є переважним, оскільки вони базуються на високій специфічності взаємодії антиген-антитіло. Використання моноклональних антитіл дозволило максимально стандартизувати ці методи, зробити їх надійними та відтворюваними. З іншого боку, визначення антитіл у сироватках чи інших біологічних рідинах теж часто є необхідним, наприклад, для оцінки успішності вакцинації. Визначення антитіл проти віруса СНІДу є головним діагностичним тестом на зараження цим вірусом. Таким чином, визначення антигенів та антитіл часто є необхідним у клінічній практиці. Воно потребує дуже чутливих методів, тому що більшість гормонів, ростових факторів та антитіл знаходяться в організмі у слідових кількостях. Саме тому в останні десятиріччя багато уваги приділялося розробці чутливих методів кількісного та якісного визначення антигенів і антитіл.
Дата добавления: 2016-02-02; просмотров: 722;
