Объединенное выражение Iи II— закона термодинамики
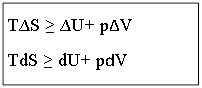
ЭНТРОПИЯ, КАК КРИТЕРИЙ НАПРАВЛЕННОСТИ
САМОПРОИЗВОЛЬНЫХ ПРОЦЕССОВ.
Рассмотрим изолированную систему.
В изолированной системе : Q= 0
Обратимый процесс: 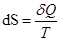 ,
, 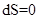 .
.
Необратимый процесс: 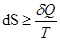 ,
, 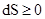 .
.
В изолированной системе все самопроизвольные процессы идут в направлении увеличения энтропии системы, и пределом процесса является max. и постоянное значение энтропии.
В неизолированных системах энтропия может возрастать, убывать и быть постоянной, поэтому не является критерием направленности протекания самопроизвольных процессов.
ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА
TdS≥dU+pdV; dU- TdS+pdV=0.
1. Энергия Гельмгольца (Т=const, V=const)
При V=const: dU- TdS≤0
dU- TdS - SdT≤- SdT
dU- d(TS) ≤- SdT
При Т=const: dU- d(TS) ≤ 0;
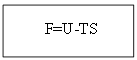
dF≤ 0.
При постоянном объеме и температуре все самопроизвольные процессы идут в сторону уменьшения энергии Гельмгольца до её постоянного min-ого значения.
2. Энергия Гиббса (Т=const, Р=const)
dU–TdS+pdV-SdT+Vdp≤ -SdT+Vdp;
(Т=const, V=const)
d(U–TS+pV)≤ -SdT+Vdp;
d(U–TS+pV)≤0
dG≤0
G=U-TS+pV;

При постоянном давлении и температуре все самопроизвольные процессы идут в сторону уменьшения энергии Гиббса до его постоянного min-ого значения.
Физический смысл:
1. ∆F
δW=TdS-dU —обратимый процесс.
δW= -dF
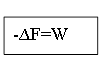
Убыл энергии Гельмгольца равна max работе процесса.
1) ∆G
W=W’+ p∆V
W’=W — p∆V
δW’= δW— p∆V
δW’= TdS – dU- pdV(обр)
δW’= -dG
Полезная работа:
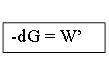
Убыл энергии Гиббса равна max полезной работе процесса.
ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ,
КАК КРИТЕРИЙ САМОПРОИЗВОЛЬНОГО ПРОЦЕССА
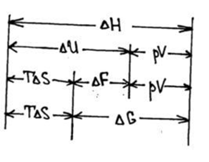
1. G = U–TS+pV;
2. F = U-TS;
3. H= U+pV;
4. dU≤ TdS-pdV.
1) dG = dU–TdS –SdT+pdV+Vdp;
dG ≤ TdS- pdV - TdS –SdT +pdV+Vdp;
dG = –SdT+Vdp;
T=const; P= const.
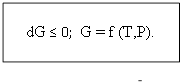
dG ≤ 0; G = f (T,P).
2) dF = dU–TdS –SdT;
dF ≤ TdS-pdV–TdS –SdT;
dF ≤ -pdV–SdT;
V=const; T= const.
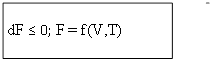
dF ≤ 0; F = f(V,T)
3) dH = dU+pdV+Vdp;
dH ≤ TdS-pdV +pdV+Vdp;
dH ≤ TdS+Vdp;
S=const; P= const

dH ≤ 0; H= f (S,P).
4) dU≤ TdS-pdV;
S=const; P= const
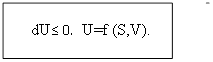
dU≤ 0. U=f (S,V).
ТЕРМОДИНАМИЧЕСКИЕ ХАРАКТЕРИСТИЧЕСКИЕ ФУНКЦИИ
Это функции, с помощью которых или их частных производных можно выразить в явном виде параметры состояния.
1. G = f (T,P);
2. F = f(V,T);
3. H= f (S,P);
4. U=f (S, V).
1) 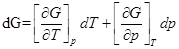 ;
;
dG = –SdT+Vdp;
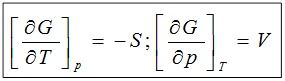
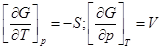
2) 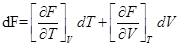 ;
;
dF = -pdV–SdT;
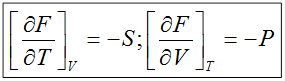
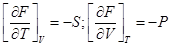
3) 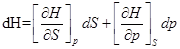 ;
;
dH = TdS+Vdp;
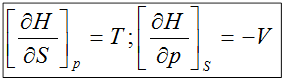
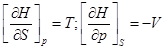
4) 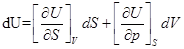 ;
;
dU≤ TdS-pdV;
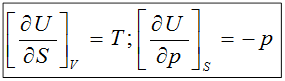
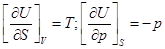
Функции энергии Гиббса, Гельмгольца, энтальпия и внутренней энерги являются характеристическими.
Поясним их смысл:
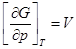
V= 0; p↑;G↑.
2. 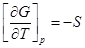
S˃0; -S˂0
T↑G↓
УРАВНЕНИЕ ГИББСА—ГЕЛЬМГОЛЬЦА
G=H-TS; F=U-TS.
Подставим вместо энтропии ее значение через частную производную энерги Гиббса и Гельмгольца:
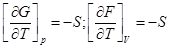
Тогда, уравнение Гиббса-Гельмгольца для системы:
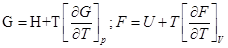
Уравнение Гиббса-Гельмгольца для процесса:
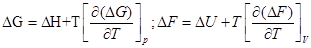
Эти уравнения показывают изменение энергии Гиббса и Гельмгольца при изменении температуры, также они связывают энергию Гельмгольца с тепловыми эффектами процесса(∆U и ∆F). При этом энтропия в явном виде не используется.
ХИМИЧЕСКИЙ ПОНЕНЦИАЛ
2CO+O2=2CO2
∑μidni=∑μidn;
dG = –SdT+Vdp, G = f (T,P)—уравнение справедливо, если система является закрытой и в ней не идет химическая реакция (состав системы не меняется).
Энергия множества переменных (компонентов), которые рассматриваются как независимые переменные: G =f (T,P,n1,n2,n3…ni).
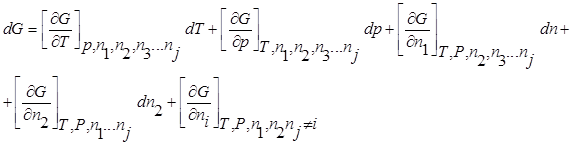
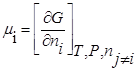
Химическим потенциалом данного компонента называется частная производная соответствующей термодинамической функции по числу молей данного компонента при условии постоянства параметров, функцией которых данная термодинамическая функция является.
Химический потенциал — это есть изменение энергии Гиббса (или любой другой термодинамической функции) при введении в большой энергии системы 1 моля данного вещества.
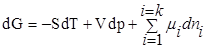 ,где к— число компонентов.
,где к— число компонентов.
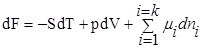
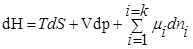
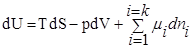
При T=const, P=const
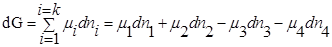 ,
,
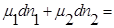
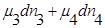
где 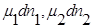 — продукт, а
— продукт, а 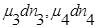 — исходные вещества.
— исходные вещества.
Для индивидуального вещества химический потенциал равен соотвественно термодинамической функции (в частности энергии Гиббса).
Химический потенциал компонента тождественен мольной энергии Гиббса. Для определения мольной энергии Гиббса i-ого компонента в условиях, отличных от стандартных, можно воспользоваться соотношением, которое справедливо для идеальных газов G i не зависит от вида и концентрации других компонентов:
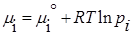 - (для газов)
- (для газов)
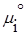 — стандартный химический поненциал; Pi — парциальное давление данного компонента.
— стандартный химический поненциал; Pi — парциальное давление данного компонента.
Т =298К, Р= 1атм, R=8,314 Дж/(моль*К),
Парциальное давление — это объем одного газа, который занимал бы вес объём данного газа. ∑pi=p
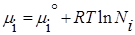 , где
, где 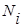 — мольная доля компонентов в растворе.
— мольная доля компонентов в растворе.
Дата добавления: 2016-02-02; просмотров: 1877;
