Подтверждение заявленной чувствительности ЛАЛ-реактива
Анализ проводят для каждой новой серии используемого ЛАЛ-реактива, а также при изменении условий эксперимента, используемых материалов и реактивов, способных повлиять на результаты теста.
Процедура испытания. Для проведения анализа готовят растворы C и D по схеме, приведенной в табл. 1.
Таблица 1 - Схема эксперимента «Подтверждение заявленной чувствительности ЛАЛ-реактива»
| Раствор | Исходный раствор | Растворитель | Фактор разведения | Конечная концентрация КСЭ в испытуемом растворе | Количество повторностей |
| С | Раствор КСЭ в воде для ЛАЛ-теста с концентрацией 2l | Вода для ЛАЛ-теста | 2l 1l 0,5l 0,25l | ||
| D | Вода для ЛАЛ-теста | ─ | ─ | ─ |
Растворы С – серия разведений КСЭ в воде для ЛАЛ-теста (проверка чувствительности ЛАЛ-реактива);
Раствор D – вода для ЛАЛ-теста (отрицательный контроль).
Опыт проводят, как описано в разделе «Процедура анализа».
Результаты и интерпретация. Анализ считают достоверным, если:
- для раствора D (отрицательный контроль) во всех повторностях получены отрицательные результаты;
- для раствора С с концентрацией 2l, получены положительные результаты;
- для раствора С с концентрацией 0,25l, получены отрицательные результаты.
Конечной точкой реакции для каждой из повторностей раствора С является положительный результат, полученный для раствора с наименьшей концентрацией КСЭ. По этим результатам рассчитывается среднее геометрическое значение чувствительности ЛАЛ-реактива по следующей формуле:
| Среднее геометрическое значение концентраций КСЭ в конечной точке Реакции | = | antilog ( 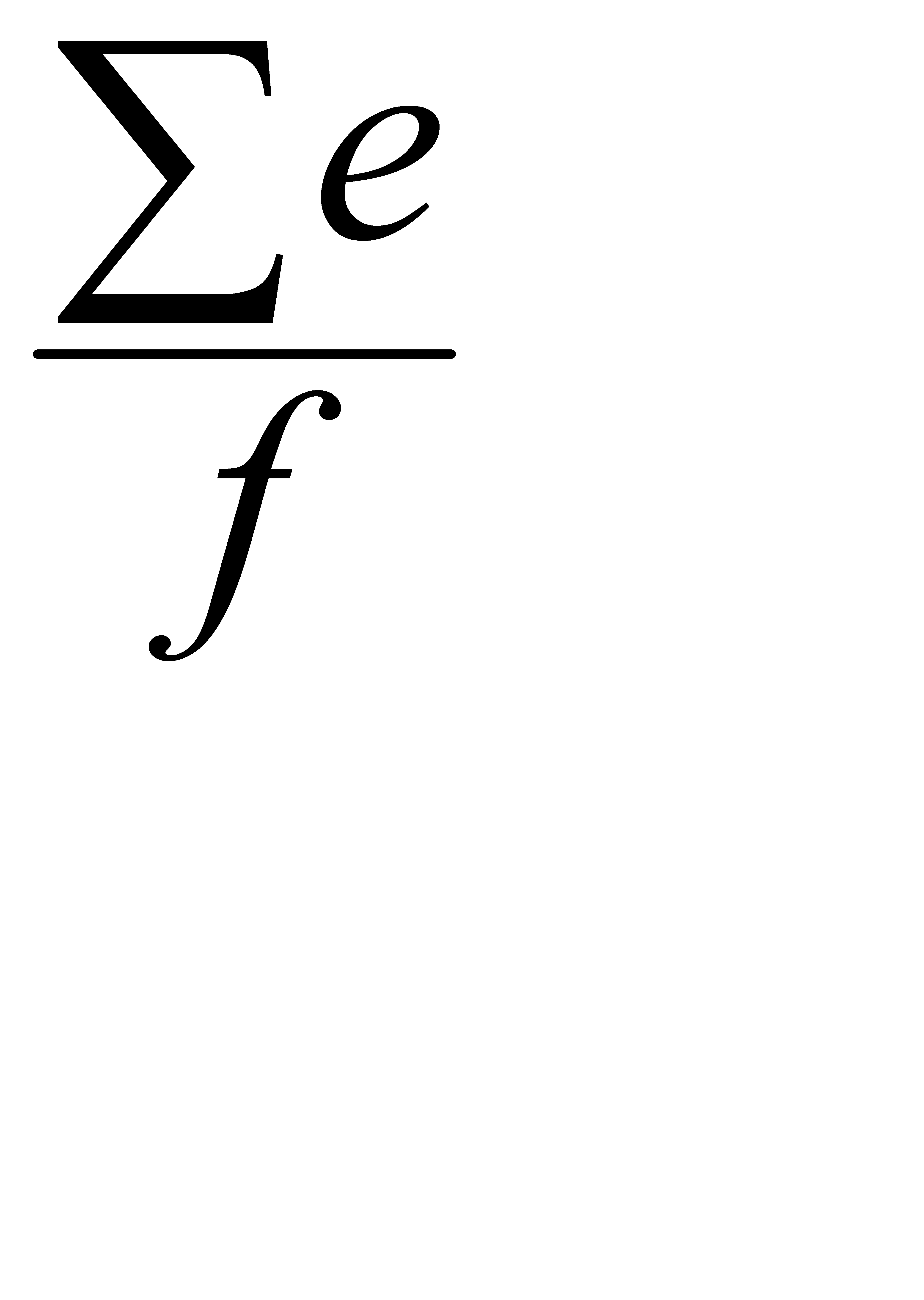 ), ),
|
где:  e – сумма логарифмов концентраций КСЭ в конечной точке реакции в каждой из повторностей;
e – сумма логарифмов концентраций КСЭ в конечной точке реакции в каждой из повторностей;
f – число повторностей.
Заявленная чувствительность ЛАЛ-реактива считается подтвержденной и используется в дальнейших расчетах в том случае, если полученное в эксперименте значение чувствительности ЛАЛ-реактива, не менее 0,5l и не более 2l.
Мешающие факторы
Испытуемое лекарственное средство может содержать мешающие факторы, усиливающие и/или ингибирующие реакцию ЛАЛ-реактива с бактериальными эндотоксинами. Обнаружить эти явления можно, сравнив способность используемого ЛАЛ-реактива реагировать с раствором КСЭ в воде для ЛАЛ-теста и в растворе испытуемого лекарственного средства в стандартных условиях проведения эксперимента.
Испытанию может быть подвергнуто лекарственное средство в любом разведении, не превышающем значения МДР. Используемые в данном анализе пробы испытуемого лекарственного средства (или его разведения) не должны содержать бактериальных эндотоксинов в определяемых в тесте количествах.
Процедура испытания. Для проведения анализа готовят растворы А – D по схеме, приведенной в Таблице 2.
Раствор А – испытуемое лекарственное средство в выбранном разведении (контроль отсутствия бактериальных эндотоксинов);
Растворы В – серия разведений КСЭ в растворе испытуемого лекарственного средства (выявление возможности ингибирования или усиления реакции);
Растворы С – серия разведений КСЭ в воде для ЛАЛ-теста (положительный контроль);
Раствор D – вода для ЛАЛ-теста (отрицательный контроль).
Таблица 2 - Схема эксперимента «Мешающие факторы»
| Раствор | Исходный раствор | Растворитель | Фактор разведения | Конечная концентрация эндотоксина в испытуемом растворе | Количество повторностей |
| A | Испытуемое лекарственное средство | ─ | ─ | ─ | |
| B | Испытуемое лекарственное средство, содержащее КСЭ в концентрации 2l | Испытуемое лекарственное средство | 2l 1l 0,5l 0,25l | ||
| С | Раствор КСЭ в воде для ЛАЛ-теста с концентрацией 2l | Вода для ЛАЛ-теста | 2l 1l 0,5l 0,25l | ||
| D | Вода для ЛАЛ-теста | ─ | ─ | ─ |
Опыт проводят, как описано в разделе «Процедура анализа».
Результаты и интерпретация. Результаты эксперимента считаются достоверными, если:
– для растворов А и D получены отрицательные результаты во всех повторностях;
– для растворов С (положительный контроль) среднее геометрическое значение концентрации бактериальных эндотоксинов составляет не менее 0,5l и не более 2l.
По результатам, полученным для каждой из повторностей растворов В, рассчитывают среднее геометрическое значение чувствительности ЛАЛ-реактива. Расчет проводят, как описано в разделе «Подтверждение заявленной чувствительности ЛАЛ-реактива». Если полученное среднее значение оказалось не менее 0,5lи не более 2l, считают доказанным, что испытуемое лекарственное средство в выбранном разведении не содержит мешающих факторов, способных ингибировать и/или усиливать реакцию ЛАЛ-реактива с бактериальными эндотоксинами и оно может быть подвергнуто анализу на содержание бактериальных эндотоксинов.
Если обнаружено присутствие мешающих факторов для испытуемого лекарственного средства, которое проверялось в разведении, меньшем МДР, анализ повторяют в большем разведении, вплоть до разведения, равного МДР. В большинстве случаев дополнительное разведение испытуемого лекарственного средства способно устранить действие мешающих факторов. Использование ЛАЛ-реактива большей чувствительности позволяет увеличить степень разведения.
Действие мешающих факторов может быть преодолено соответствующей подготовкой образца, например, фильтрацией, нейтрализацией, диализом или температурной обработкой. Выбранный способ удаления мешающих факторов не должен изменять концентрацию бактериальных эндотоксинов в испытуемом лекарственном средстве, поэтому к раствору испытуемого лекарственного средства КСЭ известной концентрации добавляют перед проведением такой обработки, после чего проводят анализ «Мешающие факторы». Если после обработки выбранным способом результаты анализа окажутся удовлетворительными, то испытуемое лекарственное средство может быть подвергнуто анализу на содержание бактериальных эндотоксинов.
Если испытуемое лекарственное средство нельзя освободить от мешающих факторов, оно не может быть исследовано на предмет содержания бактериальных эндотоксинов с помощью ЛАЛ-теста.
КАЧЕСТВЕННЫЙ АНАЛИЗ (Метод А)
Задачей этого анализа является подтверждение того, что содержание бактериальных эндотоксинов в испытуемом образце не превышает значения предельного содержания бактериальных эндотоксинов, указанного в фармакопейной статье.
Процедура испытания.Для проведения анализа готовят Растворы А – D по схеме, приведенной в табл. 3.
Раствор А – испытуемое лекарственное средство в разведении, в котором отсутствуют мешающие факторы, или в большем разведении, не превышающем МДР;
Раствор В – испытуемое лекарственное средство в выбранном разведении, к которому добавлен КСЭ. Конечная концентрация эндотоксина в анализируемом растворе должна составлять 2l (положительный контроль испытуемого образца).
Раствор С – раствор КСЭ в воде для ЛАЛ-теста с конечной концентрацией 2l (положительный контроль).
Раствор D – вода для ЛАЛ-теста (отрицательный контроль).
Анализ проводят, как описано в разделе «Процедура анализа».
Таблица 3 -Схема эксперимента «Качественный анализ»
| Раствор | Исходный раствор | Конечная концентрация эндотоксина (КСЭ) в испытуемом растворе | Количество повторностей |
| А | Испытуемое лекарственное средство | ─ | |
| В | Испытуемое лекарственное средство, содержащее КСЭ в концентрации 2l | 2l | |
| С | Раствор КСЭ в воде для ЛАЛ-теста с концентрацией 2l | 2l | |
| D | Вода для ЛАЛ-теста | ─ |
Результаты и интерпретация. Анализ считают достоверным, если:
– для раствора D (отрицательный контроль) получены отрицательные результаты в обеих повторностях,
– для раствора С (положительный контроль) во всех повторностях получены положительные результаты,
– для раствора В (положительный контроль испытуемого образца) в обеих повторностях получены положительные результаты.
Если для раствора А в двух повторностях получены отрицательные результаты, лекарственное средство считают выдержавшим испытания.
Если для испытуемого лекарственного средства в разведении, меньшем МДР, в двух повторностях получены положительные результаты, анализ следует повторить в большем разведении или в разведении, равном МДР.
Если для испытуемого лекарственного средства в разведении, равном МДР, в двух повторностях получены положительные результаты, то лекарственное средство не соответствует требованиям раздела «Бактериальные эндотоксины» фармакопейной статьи.
Если положительный результат получен в одной из повторностей для раствора А, то проводят повторный анализ. Лекарственное средство считается выдержавшим испытания, если в повторном анализе для двух повторностей получены отрицательные результаты.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ (Метод В)
Этим методом определяют содержание бактериальных эндотоксинов с помощью ряда последовательных разведений испытуемого лекарственного средства.
Процедура испытания. Для проведения анализа готовят Растворы A – D по схеме, приведенной в табл. 4.
Растворы А – разведения испытуемого лекарственного средства, начиная с того разведения, в котором отсутствуют мешающие факторы, до наибольшего разведения, не превышающего МДР.
Раствор В – наименьшее разведение из серии разведений раствора А, к которому добавлен раствор КСЭ. Конечная концентрация эндотоксина в анализируемом растворе должна составлять 2l (положительный контроль испытуемого образца).
Растворы С – серия разведений КСЭ в воде для ЛАЛ-теста (положительный контроль).
Раствор D – вода для ЛАЛ-теста (отрицательный контроль).
Анализ проводят, как описано в разделе «Процедура анализа».
Таблица 4- Схема эксперимента «Количественный анализ»
| Раствор | Исходный раствор | Растворитель | Фактор разведения | Конечная концентрация КСЭ в испытуемом растворе | Количество повторностей |
| А | Испытуемое лекарственное средство | Вода для ЛАЛ-теста | и т.д. до МДР | ─ ─ ─ ─ | |
| В | Испытуемое лекарственное средство, содержащее КСЭ в концентрации 2l | Испытуемое лекарственное средство | 2l | ||
| С | Раствор КСЭ в воде для ЛАЛ-теста с концентрацией 2l | Вода для ЛАЛ-теста | 2l 1l 0,5l 0,25l | ||
| D | Вода для ЛАЛ-теста | ─ | ─ | ─ |
Результаты и интерпретация.Анализ считают достоверным, если:
– для раствора D (отрицательный контроль) получены отрицательные результаты в двух повторностях,
– для растворов С (положительный контроль) среднее геометрическое значение концентрации бактериальных эндотоксинов составляет не менее 0,5l и не более 2l.
– для раствора В (положительный контроль испытуемого образца) получены положительные результаты в двух повторностях,
Для растворов А конечной точкой реакции является положительный результат, полученный для наибольшего разведения испытуемого лекарственного средства.
Значение произведения фактора этого разведения на величину чувствительности ЛАЛ-реактива (l) равно концентрации эндотоксина в растворе А, полученной для данной повторности. Среднее геометрическое значение концентрации эндотоксина рассчитывают, как описано в разделе «Подтверждение заявленной чувствительности ЛАЛ-реактива».
Если во всех повторностях серии растворов А получены отрицательные результаты, то концентрация бактериальных эндотоксинов в испытуемом лекарственном средстве меньше величины произведения чувствительности ЛАЛ-реактива и наименьшего фактора разведения. Если во всех повторностях серии растворов А получены положительные результаты, то концентрация бактериальных эндотоксинов в испытуемом лекарственном средстве больше величины произведения чувствительности ЛАЛ-реактива и наибольшего фактора разведения.
Лекарственное средство считают выдержавшим испытание, если определенное в эксперименте среднее значение содержания бактериальных эндотоксинов менее значения предельного содержания бактериальных эндотоксинов, указанного в фармакопейной статье.
Дата добавления: 2016-01-30; просмотров: 1754;
