Мицеллярная электрокинетическая хроматография
В мицеллярной электрокинетической хроматографии разделение осуществляется в растворе электролита, содержащего поверхностно-активное вещество в концентрации выше критической концентрации мицеллообразования. Молекулы растворенного вещества распределяются между буферным раствором и псевдостационарной фазой, состоящей из мицелл. Этот метод может использоваться для разделения как заряженных, так и нейтральных молекул. В качестве анионного поверхностно-активного вещества наиболее часто используется додецилсульфат натрия, в качестве катионного – соли цетилтриметиламмония.
При нейтральных и щелочных значениях рН возникает сильный электроосмотический поток, который движет ионы разделяющего буфера в сторону катода. При использовании в качестве поверхностно-активного вещества додецилсульфата натрия электрофоретическое движение анионных мицелл направлено в противоположную сторону – к аноду. В результате суммарная скорость движения мицелл снижена по сравнению с основным потоком раствора электролита. В случае нейтральных веществ скорость движения компонента, не имеющего электрофоретической подвижности, зависит только от его коэффициента распределения между мицеллой и водной средой. На электрофореграмме сначала появляется пик маркера электроосмотического потока, затем пики аналитов, и в конце – пик маркера мицелл. Время между первым и последним пиком называется окном разделения. На движение заряженных веществ влияют как их коэффициенты распределения между мицеллой и водным буферным раствором, так и их собственная электрофоретическая подвижность.
Движение аналитов и разрешение может быть описано термином «фактор удерживания (k)», представляющим собой отношение молярных долей аналита в мицелле и в подвижной фазе. Для нейтрального вещества k вычисляют по формуле: 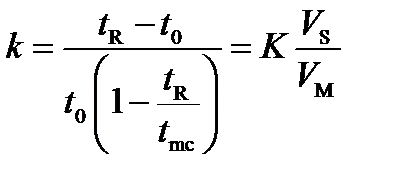 , (10)
, (10)
где tR – время миграции аналита;
t0 – время миграции неудерживаемого вещества;
tmc – время миграции мицеллы;
K – коэффициент распределения аналита;
VS – объем мицеллярной фазы;
VM – объем подвижной фазы.
Разрешение для двух близко движущихся аналитов (RS) рассчитывают по формуле:
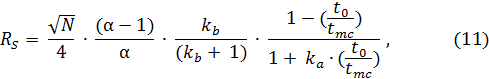
где N – число теоретических тарелок для одного из аналитов;
a– селективность разделения;
ka и kb– коэффициенты удерживания обоих аналитов соответственно
(kb > ka).
Время разделения обратно пропорционально приложенному напряжению, однако следует учитывать, что увеличение напряжения может вызвать избыточное выделение тепла, приводящее к возникновению градиентов температуры и вязкости буферного раствора. Этот эффект вызывает уширение полос и уменьшение разрешения.
Как и в капиллярном зонном электрофорезе, при мицеллярной электрокинетической хроматографии длина и внутренний диаметр капилляра влияют на время анализа и эффективность разделения. Увеличение длины капилляра уменьшает электрическое поле, увеличивает время миграции и повышает эффективность разделения. Уменьшение внутреннего диаметра повышает рассеяние тепла и увеличивает разрешение.
Величина рН среды влияет на электроосмотический поток в немодифицированных капиллярах. Уменьшение рН снижает электроосмотический поток и вследствие этого увеличивает разрешение нейтральных веществ в мицеллярной электрокинетической хроматографии за счет увеличения времени анализа.
Для улучшения разделения гидрофобных веществ в мицеллярной электрокинетической хроматографии используют органические модификаторы (метанол, пропанол, ацетонитрил и др.). При этом необходимо учитывать, что добавление органического модификатора влияет на критическую концентрацию мицеллообразования.
Для разделения с помощью мицеллярной электрокинетической хроматографии энантиомеров в мицеллярную систему включают хиральные селекторы: ковалентно связанные с поверхностно-активным веществом (соли N-додеканоил-L-аминокислот, соли желчных кислот и др.) или вводимые в состав электролита (циклодекстрины).
Для улучшения селективности разделения в мицеллярной электрокинетической хроматографии применяют также вещества, способные изменить взаимодействие аналита с мицеллой путем адсорбции на последней. Этими добавками могут быть второе поверхностно-активное вещество (ионное или неионное), ведущее к образованию смешанных мицелл, катионы металлов, которые распределяются в мицелле и образуют координационные комплексы с аналитом, а также ион-парные соединения, которые взаимодействуют с заряженными компонентами пробы и задерживают их, например, тетрабутиламмония бромид.
Капиллярный гель-электрофорез
В капиллярном гель-электрофорезе разделение происходит внутри капилляра, заполненного гелем, действующим в качестве молекулярного сита. При равном отношении заряда к массе более мелкие компоненты движутся в капилляре быстрее, чем более крупные. Капиллярный гель-электрофорез может быть использован для разделения биологических макромолекул по их молекулярной массе. Электроосмотический поток при этом полностью устраняется путем модификации внутренней стенки капилляра.
В капиллярном гель-электрофорезе используются два типа гелей: химически модифицированные и динамически модифицированные. Химически модифицированные гели, как, например, поперечно-сшитый полиакриламид, поливинилпирролидон, готовятся внутри капилляра посредством полимеризации мономеров. Они обычно связаны с кварцевой стенкой капилляра и не могут быть удалены без его разрушения. При использовании таких гелей для анализа белков в редуцирующих условиях буферный раствор содержит обычно додецилсульфат натрия и образцы перед вводом денатурируют нагреванием в смеси додецилсульфата натрия с 2-меркаптоэтанолом или дитиотрейтолом. При анализе в нередуцирующих условиях 2-меркаптоэтанол и дитиотрейтол не используют. Разделение в поперечно сшитых гелях оптимизируют модификацией буферного раствора (как указано в разделе «Капиллярный зонный электрофорез») и контролем пористости геля во время его приготовления. Пористость этих гелей регулируют изменением концентрации акриламида, а также его соотношения со сшивающим реагентом. Уменьшение пористости геля ведет к уменьшению подвижности аналитов. Из-за неподвижности таких гелей допустимо только электрокинетическое введение пробы.
Динамически модифицированные гели являются гидрофильными полимерами, как, например, линейный полиакриламид, производные целлюлозы, декстран и т. п., которые могут быть растворены в водных разделительных буферных растворах с образованием разделяющей среды, действующей как молекулярное сито. После приготовления они могут быть введены в капилляр под давлением. Замена геля перед каждой инжекцией улучшает воспроизводимость разделения. Пористость гелей увеличивается при использовании полимеров с большей молекулярной массой или уменьшении концентрации полимера. Для выбранного буферного раствора уменьшение пористости геля ведет к уменьшению подвижности компонентов раствора. Так как растворение этих полимеров в буферном растворе дает растворы с низкой вязкостью, может быть использован гидродинамический или электрокинетический ввод пробы.
Дата добавления: 2016-01-30; просмотров: 2877;
