РАСТВОРЕНИЕ КИСЛОРОДА
Кислород находится в жидкой стали в виде раствора и в виде оксидных неметаллических включений. При температуре плавления в чистом жидком железе растворяется -0,17% кислорода. При повышении температуры растворимость кислорода в жидком железе возрастает (рис. 12.7). Растворение кислорода газовой фазы в жидком железе может быть описано схемой 0,5О2®→ [О], = [0], K=[0] 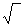 pO2. Константа К характеризует содержание кислорода, растворенного в металле, равновесное с О2 газовой фазы; она может быть выражена формулой
pO2. Константа К характеризует содержание кислорода, растворенного в металле, равновесное с О2 газовой фазы; она может быть выражена формулой
lg K=lg[0]/pO21/2 =-6100/T + 0,1245.
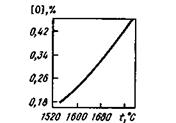
Рис. 12.7.Растворимость кислорода в жидком железе при равновесии с чистым железистым шлаком
При содержании кислорода, превышающем предел его растворимости в жидком железе при данной температуре, кислород взаимодействует с железом по реакции Fe + [О] = (FeO), образуя обособленную фазу — вюстит. Содержание кислорода, растворенного в жидком железе, равновесное с вюститом, может быть описано уравнением
lg[O]Fe0 = -6320/T+ 2,734,
где [O](Fe0) —содержание кислорода в жидком железе, равновесное с вюститом, маc. %; T—температура.
Расчеты по этим уравнениям показывают, что даже при очень низких парциальных давлениях кислорода в газовой фазе, соприкасающейся с жидким железом, происходит окисление последнего с образованием вюсти-та. Экспериментальное исследование взаимодействия кислорода с расплавленным железом затруднительно, поскольку равновесное давление газа очень низкое (10 -9 — 10 -10 МПа) и измерить его практически затруднительно'.
Растворимость кислорода в 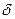 -Fe существенно ниже, чем в жидком железе. В интервале 1400—1500 °С lg[0]S-Fe = -17900/T+7,20. В
-Fe существенно ниже, чем в жидком железе. В интервале 1400—1500 °С lg[0]S-Fe = -17900/T+7,20. В  -Fe растворимость кислорода выше, чем в
-Fe растворимость кислорода выше, чем в 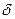 -Fe, что объясняется перестройкой его кристаллической решетки из ОЦК в ГЦК. В
-Fe, что объясняется перестройкой его кристаллической решетки из ОЦК в ГЦК. В  -Fe, так же как и в
-Fe, так же как и в  -Fe, растворимость кислорода очень низка (рис. 12.8). При комнатной температуре растворимость кислорода в железе снижается до следов (< 10 -4 %). Уравнение процесса 0,5О2→ [О] условно, так как практически во всех существующих сталеплавильных агрегатах давление кислорода всегда выше равновесного с жидким железом и идет реакция Fеж + 0,5О2 = (FeO). На двойных диаграммах Fe—О левый (железный) угол соответствует
-Fe, растворимость кислорода очень низка (рис. 12.8). При комнатной температуре растворимость кислорода в железе снижается до следов (< 10 -4 %). Уравнение процесса 0,5О2→ [О] условно, так как практически во всех существующих сталеплавильных агрегатах давление кислорода всегда выше равновесного с жидким железом и идет реакция Fеж + 0,5О2 = (FeO). На двойных диаграммах Fe—О левый (железный) угол соответствует  -фазе,
-фазе,
1 Обычно процесс растворения кислорода описывают в виде перехода 0,5О2(Г) -> [О].
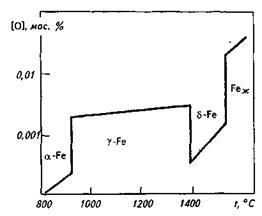
Рис. 12.8.Растворимость кислорода в железе
называемой вюститом (имеет приблизительный состав FeO). Фаза 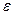 незначительно растворяет железо и в гораздо большей степени растворяет
незначительно растворяет железо и в гораздо большей степени растворяет 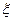 -фазу, которая соответствует составу Fe3O4 и называется магнетитом.
-фазу, которая соответствует составу Fe3O4 и называется магнетитом.
Таким образом, величина [О], характеризующая растворенный в металле кислород, является относительной. В металлургической технике распространение получил метод определения активностей растворенных в железе элементов, основанный на замерах э. д. с. цепи, на одном конце которой находится металл, активность компонента в котором известна (так называемый электрод сравнения), на другом — исследуемый образец. Этот метод в настоящее время широко используется для определения активности кислорода, растворенного в металле. Замеряемое этим методом значение э. д. с. элемента Е пропорционально отношению активностей кислорода в электроде сравнения a[O]c и в исследуемом расплаве а[О]. В соответствии с уравнением Нернста
E=-(RT/nF)ln(a[0]c/a[0]),
где n — число переноса заряда потенциалопределяющего процесса; F— число Фарадея.
В настоящее время метод определения активности кислорода в металле a[О] широко используют на практике для контроля процесса плавки. С помощью выражения a[о] =f [О][О] ПРИ известном коэффициенте активности f[O] можно определить концентрацию кислорода, растворенного в металле (эту величину часто обозначают [О]раст). Полный количественный анализ на кислород (например, методом вакуум-плавления) обеспечивает определение общего содержания кислорода в металле [О]общ. Разность [0]общ - [О]раст = [О]св характеризует количество кислорода, связанного в оксидные включения. Достоверность результатов разделения [О]общ на [0]раст и [О]св зависит от точности определения коэффициента активности f [0] При этом следует учитывать, что системы часто состоят не только из железа и кислорода. Как правило, в жидком металле растворены и другие элементы, которые имеют большее, чем железо, химическое сродство к кислороду. В итоге системы Fe-O-R (R — элемент, растворенный в жидком железе) характеризуются отрицательными отклонениями от идеальности.
В сталеплавильных агрегатах на содержание и активность кислорода по ходу плавки очень большое (как правило, решающее) влияние оказывает углерод (рис. 12.9). Образующиеся в процессе взаимодействия углерода и кислорода пузыри СО выделяются из сталеплавильной ванны, создавая эффект кипения ванны. При содержании углерода <0,10% процесс кипения' ванны замедляется и углерод уже не определяет и не регулирует окислен-ность металла. Начинается проявление преобладающего влияния других факторов на уровень окисленности металла, и
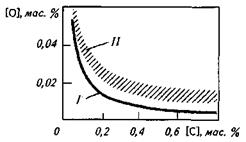
Рис. 12.9.Влияние углерода на окисленность металла в сталеплавильной ванне при ее кипении:
/— кривая равновесных концентраций [С] и [О]; //— область концентраций [С] и [О], фактически наблюдаемых в кипящей сталеплавильной ванне
прежде всего активности оксидов железа в шлаке. При отсутствии кипения обычно соблюдается соотношение a(FeO)/a[O]= const: чем выше активность оксидов железа в шлаке, тем выше окисленность металла. В тех случаях, когда в ванну вводят добавки, содержащие элементы, обладающие большим химическим сродством к кислороду, чем железо (например, кремний, алюминий, марганец), окисленность металла определяется уже уровнем активности этих элементов-раскислите-лей. Некоторые примеси (такие, как никель, молибден, медь), имеющие меньшее химическое сродство к кислороду, чем железо, повышают активность кислорода в стали. При введении в металл элементов-раскисли-телей в нем образуются оксидные неметаллические включения. После кристаллизации в твердой стали практически весь кислород находится не в растворе, а в виде оксидных неметаллических включений, образовавшихся: 1) при введении раскислителей (и взаимодействии их с кислородом, растворенным в металле); 2) во время выпуска и разливки в результате повторного окисления (кислородом воздуха); 3) из шлака, огнеупорной кладки; 4) по ходу плавки как результат поступления в металл вместе с добавками; 5) при затвердевании стали (в результате взаимодействия включений различного происхождения).
ИСТОЧНИКИ ГАЗОВ,
Дата добавления: 2016-01-29; просмотров: 1024;
