Основные физические свойства жидкости и газа
К основным физическим свойствам жидкости и газа относятся: плотность, удельный вес, сжимаемость, температурное расширение, вязкость. Для жидкостей дополнительно важными свойствами являются парообразование, поверхностное натяжение и капиллярность. Газы обладают свойством растворимости в жидкостях.
Плотность r – масса жидкости или газа, содержащаяся в единице объема (кг/м3). Для однородной жидкости
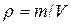 , (2.1)
, (2.1)
где m- масса жидкости, кг; V – объем жидкости, м3.
Удельный вес g – вес жидкости или газа в единице объема (Н/м3):
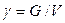 , (2.2)
, (2.2)
где G - вес жидкости, Н.
Плотность и удельный вес связаны между собой зависимостью:
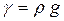 , (2.3)
, (2.3)
где g – ускорение свободного падения: g = 9,81 м/с2.
С ростом температуры плотностьжидкости и газа уменьшается (кроме воды). Для воды максимальная плотность имеет место при 4 0С, при уменьшении ее температуры от 4 0С до 0 0С и увеличении температуры >4 0C плотность уменьшается. Более подробно зависимость плотностигаза от температуры будет рассмотрена ниже.
Также плотность жидкости и газа зависит от давления. Для жидкости эта зависимость незначительная, а плотность газа существенно зависит от давления. Данные зависимости будут приведены ниже.
Сжимаемость – свойство жидкости обратимо изменять свой объем при изменении внешнего давления. Сжимаемость жидкости характеризуется коэффициентом объемного сжатия bр (Па-1), который равен:
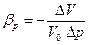 , (2.4)
, (2.4)
где V0 – первоначальный объем жидкости, м3; DV – изменение первоначального объема (м3) при изменении первоначального давления р0 на величину Dр (Па).
Знак минус в формуле (2.4) означает, что при увеличении давления (положительное приращение) происходит уменьшение первоначального объема (отрицательное приращение).
Очевидно, что DV=Vк־V0, а Dр=рк - р0 (Vк, рк – конечные значения объема и давления). Подставив эти значения в формулу (2.4) получим:
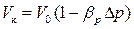 . (2.5)
. (2.5)
Подставим значение V в формулу(2.1) и получим зависимость для определения плотности жидкости от давления:
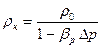 , (2.6)
, (2.6)
где r0– первоначальная плотность жидкости, кг/м3.
Жидкости, очищенные от пузырьков нерастворенного воздуха и других газов, сжимаются крайне незначительно. Так, при повышении давления на 0,1 МПа объем воды уменьшается всего на 0,005 %.
Величина, обратная bр, называется объемным модулем упругости жидкости Еж (Па):
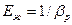 . (2.7)
. (2.7)
Различают адиабатный и изотермический модули упругости жидкости. В расчетах адиабатный модуль применяют в случаях, когда можно пренебречь теплообменом с окружающей средой, например в быстротечных процессах (гидравлический удар, быстрое сжатие жидкости и т.д.). В остальных случаях используют изотермический модуль упругости жидкости, который несколько меньше адиабатного.
Изотермический модуль упругости жидкости уменьшается с увеличением температуры и возрастает с повышением давления
Температурное расширение – свойство жидкости обратимо изменять свой объем при изменении температуры. Для жидкостей оно характеризуется коэффициентом температурного расширения βТ (К-1 или 0С-1):
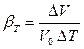 , (2.8)
, (2.8)
где DТ – изменение температуры: (DТ = Тк – Т0); Т0 и Тк - начальная и конечная температуры, соответственно, К или 0С.
Тогда
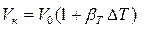 , (2.9)
, (2.9)
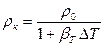 .
.  (2.10)
(2.10)
Газы, в отличие от жидкостей, характеризуются значительной сжимаемостью и температурным расширением. Связь между объемом V, давлением p и абсолютной температурой T идеального газа описывается уравнением Клапейрона, которое объединят уравнения Бойля – Мариотта и Гей-Люссака:
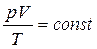 . (2.11)
. (2.11)
Д.И. Менделеев объединил уравнение Клапейрона с законом Авогадро и получил следующее уравнение:
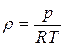 , (2.12)
, (2.12)
где R – газовая постоянная, Дж/(кг · К): для воздуха R=287 Дж/(кг · К) [2, с. 21]. Физическая сущность R – работа расширения 1 кг газа при нагревании на 1 К. Это уравнение называется уравнением Клапейрона – Менделеева.
Реальные газы и их смеси в условиях, далеких от сжижения, практически подчиняются тем же законам, что и идеальные. Поэтому при проектировании систем вентиляции зданий и сооружений можно пользоваться уравнениями (1.11 и 1.12).
Вязкость – свойство жидкости и газа оказывать сопротивление относительному движению (сдвигу) их частиц. Впервые гипотезу о силах внутреннего трения в жидкости высказал И. Ньютон в 1686 г. Спустя почти 200 лет в 1883 г. проф. Н.П. Петров экспериментально подтвердил данную гипотезу и выразил ее математически. При слоистом течении вязкой жидкости вдоль твердой стенки скорости движения ее слоев u различны (рис. 2.1). Максимальная скорость будет у верхнего слоя, скорость слоя, соприкасающегося со стенкой, будет равна нулю. Из-за разности скоростей будет происходить относительный сдвиг соседних слоев, а их на границе возникать касательные напряжения τ. Для однородных жидкостей и газов уравнение для определения касательных напряжений τ (Па) при слоистом движении имеет следующий вид и называется уравнением Ньютона – Петрова:
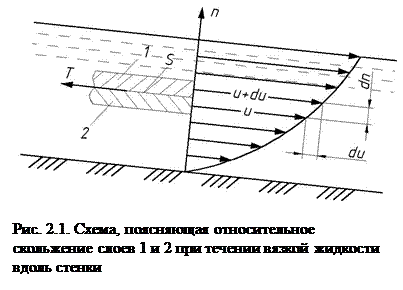
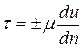 , (2.13)
, (2.13)
где m – коэффициент пропорциональности, называемый динамической вязкостью, Па·с; du/dn - градиент скорости, т.е. элементарное изменение скорости u по нормали n, проведенной к векторам скоростей слоев, с-1. Градиент скорости может быть положительным, так и отрицательным. Поэтому в уравнении (2.13) перед m стоит знак ±.
При постоянстве τ касательных напряжений по всей поверхности соприкасающихся слоев полная касательная сила (сила трения) Т будет равна:
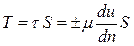 , (2.14)
, (2.14)
где S – площадь поверхности соприкасающихся слоев, м2.
В механике жидкости и газа при выполнении расчетов чаще всего используют кинематическую вязкость ν (м/с2):
 . (2.15)
. (2.15)
Вязкость зависит от температуры и давления. При увеличении температуры вязкость жидкостей уменьшается, а газов увеличивается. В жидкостях вязкость обусловлена силами молекулярного сцепления, которые с увеличением температуры ослабевают. Для воды зависимость кинематической вязкости от температуры определяется с помощью эмпирической формулы Пуазейля (м2/с):
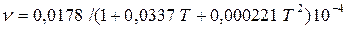 , (2.16)
, (2.16)
где Т- температура воды, 0С.
В газах вязкость в основном вызвана хаотичным тепловым движением молекул, скорость движения которых увеличивается с повышением температуры. Между движущимися относительно друг друга слоями газа происходит постоянный обмен молекулами. Переход молекул из одного слоя в соседний, который двигается с иной скоростью, приводит к переносу определённого количества движения. В результате медленные слои ускоряются, а более быстрые замедляются. Поэтому, при увеличении температуры вязкость газов увеличивается. Динамическую вязкость газов в зависимости от температуры можно определить, используя формулу Сазерленда:
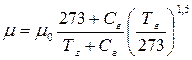 , (2.17)
, (2.17)

где μ0 – динамическая вязкость газа при 0 оС; Тг – температура газа, К; Сг – постоянная, зависящая от вида газа: для воздуха Сг=130,5.
С увеличением давления вязкость жидкости увеличивается, которое может быть вычислено по следующей формуле:
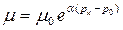 , (2.18)
, (2.18)
где m и m0 - динамическая вязкость жидкости при давлении рк и р0, соответственно, Па∙с; a - коэффициент, зависящий от температуры жидкости (при высоких температурах a =0,02 , низких – a = 0,03).
Для газов m незначительно зависит от давления при его изменении от 0 до 0,5 МПа. При дальнейшем увеличении давления вязкость газа растет по зависимости, близкой к экспоненте. Например, при увеличении давления газа от 0 до 9 МПа m увеличивается почти в пять раз.
Сопротивление растяжению для жидкостей из-за наличия сил межмолекулярного притяжения может достигать значительной величины. Так, в очищенной от примесей и дегазированной воде кратковременно удалось получить растягивающие напряжения до 28 МПа. Технически чистые жидкости, содержащие пузырьки газов и твердые частицы примесей практически не сопротивляются растяжению. В газах расстояния между молекулами значительны и межмолекулярные силы притяжения крайне невелики. Поэтому, в механике жидкости и газа принято считать, что сопротивление растяжению в жидкостях и газах равно нулю.
Растворимость газов в жидкости – это способность молекул газа из окружающей среды проникать во внутрь жидкости через ее свободную поверхность. Этот процесс продолжается до полного насыщения жидкости газом или смесью газов. Количество растворенного газа в единице объема жидкости зависит от рода газа и жидкости, ее температуры и давления на свободной поверхности. Впервые это явление исследовал английский химик У. Генри в 1803 г. и вывел закон, который в настоящее время носит его имя: в состоянии насыщения масса газа, растворенного в определенном объеме жидкости при постоянной температуре, прямо пропорциональна парциальному давлению этого газа над жидкостью.
При понижении давления растворенный газ выделяется из жидкости. В ней образуются пузырьки, заполненные парами жидкости и газом, выделившимся из данной жидкости.
При повышении температуры растворимость газа в жидкости практически всегда уменьшается. Так, при кипячении воды, растворенные в ней газы можно почти полностью удалить.
Парообразование – свойство жидкостей превращаться в пар, т.е. в газообразное состояние. Парообразование, происходящее на поверхности жидкости, называется испарением. Все жидкости без исключения испаряются. Испаряемость жидкости зависит от типа жидкости, температуры и внешнего давления на свободной поверхности. Чем выше температура и чем меньше давление на поверхности жидкости, тем быстрее происходит процесс испарения. Количество пара, которое может содержаться в окружающей газовой среде, не является бесконечным. Оно ограничено некоторым уровнем, называемым состоянием насыщения. При этом количество испарившейся жидкости равно количеству жидкости, превратившейся из пара в капельки (процесс конденсации). Плотность и давление насыщенного пара зависит от температуры и типа жидкости, при фиксированной температуре плотность и давление насыщенного пара для определенной жидкости есть величины постоянные. В жидкости всегда имеются мельчайшие пузырьки газа, при нагревании жидкости у стенок сосуда, поскольку там наибольшая температура, во внутрь этих пузырьков происходит испарение жидкости до тех пор, пока давление насыщенных паров в пузырьке не станет равно наружному давлению. При дальнейшем увеличении температуры размеры пузырька увеличиваются, под действием выталкивающей силы (силы Архимеда) он отрывается от стенки, достигает свободной поверхности и лопается. Парогазовая смесь попадает в окружающую газовую среду. При достижении определенной температуры процесс образования парогазовых пузырьков происходит во всем объеме жидкости. Как отмечалось выше, количество растворенного в жидкости газа зависит и от давления. Поэтому кипение жидкости может происходить при понижении давления на свободной поверхности. Процесс парообразования во всем объеме жидкости с образованием парогазовых пузырьков называется кипением. Кипение происходит при определенных температуре и давлении. Эта температура называется точкой кипения, а давление – давлением насыщенных паров рн.п. (в справочниках рн.п. приводится в абсолютной системе отсчета давления). Например, при температуре 100 0С для воды давление насыщенных паров равно примерно 0,1 МПа, а при 20 0С – 0,0024 МПа. Таким образом, для закипания воды, температура которой равна 20 0С, необходимо либо нагреть ее при атмосферном давлении до 100 0С, либо снизить абсолютное давление на свободной поверхности до 0,0024 МПа без нагревания.
 В некоторых гидравлических устройствах возможно уменьшение давления ниже атмосферного, например, на входе в насос при всасывании жидкости. При уменьшении там давления до рн.п. начинается образование парогазовых пузырьков и нарушение сплошности жидкости. Пузырьки в подавляющем большинстве случаев увлекаются потоком жидкости в область повышенного давления. Внутри пузырьков начинается конденсация пара, а находящийся там газ вновь растворяется в жидкости. Происходит, так называемое, «схлопывание» пузырьков, что сопровождается локальными гидроударами, шумом и вибрацией. В результате снижается КПД и подача насоса или производительность турбины. Поверхность обтекаемого тела при этом может разрушаться. Этот процесс называется кавитацией (от лат. сavitas – пустота) (рис. 2.2). Явление кавитации известно в науке и технике немногим больше сотни лет. Впервые это явление обнаружил английский инженер Р. Фруд в 1894 году при испытании английских миноносцев. Тогда же он ввел термин «кавитация».
В некоторых гидравлических устройствах возможно уменьшение давления ниже атмосферного, например, на входе в насос при всасывании жидкости. При уменьшении там давления до рн.п. начинается образование парогазовых пузырьков и нарушение сплошности жидкости. Пузырьки в подавляющем большинстве случаев увлекаются потоком жидкости в область повышенного давления. Внутри пузырьков начинается конденсация пара, а находящийся там газ вновь растворяется в жидкости. Происходит, так называемое, «схлопывание» пузырьков, что сопровождается локальными гидроударами, шумом и вибрацией. В результате снижается КПД и подача насоса или производительность турбины. Поверхность обтекаемого тела при этом может разрушаться. Этот процесс называется кавитацией (от лат. сavitas – пустота) (рис. 2.2). Явление кавитации известно в науке и технике немногим больше сотни лет. Впервые это явление обнаружил английский инженер Р. Фруд в 1894 году при испытании английских миноносцев. Тогда же он ввел термин «кавитация».
Кавитация находит и полезное применение. Например, при бурении горных пород и обработке поверхностей за счет кавитационной эрозии.
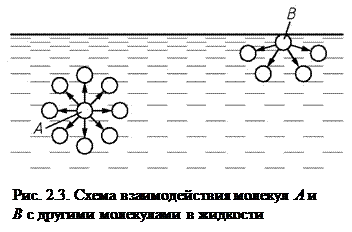
Поверхностное натяжение – напряжения, возникающие в поверхностном слое жидкости и вызываемые силами межмолекулярного притяжения. Сравним воздействие на молекулу А, находящуюся внутри жидкости, с молекулой В, находящейся вблизи поверхности раздела жидкости и газа (рис. 2.3). Молекула А окружена другими молекулами со всех сторон и силы притяжения со стороны окружающих молекул уравновешены. Молекулу В, находящуюся у границы с газом, окружают другие молекулы только со стороны жидкости, молекул со стороны газа практически нет. Поэтому, для молекулы В равнодействующая всех сил направлена вниз во внутрь жидкости. В результате в поверхностном слое жидкости возникают дополнительные напряжения сжатия. Вследствие этого жидкость стремится принять такую форму, при которой ее свободная поверхность минимальна. Например, в невесомости жидкость принимает сферическую форму, такую же форму стремятся принять капли воды и масла на раскаленной плите.
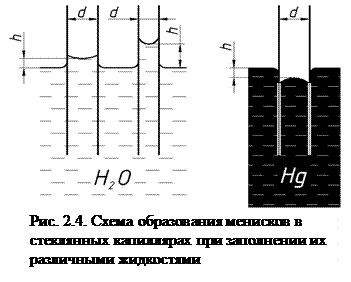
 В случае соприкосновения жидкости с твердым телом жидкость может смачивать поверхность этого тела, а может и не смачивать. Поведение жидкости будет зависеть от величины сил сцепления молекул жидкости и молекул твердого тела. В первом случае, если силы сцепления между молекулами самой жидкости больше сил сцепления между молекулами жидкости и твердого тела, то капля жидкости на поверхности данного тела будет образовывать слегка сплюснутую сферу (например, капля ртути на поверхности стекла). Во втором случае, когда силы взаимодействия между молекулами жидкости и твердого тела больше сил взаимодействия между молекулами самой жидкости, то капля жидкости растекается по поверхности твердого тела. Так капля воды растекается на той же стеклянной поверхности, причем общая внешняя поверхность бывшей капли воды увеличивается. В первом случае жидкость смачивает поверхность твердого тела, а во втором – не смачивает. Если поместить тонкую трубку (капилляр) в достаточно большой сосуд, то вследствие несмачивания или смачивания жидкостью стенок капилляра поверхность жидкости (мениск) имеет выпуклую форму в первом случае и вогнутую – во втором случае (рис. 2.4).
В случае соприкосновения жидкости с твердым телом жидкость может смачивать поверхность этого тела, а может и не смачивать. Поведение жидкости будет зависеть от величины сил сцепления молекул жидкости и молекул твердого тела. В первом случае, если силы сцепления между молекулами самой жидкости больше сил сцепления между молекулами жидкости и твердого тела, то капля жидкости на поверхности данного тела будет образовывать слегка сплюснутую сферу (например, капля ртути на поверхности стекла). Во втором случае, когда силы взаимодействия между молекулами жидкости и твердого тела больше сил взаимодействия между молекулами самой жидкости, то капля жидкости растекается по поверхности твердого тела. Так капля воды растекается на той же стеклянной поверхности, причем общая внешняя поверхность бывшей капли воды увеличивается. В первом случае жидкость смачивает поверхность твердого тела, а во втором – не смачивает. Если поместить тонкую трубку (капилляр) в достаточно большой сосуд, то вследствие несмачивания или смачивания жидкостью стенок капилляра поверхность жидкости (мениск) имеет выпуклую форму в первом случае и вогнутую – во втором случае (рис. 2.4).
Силы взаимодействия между молекулами жидкости и молекулами стенки вызывают на поверхности жидкости дополнительное давление. Это давление обусловлено силами поверхностного натяжения и для выпуклой поверхности оно положительно и направлено во внутрь жидкости, для вогнутой поверхности – отрицательно и направлено в противоположную сторону. В результате при вогнутом мениске жидкость под действием разности давлений на поверхности сосуда и на поверхности мениска будет подниматься в капилляре на высоту h (рис. 2.4). При выпуклом мениске жидкость наоборот – будет опускаться в капилляре. Физическое явление, заключающееся в способности жидкостей изменять уровень в трубках, узких каналах произвольной формы, пористых телах, называется капиллярностью (от лат. capillaris — волосяной).
Высота подъема или опускания жидкости в капилляре h (м) определяется по формуле:
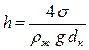 , (2.19)
, (2.19)
где σ – поверхностное натяжение, Н/м; ρж – плотность жидкости, кг/м3; dк – диаметр капилляра, м.
 Для воды при 20 0С формула (1.19) примет вид: h =0, 0298/ dк.
Для воды при 20 0С формула (1.19) примет вид: h =0, 0298/ dк.
Капиллярные явления имеют место как в природе (влагообмен в почве и растениях), так и в технике (действие фитилей, впитывание влаги пористыми средами, неразрушающий контроль микротрещин и др.). Это явление может приводить к сырости в цокольных и первых этажах зданий, если гидроизоляция выполнена некачественно.
Идеальная жидкость
Идеальной жидкостью называется несуществующая жидкость, в которой отсутствуют силы внутреннего трения, она не изменяет свой объем при изменении давления и температуры и совершенно не сопротивляется разрыву. Таким образом, идеальная жидкость представляет собой упрощенную модель реальной жидкости. Использование модели идеальной жидкости позволяет значительно упростить способы решения гидравлических задач. Вместе с тем, использование данной модели не позволяет получить объективную картину процессов, происходящих при движении реальной жидкости. Поэтому, для достижения необходимой точности в расчетах полученные уравнения для идеальной жидкости корректируются поправочными коэффициентами.
Дата добавления: 2016-01-26; просмотров: 12448;
