Тема лекции: Метод кислотно-основного титрования
План лекции:
1. Теоретические основы метода кислотно-основного титрования. рН.
2. Титранты метода. Индикаторы метода.
3. Кривые титрования.
4. Значение метода в технохимическом контроле продукции пищевых производств и общественного питания.
5. Гидролиз солей.
Метод кислотно-основного титрования (нейтрализации) – метод химического анализа, основанный на применении реакции взаимодействия ионов Н+ и ОН-.
Характеристика метода нейтрализации.
| Уравнение реакции | Рабочий раствор (титрант) | Применение метода | Фиксирование точки эквивалентности | Недостатки метода |
| Взаимодействие кислот с основаниями: Н+ + ОН- → Н2О | Раствор кислоты или щелочи | Для количественного определения кислот или щелочей (жесткость воды, концентрацию солей слабых кислот – щелочная среда) | Индикаторы (по природе – органические кислоты или основания) | Большая трудность определения точки эквивалентности. |
В зависимости от титранта различают методы:
Ø ацидиметрии (acidum – кислота): в качестве титранта используют 0,01 – 0,1 н. растворы сильных кислот (серная кислота, соляная кислота). Применяют для определения сильных и слабых оснований и некоторых солей слабых кислот (NaOH, NH4OH, Na2CO3, NaHCO3 и т.д.)
Ø алкалиметрии (alkalis – щелочь): в качестве титранта используют 0,01 – 0,1 н. растворы щелочей (NaOH, KOH, Ва(ОН)2). Применяют для определения сильных и слабых кислот и некоторых солей слабых оснований (HCl, H3BO3, CH3COOH и т.д.)
Водородный показатель.
Понятие «водородный показатель» было введено датским химиком Серенсоном в 1909 г. Буква «р» - начальная буква датского слова «потенц» - степень, буква «Н» - символ водорода.
Концентрации ионов Н+ и ОН- в воде и любом водном растворе взаимосвязаны. Увеличение концентрации ионов Н+ (например, при добавлении кислоты) вызывает уменьшение концентрации ионов ОН-, и наоборот.
Растворы, в которых концентрация ионов водорода равна концентрации гидроксид-ионов, называют нейтральными. Если концентрация ионов водорода больше, то среда в растворе кислотная, если меньше — раствор щелочной, так как концентрация гидроксид-ионов будет больше.
Кислотность растворов обычно выражают через концентрацию ионов водорода Н+. Однако выражать такими числами, как 10-8 моль/дм3 или 10-4 моль/дм3, концентрацию ионов водорода неудобно, и в химии применяют водородный показатель рН, который численно равен показателю степени молярной концентрации, взятому с обратным знаком. Например, при молярной концентрации ионов Н+, равной 10-5 моль/дм3, рН равен 5, а при концентрации ионов Н+, равной 10-8 моль/дм3, рН равен 8. Водородный показатель характеризует кислотность или щелочность раствора.
Чем рН меньше 7, тем больше кислотность раствора. Чем рН больше 7, тем больше щелочность раствора. При рН 7 среда раствора нейтральная. Это означает, что молярные концентрации ионов водорода Н+ и гидроксид-ионов ОН- равны.
Увеличение кислотности Увеличение щелочности
 |  |
рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Величина рН играет большую роль в промышленности, химических и биологических процессах. Большинство из них может протекать только при определенной кислотности среды. На молочных комбинатах свежесть молока определяется по величине рН. В человеческом организме различные жидкости имеют различную величину рН: желудочный сок – рН 1,7 (сильнокислая среда), кровь – рН 7,4 (слабощелочная среда). Величина рН – показатель состояния здоровья человека.
Выбор титранта для кислотно-основного титрования.
Предпочтительно использовать либо сильные кислоты, либо сильные основания. В качестве индикаторов в методе нейтрализации используют слабые органические кислоты или основания.
Характеристика индикаторов метода нейтрализации:
Ø меняют окраску в зависимости от концентрации водородных ионов в растворе
Ø имеют интервал перехода окраски (значения рН раствора, в пределах которого индикатор меняет свою окраску)
Ø характерен показатель титрования (концентрация ионов водорода, при которой наиболее резко меняется окраска индикатора) – рТ.
Показатель титрования основных индикаторов
 индикатор
рТ индикатор
рТ
| Метиловый оранжевый | Метиловый красный | Лакмус | фенолфталеин |
| рТ |
Требования к индикаторам в методе нейтрализации:
1. резкое отличие в окраске двух форм индикатора в небольшом интервале рН, при добавлении малого количества гидроксид-ионов или протонов Н+;
2. изменение окраски должно быть обратимо; видимая окраска индикатора наблюдается лишь внутри интервала перехода окраски.
Часто используемые индикаторы.
· Столбец «х» — характер индикатора: к—кислота, о—основание.
| Индикатор | х | Цвет более кислой формы | Интервал перехода pH | Цвет более щелочной формы |
| фенолфталеин | к | бесцветный | 8,2 – 10,0 | Малиново-красный |
| Лакмус (азолитмин) | красный | 5,0 – 8,0 | синий | |
| Метиловый красный | о | красный | 4,2 – 6,2 | Желтый |
| Метиловый оранжевый | о | красный | 3,1 – 4,4 | Оранжево-желтый |
Интервал перехода индикатора не является вполне точной характеристикой. Он зависит от различной интенсивности окраски обоих растворов и от различной восприимчивости глаза к разным цветам. Тем не менее, при выборе индикатора для титрования необходимо знать интервал перехода различных индикаторов. При каждом титровании следует применять определенный индикатор, который позволит свести ошибку титрования к минимуму. Информация о применении основных индикаторов в методе нейтрализации приведена в таблице.
Выбор индикаторов в методе нейтрализации
| Условия титрования | рН в момент эквивалентности | Индикатор |
| сильную кислоту титруют сильным основанием | метиловый оранжевый, метиловый красный, фенолфталеин | |
| сильное основание титруют сильной кислотой | То же | |
| слабую кислоту титруют сильным основанием | больше 7 (слабощелочная) | фенолфталеин |
| Слабое основание титруют сильной кислотой | меньше 7 (слабокислая) | метиловый оранжевый, метиловый красный |
Для правильного выбора индикатора в методе нейтрализации строят кривые титрования.
В методе нейтрализации титрования выражают зависимость изменения рН среды от объема добавленного в процессе титрования титранта.
Кривые титрования — кривые, показывающие изменение концентраций веществ в процессе прохождения химических и электрохимических реакций титрования.
Значение:
• дают возможность обнаружить, в какой мере та или иная реакция проходит количественно, т.е. можно ли ее использовать для титрования (оценка целесообразности титрования);
• дают возможность установить, за изменениями какой величины лучше всего следить в ходе титрования, как эта величина изменяется и как можно обнаружить конец титрования;
• дают возможность найти точку эквивалентности;
• дают возможность подобрать подходящий индикатор.
На рисунках 1,2,3 представлены примеры различных случаев титрования с характерными кривыми титрования.
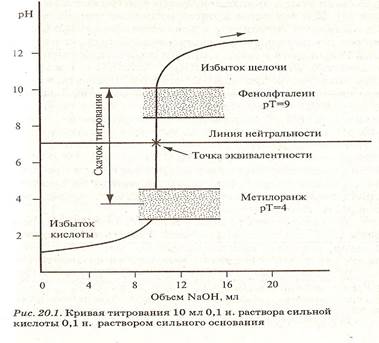
Рисунок 1. Кривая титрования раствора сильной кислоты раствором сильного основания
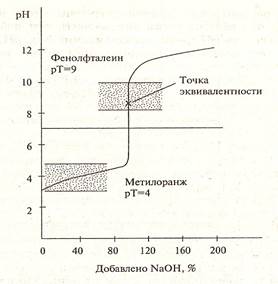
Рисунок 2. Кривая титрования слабой кислоты сильным основанием
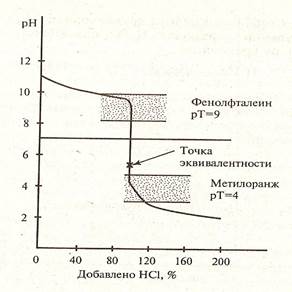
Рисунок 3. Кривая титрования слабого основания сильной кислотой
Гидролиз – взаимодействие ионов соли с ионами воды, в результате которого образуется слабый электролит.
Результат гидролиза: изменение среды раствора
Типы солей:
1. Соль, образованная сильным основанием и сильной кислотой: не гидролизуется
Примеры: КNO3, NaCl, CaCl2 и т.д.
2. Соль, образованная слабым основанием и сильной кислотой: MgSO4, CuCl2 и т.д.
MgSO4 ↔ Mg2+ + SO42- - гидролиз по катиону (анион сильной кислоты не реагирует с водой)
Mg2+ + НОН ↔ MgОН+ + Н+ - кислая среда (рН меньше 7)
MgОН+ + НОН ↔ Mg(ОН)2 + Н+ - протекает при жестких условиях
MgSO4 + 2НОН ↔ Mg(ОН)2 + Н2SO4
3. Соль, образованная сильным основанием и слабой кислотой: Na2CO3, K2SO3 и т.д.
Na2CO3 ↔ 2Na+ + CO32- - гидролиз по аниону (катион не реагирует)
CO32- + НОН ↔ НCO3- + ОН- - щелочная среда (рН больше 7)
НCO3- + НОН ↔ Н2CO3 + ОН-
Na2CO3 +2НОН ↔ Н2CO3 + 2NaOH
4. Соль, образованная слабым основанием и слабой кислотой: СН3СООNН4, Al2S3 и т.д.
СН3СООNН4 ↔ СН3СОО- + NН4+ - гидролиз по катиону и аниону
СН3СОО- + NН4+ + НОН ↔ СН3СООН + NН4ОН – среда нейтральная (рН = 7)
СН3СООNН4 + НОН ↔ СН3СООН + NН4ОН
Литература:
1. Панкратова Г.В., Жванко Ю.Н., Мамедова З.И. Аналитическая химия и технохимический контроль в общественном питании. – М.: Высшая школа, 1980. – с. 95 – 104/
2. Шапиро С.А., Шапиро М.А. Аналитическая химия. – М.: Высшая школа, 1979. – с. 228 – 241.
Дата добавления: 2016-01-26; просмотров: 2753;
