Глюкоза C6H12O6 (альдегидоспирт).
Глюкозу называют также виноградным сахаром, так как она содержится в большом количестве в виноградном соке. Кроме винограда глюкоза находится и в других сладких плодах и даже в разных частях растений. Распространена глюкоза и в животном мире: 0,1% ее находится в крови. Глюкоза разносится по всему телу и служит источником энергии для организма. Она также входит в состав сахарозы, лактозы, целлюлозы, крахмала.
В организме человека глюкоза содержится а мышцах, крови, и в небольших количествах во всех клетках.
В природе глюкоза на ряду с другими углеводами образуется в результате реакции фотосинтеза:
6СО2+6Н2О хролофил С6Н12О6+6О2-Q.
Физические свойства. Глюкоза -- бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. Из водного раствора она выделяется в виде кристаллогидрата С6Н12Об*Н2О. По сравнению со свекловичным сахаром она менее сладкая.
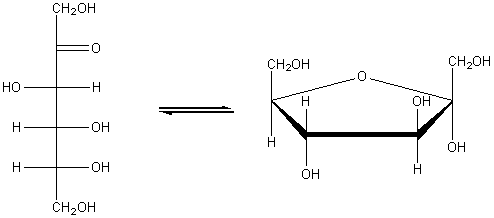
Глюкоза может существовать в линейной и циклической формах:
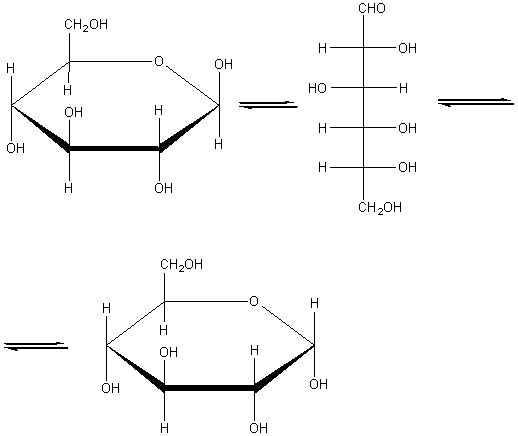
Получение.
Первый синтез простейших углеводов из формальдегида в присутствии гидроксида кальция был произведен А. М. Бутлеровым в 1861 г. На производстве глюкозу чаще всего получают гидролизом крахмала в присутствии серной кислоты:
(С6Н10О5)n + nН2О Н2SO4, t nС6Н12О6
Химические свойства:
Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов. Кроме того, она обладает и некоторыми специфическими свойствами.
1) Реакции альдегидной группы:
а) реакция «серебряного зеркала»:
CH2OH–(CHOH)4–CH=O + 2[Ag(NH3)2]OH →
→ CH2OH–(CHOH)4–COONH4 + 2Ag↓ +3NH3 + H2O;
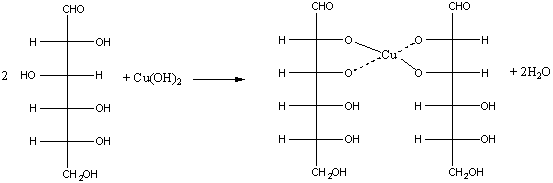
б) реакция с гидроксидом меди (II):
t
CH2OH–(CHOH)4–CH=O + 2Cu(OH)2 →
CH2OH–(CHOH)4–COOH + Cu2O↓ + 2H2O,
в) восстановление:
[H]
CH2OH–(CHOH)4–CH=O → CH2OH–(CHOH)4–CH2OH.
2) Реакции гидроксильной группы:
а) взаимодействие с гидроксидом меди (II): Как и все многоатомные спирты, глюкоза с гидроксидом меди (II) дает интенсивное синее окрашивание (качественная реакция). Осадок гидроксида меди(II) сначала растворяется, затем при нагревании становится желто-оранжевым, что говорит о наличии альдегидной группы.
HOCH2(CHOH)4CHO + 2Cu(OH)2 ----- HOCH2(CHOH)4COOH + Cu2O + 2H2O
 ярко синий раствор
ярко синий раствор
При действии бромной водой глюкоза также окисляется в глюконовую кислоту.
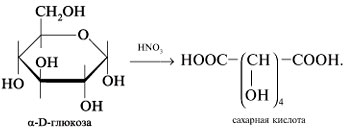
-Окисление глюкозы азотной кислотой приводит к двухосновной сахарной кислоте:
Восстановление глюкозы в шестиатомный спирт сорбит:
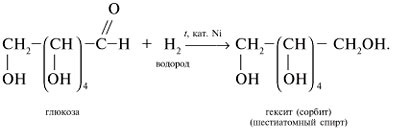
Cорбит содержится во многих ягодах и фруктах.
б) брожение – расщепление глюкозы под действием ферментов (специфические реакции)
C6H12O6 → 2C2H5OH + 2CO2 – спиртовое брожение,
C6H12O6 → 2CH3CH(OH)COOH – молочнокислое брожение
Существуют специфические свойства глюкозы, подобно алифатическим альдегидам она присоединяет молекулу синильной кислоты. Что позволяет увеличить длину цепи углевода:
HOCH2-(CHOH)4—COH + HCN ---- HOCH2_(CHOH)4-CHOH-CN
Фруктоза C6H12O6 (кетоноспирт). В растительном мире широко распространена фруктоза или фруктовый (плодовый) сахар. Фруктоза содержится в сладких плодах, меде. Извлекая из цветов сладких плодов соки, пчелы приготавливают мед, который по химическому составу представляет собой в основном смесь глюкозы и фруктозы. Также фруктоза входит в состав сложных сахаров, например тростникового и свекловичного.
Химические свойства:Фруктоза вступает во все реакции, характерные для многоатомных спиртов, однако реакции карбонильной (альдегидной) группы, в отличие от глюкозы, для нее не характерны.
Рибоза C5H10O5 – пентоза (альдегидоспирт)
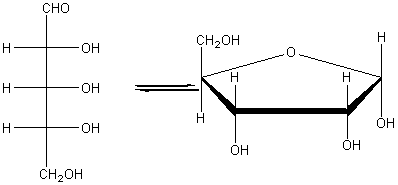
Химические свойства аналогичны глюкозе.
Дисахариды.
Важнейшие дисахариды -- сахароза, мальтоза и лактоза. Все они являются изомерами и имеют формулу С12Н22О11, однако их строение различно
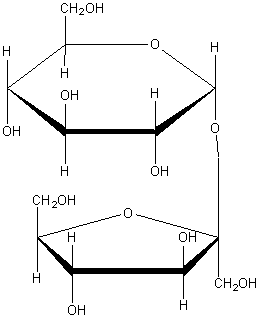
Сахароза C12H22O11 – дисахарид. Сахароза образована остатками a-глюкозы и b-фруктозы:
Химические свойства:
1) Гидролиз:
C12H22O11 + H2O → C6H12O6 + C6H12O6.
Сахароза глюкоза фруктоза
2) Взаимодействие с гидроксидом кальция с образованием сахарата кальция.
3) Сахароза не реагирует с аммиачным раствором оксида серебра, поэтому ее называют невосстанавливающим дисахаридом.
Индусы еще за 300 лет до нашей эры умели получать тростниковый сахар из тростника. В наше время получают сахарозу из тростника, произрастающего в тропиках (на о.Куба и в других странах Центральной Америки).
В середине 18 века дисахарид был обнаружен и в сахарной свекле, а в середине 19 века был получен в производственных условиях.
В сахарной свекле содержится 12-15% сахарозы, по другим источникам 16-20% (сахарный тростник содержит 14-26% сахарозы).
Тростниковый сахар применяется в медицине для изготовления порошков, сиропов, микстур и т.д.
Свекловичный сахар широко применяется в пищевой промышленности, кулинарии, приготовлении вин, пива и т.д.
Из молока получают молочный сахар - лактозу. В молоке лактоза содержится в довольно значительном количестве: в коровьем молоке 4-5,5% лактозы, женское молоко содержит 5,5-8,4% лактозы.
Лактоза отличается от других сахаров отсутствием гидроскопичности - она не отсыревает. Это свойство имеет большое значение: если нужно приготовить с сахаром какой-либо порошок, содержащий легко гидролизующее лекарство, то берут молочный сахар. Если взять тростниковый или свекловичный сахар, то порошок быстро отсыреет и легко гидролизующее лекарственное вещество быстро разложится.
Значение лактозы очень велико, т.к. она является важным питательным веществом, особенно для растущих организмов человека и млекопитающихся животных.
Солодовый сахар - это промежуточный продукт при гидролизе крахмала. По другому его называют еще мальтоза, т.к. солодовый сахар получается из крахмала при действии солода (по лат. солод - maltum).
Солодовый сахар широко распространен как в растительных, так и в животных организмах. Например, он образуется под влиянием ферментов пищеварительного канала, а также при многих технологических процессах бродильной промышленности: винокурения, пивоварении и т.д.
Мальтоза С12H22O11 – дисахарид, образованный двумя остатками a-глюкозы.
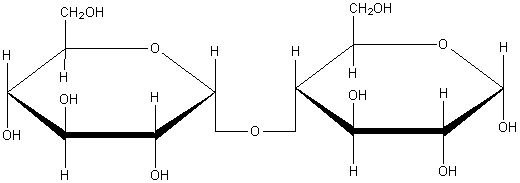
Химические свойства аналогичны глюкозе, поэтому ее называют восстанавливающим дисахаридом. Молекула мальтозы состоит из двух остатков б -глюкозы в пиранозной форме, соединенных через 1-й и 4-й атомы углерода.
Лактоза состоит из остатков (3-галактозы и а-глюкозы в пиранозной форме, соединенных через 1-й и 4-й атомы углерода. Все эти вещества представляют собой бесцветные кристаллы сладкого вкуса, хорошо растворимые в воде. Химические свойства дисахаридов определяются их строением. При гидролизе дисахаридов в кислой среде или под действием ферментов связь между двумя циклами разрывается и образуются соответствующие моносахариды, например:
С12Н22О11 + Н2О Н+, t С6Н12О6 + С6Н12О6
глюкоза фруктоза
По отношению к окислителям дисахариды делят на два типа: восстанавливающие и невосстанавливающие. К первым относятся мальтоза и лактоза, которые реагируют с аммиачным раствором оксида серебра по упрощенному уравнению:
NH3
C12H22O11 + Ag2O ------ > С12Н22О12 + 2Ag.
Эти дисахариды могут также восстанавливать гидроксид меди (II) до оксида меди (I):
C12H22O11 + 2Сu(ОН)2 ---- > С12Н22О12 + Cu2Ov + 2Н2О.
Восстановительные свойства мальтозы и лактозы обусловлены тем, что их циклические формы содержат гликозидный гидроксил (обозначен звездочкой), и, следовательно, эти дисахариды могут переходить из циклической формы в альдегидную, которая и реагирует с Ag2O и Сu(ОН)2. В молекуле сахарозы нет гликозидного гидроксила, поэтому ее циклическая форма не может раскрываться и переходить в альдегидную форму. Сахароза -- невосстанавливающий дисахарид; она не реагирует с гидро-ксидом меди (II) и аммиачным раствором оксида серебра.
Распространение в природе.Наиболее распространенный дисахарид -- сахароза. Это химическое название обычного сахара, который получают экстракцией из сахарной свеклы или сахарного тростника. Сахароза -- главный источник углеводов в пище
человека. Лактоза содержится в молоке (от 2 до 8%) и получается из молочной сыворотки. Мальтоза содержится в проросших семенах хлебных злаков. Мальтоза также образуется при неполном гидролизе крахмала.
Полисахариды: Молекулы полисахаридов можно рассматривать как продукт поликонденсации моносахаридов. Важнейшие из полисахаридов – это крахмал и целлюлоза (клетчатка). Они построены из остатков глюкозы. Общая формула этих полисахаридов (C6H10O5)n
Крахмал (С6H10O5)n – природный полимер, молекулы которого состоят из линейных и разветвленных цепей, содержащих остатки a-глюкозы. Крахмал - образуется в растениях при фотосинтезе и откладывается в виде "резервного" углевода в корнях, клубнях и семенах. Зерна риса, пшеницы, ржи и других злаков содержат 60-80% крахмала, клубни картофеля - 15-20%. Крахмальные зерна растений различаются по внешнему виду, что хорошо видно, когда их рассматриваешь под микроскопом.
Физические свойства: Внешний вид крахмала хорошо всем известен: это белое вещество, состоящее из мельчайших зерен, напоминающих муку, поэтому его второе название «картофельная мука». Крахмал не растворим в холодной воде, в горячей набухает и постепенно растворяется, образуя вязкий раствор (клейстер).При быстром нагревании крахмала происходит расщепление гигантской молекулы крахмала на мелкие молекулы полисахаридов, называемых декстринами. Декстрины имеют общую молекулярную формулу с крахмалом (С6Н12О5)х, разница лишь в том, «х» в декстринах меньше «n» в крахмале. Пищеварительные соки содержат несколько разных ферментов, которые при низкой температуре доводят гидролиз крахмала до глюкозы:
(С6Н10О5) ------- (С6Н10О5)х --------- С12Н22О11 --------- С6Н12О6
Крахмал легко подвергается гидролизу: при нагревании в присутствии серной кислоты образуется глюкоза. (C6H10O5)n(крахмал) + nH2O ––H2SO4,t°® nC6H12O6(глюкоза)
Химические свойства:
1) Гидролиз
H+, t
(C6H10O5)n + nH2O → nC6H12O6
глюкоза
2) Крахмал дает интенсивно синее окрашивание с йодом за счет образования внутрикомплексного соединения(качественная реакция).
3) Крахмал не вступает в реакцию «серебряного зеркала».
Применение: Ферментативный гидролиз (разложение путем брожения) крахмала имеет промышленное значение в производстве этилового спирта из зерна и картофеля. Процесс начинается с превращением крахмала в глюкозу, которую затем сбраживают. Используя специальные культуры дрожжей и изменяя условия, можно направить брожение и в сторону получения бутилового спирта, ацетона, молочной, лимонной и глюконовой кислот. Подвергая крахмал гидролизу кислотами, можно получить глюкозу в виде чистого кристаллического препарата или в виде патоки - окрашенного нескристаллизирующего сиропа. Наибольшее значение крахмал имеет в качестве пищевого продукта: в виде хлеба, картофеля, круп, являясь главным источником в нашем рационе питания. Кроме того, чистый крахмал применяется в пищевой промышленности в производстве кондитерских и кулинарных изделий, колбас. Значительное количество крахмала употребляется для проклеивания тканей, бумаги, картона, производства канцелярского клея. В аналитической химии крахмал служит индикатором в йодометрическом методе титрования. Для этих случаев лучше применять очищенную амилозу, т.к. ее растворы не загустевают, а образуемая с йодом окраска более интенсивна. В медицине и фармации крахмал применяется для приготовления присыпок, паст (густых мазей), а также при производстве таблеток. В животном мире роль «запасного крахмала» играет родственный крахмалу полисахарид - гликоген. Гликоген содержится во всех животных тканях. Особенно много его в печени (до 20%) и в мышцах (4%).
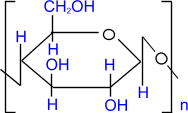
Целлюлоза (С6H10O5)n – природный полимер, молекулы которого состоят из линейных цепей, содержащих остатки b-глюкозы. . Целлюлоза – многоатомный спирт, на элементную ячейку полимера приходятся три гидроксильных группы. В связи с этим, для целлюлозы характерны реакции этерификации (образование сложных эфиров). Наибольшее практическое значение имеют реакции с азотной кислотой и уксусным ангидридом.
Нахождение в природе: Целлюлоза, так же как и крахмал, образуется в растениях при реакции фотосинтеза. Она является основной составной частью оболочки растительных клеток; отсюда происходит ее название -- целлюлоза («целлула» -- клетка). Волокна хлопка -- это почти чистая целлюлоза (до 98%). Волокна льна и конопли тоже состоят главным образом из целлюлозы. В древесине ее содержится примерно 50%.
Получение: Образцом почти чистой целлюлозы является вата, полученная из очищенного хлопка. Основную массу целлюлозы выделяют из древесины, в которой она содержится вместе с другими веществами. Наиболее распространенным методом получения целлюлозы в нашей стране является так называемый сульфитный. По этому методу измельченную древесину в присутствии раствора гидросульфита кальция Ca(HSO3)2 или «гидросульфита натрия NaHSO3 нагревают в автоклавах при давлении 0,5-- 0,6 МПа и температуре 150 "С. При этом все другие вещества разрушаются, а целлюлоза выделяется в сравнительно чистом виде. Ее промывают водой, сушат и направляют на дальнейшую переработку, большей частью на производство бумаги.
Физические свойства. Целлюлоза -- волокнистое вещество, нерастворимое ни в воде, ни в обычных органических растворителях. Растворителем ее является реактив Швейцера -- раствор гидроксида меди (II) с аммиаком, с которым она одновременно и взаимодействует.
Химические свойства:
1) Гидролиз:
H+, t
(C6H10O5)n + nH2O → nC6H12O6.
глюкоза
2) Образование сложных эфиров с азотной и уксусной кислотами:
(C6H7O2(OH)3)n + 3nCH3COOH → (C6H7O2(OCOCH3)3)n + nH2O
 целлюлоза целлюлоза
| + 3n HNO3 | H2SO4 ––––® | 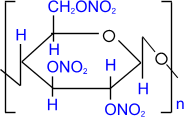 тринитрат целлюлозы тринитрат целлюлозы
| + 3n H2О |
Применение. Целлюлоза используется человеком с очень древних времен. Ее применение весьма разнообразно. Большое значение имеют продукты этерификации целлюлозы. Так, например, из ацетилцеллюлозы получают ацетатный шелк. Для этого триацетилцеллюлозу растворяют в смеси дихлорметана и этанола. Образовавшийся вязкий раствор продавливают через фильеры -- металлические колпачки с многочисленными отверстиями (рис. 36). Тонкие струи раствора опускаются в шахту, через которую противотоком проходит нагретый воздух. В результате растворитель испаряется и триацетил целлюлоза выделяется в виде длинных нитей, из которых прядением изготовляют ацетатный шелк Ацетил целлюлоза идет также на производство негорючей пленки и органического стекла, пропускающего ультрафиолетовые лучи. Тринитроцеллюлоза (пироксилин) используется как взрывчатое вещество и для производства бездымного пороха. Для этого тринитроцеллюлозу растворяют в этил-ацетате или в ацетоне. После испарения растворителей компактную массу размельчают и получают бездымный порох. Динитроцеллюлоза (коллоксилин) применяется также для получения коллодия. В этих целях ее растворяют в смеси спирта и эфира. После испарения растворителей образуется плотная пленка -- коллодий, применяемый в медицине. Динитроцеллюлоза идет также на производство пластмассы целлулоида. Его получают путем сплавления ди-нитроцеллюлозы с камфорой.
Целлюлоза (клетчатка) -- основное вещество растительных клеток. Древесина на 50% состоит из целлюлозы, а хлопок и лен -- это практически чистая целлюлоза.
Целлюлоза представляет собой твердое волокнистое вещество, нерастворимое в воде, но растворимое в аммиачном растворе гидроксида меди (II) (реактиве Швейцера).
Целлюлоза -- природный полимер. В отличие от крахмала, ее молекулы состоят только из линейных цепей, содержащих остатки р-глюкозы, которые связаны через первый и четвертый углеродные атомы.
Контроль знаний:
1.Какой дисахарид лежит в нашей сахарнице?
2.Почему жизнь на Земле основана на углероде?
3. Какие вещества относятся к углеводам? Как классифицируют углеводы и почему?
4. Какие характерные химические свойства глюкозы и крахмала.
5. Приведите примеры значения углеводов.
6.Составьте уравнение реакций, при которых сахарозу можно превратить в этанол?
7. Изобразите известные вам процессы брожения глюкозы и укажите их практическое значение.
8.Вычислите, какой объём (в л.) оксида углерода (IV) образуется при окислении 0,25 моль сахарозы.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр.146-152,153-156,157-161,162-165,пересказ конспекта лекции №13.
Лекция № 14.
Тема: Амины. Понятие об аминах. Анилин как ароматический амин, органическое основание. Взаимное влияние атомов в молекуле анилина: ослабление основных свойств и взаимодействие с бромной водой. Применение анилина на основе свойств.
Аминокислоты. Получение аминокислот из карбоновых кислот и гидролизом белков. Химические свойства аминокислот как амфотерных органических соединений: взаимодействие со щелочами, кислотами и друг с другом (реакция поликонденсации). Пептидная связь и полипептиды. Применение аминокислот на основе свойств.
Белки. Получение белков реакцией поликонденсации аминокислот. Первичная, вторичная и третичная структуры белков. Химические свойства белков: горение, денатурация, гидролиз и цветные реакции. Биохимические функции белков. Генетическая связь между классами органических соединений.
Основные понятия и термины по теме: классификация аминокислот и структуры белков, изомерия. характеристика представителей, химические свойства, качественные реакции.
План изучения темы
(перечень вопросов, обязательных к изучению):
1.Понятие об аминах. Анилин как ароматический амин, органическое основание.
2.Способы получения аминокислот.
3.Химические свойства аминокислот как амфотерных органических соединений.
4.Применение аминокислот.
5.Получение белков реакцией поликонденсации аминокислот
6.Первичная, вторичная и третичная структуры белков.
7.Качественные реакции на белки.
8.Биохимические функции белков.
9.Генетическая связь между классами органических соединений.
Содержание лекции:
Дата добавления: 2016-01-26; просмотров: 13062;
