СИНТЕЗ МЕТИЛОВОГО СПИРТА
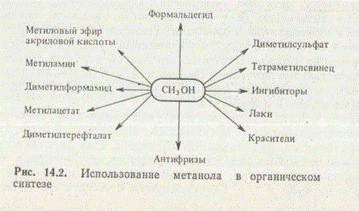
Метиловый спирт (метанол, СН3ОН) — важное соединение для получения многих продуктов (рис. 2). В чистом виде применяется в качестве растворителя и используется как высокооктановая добавка к моторному топливу.
| |
В настоящее время синтез на основе оксида углерода и водорода является главным методом производства метанола. Синтез метилового спирта по физико-химическим условиям его проведения по технологическому оформлению аналогичен процессу синтеза аммиака. Взаимодействие смеси тщательно очищенных газов происходит при высоких давлениях и температуре в присутствии катализаторов. Из-за малого выхода конечного (продукта процесс является циклическим. Процесс проводят при 620—680 К, 10—30 МПа и объемной скорости 35 000–40 000 ч–1 на цинкхромовом катализаторе (ZnO + Сг2О3) или при 490—570 К, 5—10 МПа и 8000–10 000 ч–1 на низкотемпературных медьсодержащих катализаторах (CuO + ZnO + Al2O3 или CuO + ZnO + Cr2O3). Медьсодержащие катализаторы значительно уступают цинкхромовым по стойкости; благоприятно сказывается на их активности присутствие в газе небольших количеств СО2. Выход метанола за один цикл составляет около 4%.
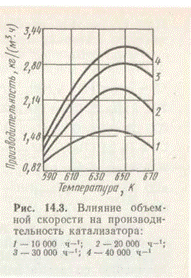
При увеличении объемной скорости степень превращения исходной смеси за один проход уменьшается, но при циклической схеме с рециркуляцией газов количество получаемого метилового спирта возрастает, так как степень превращения снижается медленнее, чем увеличивается объемная скорость (рис. 3).
| |
Для синтеза используется смесь газов при соотношении от 1:4 ; до 1:8. Образование метанола протекает по обратимой экзотермической реакции
СО + 2Н2 D СН3ОН, ΔН = –11кДж
Константа равновесия падает с повышением температуры.
При низких температурах, когда равновесие достаточно сильно смещено в сторону метанола, реакция протекает крайне медленно. При уменьшении давления или увеличения температуры сверх оптимальной могут протекать побочные реакции:
СО + 3Н2 D СН4 + Н2О, ΔН = –209 кДж (а)
2СО + 2Н2 D СН4 + СО2, ΔН = – 252 кДж (б)
2СО DСО2 +С (в)
СО + Н2 D СН2О, ΔН = – 8,4 кДж (г)
2СН3ОН D (СН3)2О + Н2О (Д)
nСО + 2nН2 ® СnН2n+1ОН + (n – 1) Н2О (e)
СН3ОН + Н2 ® СН4 + Н2О (ж)
Количество тех или иных побочных соединений зависит также от состава реакционной смеси, селективности и состояния катализатора. Наиболее существенной примесью является метан. По сравнению со всеми побочными процессами (а) — (ж) получение метанола идет с максимальным уменьшением объема, поэтому в соответствии с принципом Ле Шателье повышение давления сдвигает равновесие в сторону образования метилового спирта.
Ввиду высокой экзотермичности реакции и необходимости точного регулирования температуры, повышение которой отрицательно сказывается как на равновесии, так и на избирательности процесса, в реакционных аппаратах обычно предусматривается ввод холодного синтез-газа в пространство между полками, на которых размещен катализатор. Для предохранения реакторов синтеза от водородной коррозии, а также для уменьшения образования пентакарбонила железа, который при термическом разложении выделяет мелкодисперсное железо, катализирующее побочные реакции, реакционные устройства выполняют из легированной стали.
Технологическая схема производства метанола приведена на рис. 4.
| |
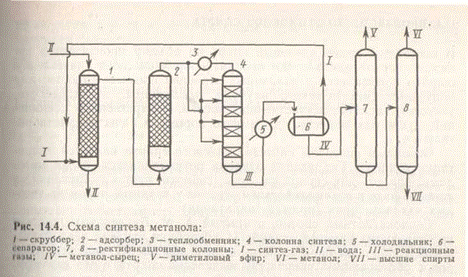
Синтез-газ под давлением 1—2 МПа поступает на водную очистку от диоксида углерода в скруббер 1. После скруббера газ дожимается до нужного давления, очищается в адсорбере 2, заполненном активированным углем, от пентакарбонила железа и разделяется на два потока. Один поток подогревается в теплообменнике 3 и подается в полочную колонну синтеза 4, другой в холодном состоянии направляется в распределители газа между слоями катализатора. Каждая полка (слой катализатор) работает в адиабатическом режиме, а весь аппарат — со ступенчатым охлаждением газа. Применяют также трубчатые аппараты с непрерывным отводом теплоты реакции для подогрева газа в межтрубном пространстве, работающие при политермическом режиме.
Реакционные газы охлаждаются в холодильнике 5 и поступают в сепаратор 6, где конденсат отделяется от непрореагировавших газов, которые возвращаются в процесс. Конденсат, представляющий собой метанол-сырец, направляется в ректификационную колонну 7, с верха которой отгоняется диметиловый эфир, который получается в колонне синтеза по реакции (д). Кубовая жидкость из колонны 7 поступает в колонну 8. В качестве дистиллята в этой колонне отбирается метанол с водой. Затем метанол отгоняется от воды острым паром. Из куба колонны 8 отводится смесь высших спиртов. Общий выход метанола составляет 85—95%.
Газовые выбросы в производстве метанола в основном составляют продувочные газы из емкостей, а также газы и пары, выделяющиеся из метанола сырца на стадии дистилляции. Газовые выбросы сжигают в котельных установках для получения пара.
Сточные воды в производстве метанола — это воды от промывки шламов и емкостей вместе с отходами на стадии очистки метанола. В сточных водах содержится до 0,3% метанола и других кислородных соединений углерода. Полная очистка сточных вод достигается при их биологической обработке в аэротенках с активным илом.
ПРОИЗВОДСТВО ЭТИЛОВОГО СПИРТА
В настоящее время этиловый спирт по объему производства занимает первое место среди продуктов органического синтеза. Он широко применяется в различных отраслях промышленности: для получения синтетического каучука, целлулоида, ацетальдегида, уксусной кислоты, искусственного шелка, лекарственных соединений, душистых веществ, бездымного пороха, в качестве растворителя и т. п.
Основным способом синтеза этилового спирта является гидратация этилена. Гидратация этилена осуществляется двумя методами: при помощи серной кислоты (сернокислотная гидратация) в жидкой фазе и взаимодействием этилена с водяным паром на твердых катализаторах (прямая гидратация).
Сернокислотный способ, открытый А. М. Бутлеровым, состоит из следующих четырех стадий: 1) абсорбция этилена серной кислотой с образованием сернокислотных эфиров; 2) гидролиз эфиров с образованием спирта; 3) выделение спирта и его ректификация; 4) концентрирование серной кислоты.
Взаимодействие между этиленом и серной кислотой состоит из двух этапов: первый — физическое растворение этилена в серной кислоте и второй — гомогенное взаимодействие обоих компонентов с образованием алкилсульфатов:
CH2=CH2 + HOSО2OH D CH3CH2OSO2OH
C2H5OSO3H + С2Н4 D (C2H5O)2SO2
При умеренных температурах реакция практически необратима, но при нагревании равновесие смещается влево. Оптимальная температура процесса 340—350 К.
Гидролиз этил- и диэтилсульфата протекает по уравнениям: C2H5OSO3H + Н2О D С2Н5ОН + H2SO4
(C2H5O)2SO2 + 2Н2О D 2C2H5OH + H2SO4
Кроме основных реакций идет образование диэтилового эфира, ацетальдегида, а также наблюдается полимеризация этилена. Температура гидролиза поддерживается в пределах 370—380 К. Время гидролиза ~30 мин.
Для получения 1 т спирта на абсорбцию идет около 2 т концентрированной серной кислоты, а затем приходится упаривать ~4 т разбавленной кислоты. Такой кислотооборот осложняет производство и вызывает значительные трудности из-за сильной коррозии и тяжелых условий труда. По сернокислотному методу из 1 т этилена вырабатывается 1,2 т спирта-ректификата и около 100 кг этилового эфира. Превращение этилена в спирт достигает 90%.
Более экономичным способом является прямая каталитическая гидратация этилена перегретым водяным паром. Процесс основан на обратимой реакции, протекающей с уменьшением объема и выделением теплоты:
СН2=СН2(Г) + Н2О(Г) D С2Н5ОН(Г), ΔН= –46 кДж
Константа равновесия этой реакции уменьшается с ростом температуры и повышается пропорционально давлению. Равновесие может быть сдвинуто в сторону образования спирта применением высокого давления и понижением температуры. Однако применение высокого давления повышает себестоимость спирта, а низкие температуры снижают скорость реакции.
Высокие скорость реакции и степень конверсии этилена обеспечивают проведением процесса в оптимальных условиях: температура 550—590 К, давление 7—8 МПа, объемная скорость парогазовой смеси 1800—2500 ч–1.
Вследствие невысокой степени конверсии этилена за один цикл (4—5%) процесс проводят по циркуляционной схеме. В качестве катализатора используют фосфорную кислоту, нанесенную на пористые носители (силикагель, алюмосиликат). Катализ осуществляется в пленке кислоты, находящейся на поверхности пористого носителя в жидком состоянии.
Скорость реакции повышается с ростом парциального давления этилена; такое же действие оказывает парциальное давление водяных паров, но до некоторого предела. Объясняется это тем, что пленка фосфорной кислоты на носителе абсорбирует воду из газовой фазы и при повышении давления водяных паров концентрация фосфорной кислоты снижается.
Оптимальное молярное соотношение Н2О : С2Н4 = 0,6 : 1.
Способ рекуперации теплоты обратного потока существенно отражается на экономике производства. Исходную парогазовую смесь можно приготовить по двум схемам: с использованием пара высокого давления 10 МПа и с применением трубчатой печи.
Технологическая схема приведена на рис. 5. Рециркулирующий газ смешивается со свежим этиленом, проходит теплообменники 2, 3 иподогреватель 4, смешивается в заданном соотношении с паром высокого давления и подается в реактор гидратации, который представляет собой цилиндрическую колонну с зернистым катализатором, футерованную красной медью или угольными брикетами. Подогрев газа в аппаратах 2, 3 производится за счет теплоты потока, выходящего из гидрататора 5, а в аппарате 4 глухим паром.
| |
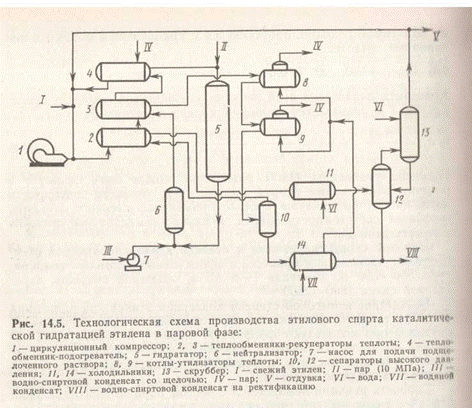
Реакционная смесь, выходящая из реактора с температурой 580 К, нейтрализуется и охлаждается до 510 К путем впрыска в нее подщелоченного водно-спиртового конденсата (ВСК), охлаждается до 420 К в теплообменнике 3, котлах-утилизаторах 8, 9 и поступает в сепаратор 10. Газ из сепаратора 10 через теплообменник 2 и холодильник 11 поступает в сепаратор 12, затем в скруббер 13, где из него при температуре 310 К водой отмывается несконденсировавшийся спирт. ВСК из сепараторов 10 и 12 передается в отделение ректификации.
Для сохранения активности катализатора в исходную смесь непрерывно добавляют небольшое количество фосфорной кислоты.
Дата добавления: 2016-01-20; просмотров: 2182;
