Примеры решения задач. Пример 45.Электрон в атоме водорода перешел с четвертого энергетического уровня на второй
Пример 45.Электрон в атоме водорода перешел с четвертого энергетического уровня на второй. Определить энергию испущенного при этом фотона.
Решение. Для определения энергии фотона воспользуемся формулой для водородоподобных ионов:
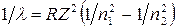 , (1)
, (1)
где λ – длина волны; R – постоянная Ридберга; Z – заряд ядра в относительных единицах (при Z=1 формула переходит в серийную формулу для водорода); n1 – номер орбиты, на которую перешел электрон;n2 – номер орбиты, с которой перешел электрон (n1 и n2 - главные квантовые числа).
Энергия фотона ε выражается формулой
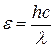 , (2)
, (2)
Поэтому, умножив обе части равенства (1) на hc, получим выражение для энергии фотона
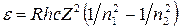 .
.
Так как Rhc есть энергия ионизации Еi атома водорода, то
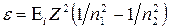 .
.
Вычисление выполним во внесистемных единицах:
Еi=13,6 эВ; Z=1; n1=2; n2=4:
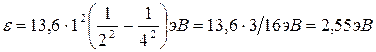
Пример 46.При соударении α-частицы с ядром бора 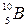 произошла ядерная реакция, в результате которой образовалось два новых ядра. Одним из этих ядер было ядро атома водорода
произошла ядерная реакция, в результате которой образовалось два новых ядра. Одним из этих ядер было ядро атома водорода 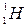 Определить порядковый номер и массовое число второго ядра, дать символическую запись ядерной реакции и определить ее энергетический эффект.
Определить порядковый номер и массовое число второго ядра, дать символическую запись ядерной реакции и определить ее энергетический эффект.
Решение. Обозначим неизвестное ядро символом 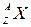 . Так как α-частица представляет собой ядро гелия
. Так как α-частица представляет собой ядро гелия 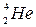 , запись реакции имеет вид
, запись реакции имеет вид
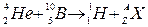
Применив закон сохранения числа нуклонов, получим уравнение 4+10= 1 +А, откуда А = 13. Применив закон сохранения заряда, получим уравнение 2 + 5 = 1+Z, откуда Z = 6. Следовательно, неизвестное ядро является ядром атома изотопа углерода 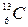 .
.
Теперь можем записать реакцию в окончательном виде:
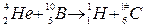
Энергетический эффект Q ядерной реакции определяется по формуле
Q=931[(mHe + mB)-(mH + mC)].
Здесь в первых круглых скобках указаны массы исходных ядер, во вторых скобках — массы ядер — продуктов реакции. При числовых подсчетах по этой формуле массы ядер заменяют массами нейтральных атомов. Возможность такой замены вытекает из следующих соображений.
Число электронов в электронной оболочке нейтрального атома равно его зарядовому числу Z. Сумма зарядовых чисел исходных ядер равна сумме зарядовых чисел ядер — продуктов реакции. Следовательно, электронные оболочки ядер гелия и бора содержат вместе столько же электронов, сколько их содержат электронные оболочки ядер углерода и водорода.
Очевидно, что при вычитании суммы масс нейтральных атомов углерода и водорода из суммы масс атомов гелия и бора массы электронов выпадут, и мы получим тот же результат, как если бы брали массы ядер. Подставив массы атомов (см. табл. 10 Приложения) в расчетную формулу, получим
Q=931(4,00260+10,01294)-(1,00783+13,00335) МэВ = = 4,06 МэВ.
Пример 47.Вычислить дефект массы и энергию связи ядра 
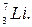
Решение. Масса ядра всегда меньше суммы масс свободных (находящая вне ядра) протонов и нейтронов, из которых ядро образовалось. Дефект массы ядра Δm и есть разность между суммой масс свободных нуклонов (протонов и нейтронов) и массой ядра, т. е.
Δm =Zmp+(A-Z)mn-mя (1)
где Z — атомный номер (число протонов в ядре) ; А — массовое число (число нуклонов, составляющих ядро); mр, mn , mя — соответственно массы протона, нейтрона и ядра.
В справочных таблицах всегда даются массы нейтральных атомов, но не ядер, поэтому формулу (1) целесообразно преобразовать так, чтобы в нее входила масса mянейтрального атома. Можно считать, что масса нейтрального атома равна сумме масс ядра и электронов, составляющих электронную оболочку атома: mа=mя + Zme, откуда
Mя=mа – Zme (2)
Выразив в равенстве (1) массу ядра по формуле (2), получаем
Δm =Zmp+(A-Z)mn- mа + Zme , или Δm=Z(mp +me )+(А –Z) mn - mа
Замечая, что mр-mе = mн, где mн - масса водорода, окончательно находим
Δm=Zmн+(А-Z) mn - mа . (3)
Подставив в выражение (3) числовые значения масс (см. табл. 12 и 13 Приложения), получим
Δm = [3·1,00783+(7-3) · 1,00867-7·0,1601] а. е. м =0,04216 а.е. м.
В соответствии с законом пропорциональности массы и энергии
Е =Δ тс2,(4)
где с - скорость света в вакууме.
Коэффициент пропорциональности с2 может быть выражен двояко:
с2=9·1016 м2/с2, или с2=ΔЕ/ Δm=9·1016Дж/кг
Если вычислить энергию связи, пользуясь внесистемными единицами, то с2 = 931 МэВ/а. е. м. С учетом этого формула (4) примет вид
Е=931Δm(МэВ). (5)
Подставив найденное значение дефекта массы ядра в формулу (5), получим
Е = 93 1 • 0,042 1 6 МэВ = 39,2 МэВ.
Примечание. Термин «дефект массы» часто применяют в другом смысле: дефектом массы Δm называют разность между массой нейтрального атома данного изотопа и его массовым числом А: Δ = mа — А. Эта величина особого физического смысла не имеет, но ее использование позволяет в ряде случаев значительно упростить вычисления. В настоящем пособии всюду имеется в виду дефект массы Δmα, определяемый формулой (1).
Пример 48. Определить начальную активность А0 радиоактивного препарата магния 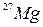 массой m=0,2 мкг, а также его активность А через время t=6 ч. Период полураспада
массой m=0,2 мкг, а также его активность А через время t=6 ч. Период полураспада 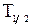 магния считать известным.
магния считать известным.
Решение.Активность А изотопа характеризует скорость радиоактивного распада и определяется отношением числа dN ядер, распавшихся за интервал времени dt, к этому интервалу:
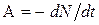 (1)
(1)
Знак «-» показывает, что число N радиоактивных ядер с течением вр6емени убывает.
Для того чтобы найти 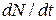 , воспользуемся законом радиоактивного распада:
, воспользуемся законом радиоактивного распада:
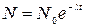 , (2)
, (2)
где N- число радиоактивных ядер, содержащихся в изотопе, в момент времени t; N0- число радиоактивных ядер в момент времени, принятый за начальный (t=0);λ- постоянная радиоактивного распада.
Продифференцируем выражение (2) по времени:
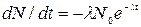 (3).
(3).
Исключим из формул (1) и (2) dN/dt, находим активность препарата в момент времени t:
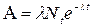 (4)
(4)
Начальную активность А0 препарата получим при t=0:
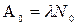 (5)
(5)
Постоянная полураспада λ связана с периодом полураспада Т1/2 соотношением
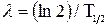 (6)
(6)
Число N0 радиоактивных ядер, содержащихся в изотопе, равно произведению постоянной Авогадро NА на количество вещества ν
Данного изотопа:
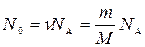 , (7)
, (7)
где m- масса изотопа; М- молярная масса.
С учетом выражений (6) и (7) формулы (5) и (4) принимают вид
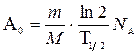 (8),
(8),
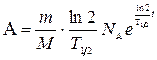 (9).
(9).
Произведем вычисления, учитывая, что Т1/2=600с ( см табл. 13 Приложения), ln2=0,693; t=6 ч = 2,16·104с:
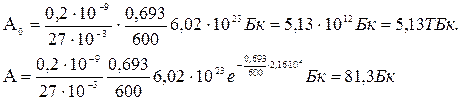
Дата добавления: 2016-01-20; просмотров: 1973;
