Внутренняя энергия идеального газа.
В идеальном газе взаимодействием молекул пренебрегают, поэтому под внутренней энергией идеального газа подразумевают только кинетическую энергию хаотичного теплового движения молекул. Кинетическая энергия одной молекулы идеального газа
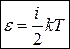 , (22)
, (22)
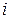 - число степеней свободы молекулы. Одноатомная молекула газа имеет три степени свободы (ее положение в пространстве описывается тремя координатами, например, x,y,z). Двухатомная молекула газа имеет 5 степеней свободы (3 координаты определяют положение центра масс молекулы и описывают ее поступательное движение, 2 угла описывают вращательное движение молекулы). Многоатомная молекула, подобно твердому телу, имеет 6 степеней свободы (3 координаты определяют поступательное движение молекулы как целого, и 3 угла - ее вращение). Т.к. колебательное движение молекулы газа характеризуется большой энергией возбуждения, то при обычных температурах этот вид движения не проявляется.
- число степеней свободы молекулы. Одноатомная молекула газа имеет три степени свободы (ее положение в пространстве описывается тремя координатами, например, x,y,z). Двухатомная молекула газа имеет 5 степеней свободы (3 координаты определяют положение центра масс молекулы и описывают ее поступательное движение, 2 угла описывают вращательное движение молекулы). Многоатомная молекула, подобно твердому телу, имеет 6 степеней свободы (3 координаты определяют поступательное движение молекулы как целого, и 3 угла - ее вращение). Т.к. колебательное движение молекулы газа характеризуется большой энергией возбуждения, то при обычных температурах этот вид движения не проявляется.
Внутренняя энергия идеального газа, состоящего из 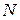 молекул, равна
молекул, равна
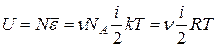 , или
, или
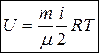 . (23)
. (23)
Изменение 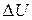 внутренней энергии идеального газа определяется изменением
внутренней энергии идеального газа определяется изменением 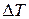 его температуры и не зависит от вида термодинамического процесса.
его температуры и не зависит от вида термодинамического процесса.
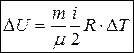 . (24)
. (24)
2. Работа 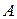 , совершаемая при расширении вещества.
, совершаемая при расширении вещества.
При малом изменении 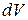 объема вещества совершается работа против внешних сил
объема вещества совершается работа против внешних сил
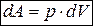 ,
,
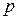 - давление вещества. Работа, совершаемая при изменении объема от
- давление вещества. Работа, совершаемая при изменении объема от 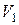 до
до 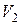 ,
,
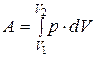 , (25)
, (25)
и зависит от вида термодинамического процесса.
При изотермическом процессе в идеальном газе, когда Т=const,
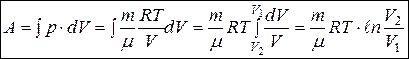 .
.
При изобарном процессе, когда p=const,
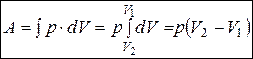 .
.
При изохорном процессе, при V=const , 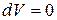 и
и 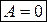 .
.
Теплота Q.
При нагревании вещества, когда не происходит изменения его агрегатного состояния, подводимое количество теплоты 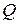 пропорционально изменению
пропорционально изменению 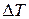 температуры вещества, что записывают либо в виде
температуры вещества, что записывают либо в виде
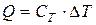 , или в виде
, или в виде 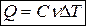 , или
, или 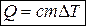 . (26)
. (26)
При малом изменении состояния системы, соответственно,
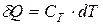 , или
, или 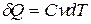 , или
, или 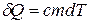 ,
,
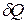 - теплота, вызывающая малое изменение
- теплота, вызывающая малое изменение 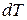 температуры тела.
температуры тела.
Коэффициенты пропорциональности
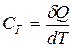 - теплоемкость тела,
- теплоемкость тела,
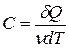 - молярная теплоемкость вещества,
- молярная теплоемкость вещества,
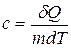 - удельная теплоемкость вещества.
- удельная теплоемкость вещества.
Т.к. число молей 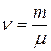 , то
, то 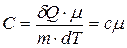 .
.
Молярная и удельная теплоемкости зависят от природы вещества, температуры и от вида термодинамического процесса. Теплоемкость тела зависит также от его массы. Твердые тела и жидкости обычно характеризуют удельной теплоемкостью, а газы – молярной.
При изменении агрегатного состояния вещества: плавлении (кристаллизации), кипении (конденсации), когда подводимое тепло тратится на разрыв связей между молекулами и изменения температуры вещества не происходит, теплоту 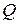 записывают в виде:
записывают в виде:
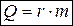 , или
, или 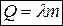 , (27)
, (27)
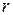 - удельная теплота кипения и
- удельная теплота кипения и 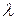 - удельная теплота плавления вещества.
- удельная теплота плавления вещества.
Дата добавления: 2016-01-20; просмотров: 1347;
