Периодический закон и периодическая система элементов Д.И. Менделеева в свете учения о строении атома.
1. Открытие периодического закона
Работы французского химика А. Лавуазье, шведского химика и минеролога Яна Берцелиуса (деление химических элементов на металлы и неметаллы), а также немецкого химика Деберейнера (объединение некоторых элементов по сходству в триады Li, Na, K, Ca, Sr, Ba) подготовили почву для открытия Д.И. Менделеевым периодического закона.
За основную характеристику химических элементов Менделеев взял количественную характеристику элемента - атомную массу Ar. В 1869 г. сформулировал периодический закон и сделал І вариант периодической системы (длинная форма), в которую входили 63 химических элемента, известных на то время.
Периодический закон - свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от их атомного веса.
В 1870 г. Д. И. Менделеев публикует ІІ вариант периодической системы (короткий), более похожей на современный классический.
После открытия теории о строении атома формулировка периодического закона изменилась. Современная формулировка периодического закона:
Периодический закон – свойства элементов, а также формы и свойства их соединений находящихся в периодической зависимости от величин заряда ядра.
2. Структура периодической системы.
Система состоит из периодов:
Период- горизонтальный ряд элементов, расположенных по возрастанию Ar,
Начинается типичным Ме (щелочным) и заканчивается благородным газом.
Периоды делятся на малые – 1, 2, 3 и большие – 4, 5, 6, 7.
По периоду свойства элементов изменяются
 | |||
 |
 Ме свойства, НМе свойства
Ме свойства, НМе свойства
R атома Заряд ядра атома
Число энергетического уровня
Электроотрицательность
Электроотрицательность - способность атома элемента притягивать электроны, участвующие в образовании химической связи.
Группа - вертикальный ряд химических элементов, обладающих одинаковой валентностью в высших окcидах.(на пример: в первой группе валентность элементов в высшем оксиде = 1). В периодической системе VІІІ групп.
Группы делятся на: главную (А) и побочную (Б) подгруппы.
 В группе (главной подгруппе) Ме свойства , НМе , Число энергетических уровней ↑ , электроотрицательность ↓ .
В группе (главной подгруппе) Ме свойства , НМе , Число энергетических уровней ↑ , электроотрицательность ↓ .
[№ группы = Число электронов внешнего уровня = валентности в высшем оксиде = высшей положительной степени окисления элемента]
3. Строение атома.
Начало XX в. - экспериментально доказано, что атом делим.
В 1911 г. Резерфорд предлагает модель строения атома: в центре располагается плотное положительно заряженное ядро, окруженное электронами.
Определение «атома» следующее: атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательных частиц электронов.
Дальнейшие исследования показали, что ядро также делится на : нейтроны (n0) и протоны (р+).
[число протонов = порядковому № химического элемента = число электронов = заряд ядра атома]
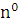 = Ar – Z , где
= Ar – Z , где 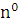 - число нейронов, Ar - атомная масса, Z - порядковый №
- число нейронов, Ar - атомная масса, Z - порядковый №
 с 6ē; 6р+, 6
с 6ē; 6р+, 6 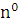
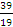 к 19ē; 19р+, 20
к 19ē; 19р+, 20 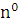
1913 г. Нильс Бор (датский физик) высказал предположение, что состояние электрона в атоме объясняется с позиции квантовой теории излучения.
«Электроны двигаются вокруг ядра по разрешенной орбите, каждой орбите соответствует определенная энергия электрона, поэтому говорят об энергетическом уровне электрона.
Электрон, находящийся на І энергетическом уровне, обладает наименьшим запасом энергии, что соответствует самому устойчивому состоянию атома.
Если электрон, поглотив энергию, переходит на более удаленную от ядра орбиту, то это означает переход атома из основного состоянии в возбужденное».
Max число электронов на 1 энергетическом уровне = 2 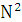 , где N – номер энергетического уровня.
, где N – номер энергетического уровня.
На 1-м уровне  = 2ē
= 2ē
На 2-м уровне 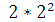 = 8 ē
= 8 ē
На 3-м уровне 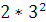 = 18 ē
= 18 ē
Вероятность нахождения электрона далеко от ядра атома мала, и ей можно пренебречь. (1926 г. австрийский физик - Шредингер)
Область в пространстве, в которой вероятность пребывания электрона максимальна (90%) называется – орбиталью.
Существуют s, p, d, f - орбитали.
Состояние электрона в атоме характеризуется 4-мя квантовыми числами .
n - главное квантовое число
е - орбитальное (побочное) квантовое число
ml – магнитное квантовое число
ms – спиновое квантовое число.
4. Квантовые числа.
1. Главное квантовое число - характеризует энергию электрона в атоме или определяет энергетический уровень электрона в атоме.
n- 1, 2, 3, 4… энергетические уровни
K L M N энергия электрона возрастает

2. Орбитальное квантовое число – определяет форму орбитали в пространстве.
l= 0, 1, 2….(n-1)
если n=3, то l= 0, 1, 2
форма орбитали – s p d




одна или несколько орбиталей с одинаковым значением главного и побочного квантового числа называется подуровнем.
Если n =1, орбиталь обозначается 1s, (и говорят, что 1-й энергетический уровень состоит из 1s – подуровня)
Если n= 2, то орбитали 2s и 2p (второй энергетический уровень состоит из 2s и 2p подуровней)
3. Магнитное квантовое число - определяет ориентацию орбитали в пространстве.
ml = +l,0,- l
если l=1, ml = +1,0,-1 (всего 3-и ориентации Px; Py; Pz;)
4. Спиновое квантовое число - характеризует угловой момент импульса электрона, поскольку ему характерно вращение вокруг собственной оси (спин)
ms= +1/2 и - 1/2
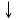

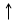
 Спин электрона
Спин электрона
 |
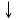 Если , то суммарный спин электронов = 0, т.к. +1/2 - 1/2
Если , то суммарный спин электронов = 0, т.к. +1/2 - 1/2

| 
| 
|
∑ = 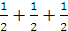 = 3/2
= 3/2
Принципы заполнения атомных орбиталей
1. Запрет Паули: в атоме не может быть 2х электронов с одинаковым значением всех квантовых чисел.

| 
| 
|
2. Правило Гунда: электроны в пределах данного подуровня располагаются так, чтобы суммарное спиновое число их было максимально.
3. Принцип наименьшей энергии: электроны на атомных орбиталях размещены в порядке возрастания их энергии, до тех пор, пока на данном энергетическом уровне не разместится максимальное число электронов.
|
S= 2ē
|  
|  
|
P= 6ē
|  
|  
|   
|  
|
d= 10ē
f= 14ē
 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
4. Правило Клечковского: заполнение подуровней происходящих в порядке увеличения суммы (n+l) сначала 4s (4+0) затем 3d (3+2).
Если (n+l) одинаковы, то сначала заполняется с меньшим значением n.
Написание электронных формул: 1 энергетический уровень = 2ē
№ периода совпадает с числом энергетического уровня.
|
1H электронная формула 1S1 , графическая формула
Существует проскок электрона у следующих d – элементов: Cr, Cu, Nb, Mo, Ru, Rh, Pd (двойной проскок), Ag, Pt, Au.
Лекция №2
Тема: Химическая связь и строение молекул.
План:
1. Виды химической связи:
а) ковалентная связь и механизм ее образования.
б) ионная связь
в) водородная связь
г) металлическая связь
2. Характеристики химической ковалентной связи.
3. Типы кристаллических решеток.
Все многочисленные химические процессы в результате перегруппировки атомов, сопровождающихся разрывом старых химических связей и образованием новых.
Химическая связь- это совокупность сил, действующих между атомами или группой атомов.
При рассмотрении химической связи используют понятие «валентность»
Валентность – это способность атома элемента образовывать химическую связь.
Химическая связь осуществляется за счет валентных ẽ (тех, которые участвуют в образовании связи = № группы).
У s- и р – элементов – валентным являются электроны внешней оболочки, у dэлементов – это S – электроны внешней и d – электроны предвнешней оболочек.
Описать химическую связь, значит выяснить, как распределяется электронная плотность в молекуле. В зависимости от этого различают ковалентную , ионную, металлическую и (водородную) связи.
Ковалентная связь- (атомная) – это химическая связь, осуществляемая за счет образования общих электронных пар, принадлежащим обоим атомам. HMe – HMe.
Сущность ковалентной связи заключается в том, что соединяющиеся атомы восполняют свои наружные электронные слои до завершения электронной оболочки.
Пример:
Молекула Cl2 17Cl 3s23p3 (в наружной оболочке 7 ē)
• • • • • • • •
: Cl • + • Сl : → : Cl • • Cl : образуется 1 общая электронная пара
• • • • • • • •
Молекула N2 7N 2s22p3 (в наружной оболочки 5 ē)
 • • • •
• • • •

 : N • + • N : → : N • • N : образуется 3 общие электронные пары
: N • + • N : → : N • • N : образуется 3 общие электронные пары
• • • •
Ковалентную связь в зависимости от электроотрицательности атомов подразделяют на полярную и неполярную.
Ковалентная неполярная вязь – между атомами одинаковыми по значению электроотрицательности. ( N2, O2, Cl2, H2, BCl3, CCl4, CS2)
Ковалентная полярная - между атомами, у которых электроотрицательность неодинакова и связующая электронная пара смещается к боле электроотрицательному атому. (H2O, H2S, HCl, N2O5, NH3 и все кислоты)
Пример:
HCl H • + • Cl → H : Cl Hδ+ → Clδ-
• • • •
NH3 • N • + 3H • → H : N : H Hδ+ → Nδ- ← H
• • • ↑
H H
Механизмы образования ковалентной связи:
а) обменный (N2, HCl)
 б) донорно-акцепторный (NH4+, H3O+)
б) донорно-акцепторный (NH4+, H3O+)
 Пример: NH3 + H+Cl- → NH4+Cl- H1s1 ↑ -ē → H+
Пример: NH3 + H+Cl- → NH4+Cl- H1s1 ↑ -ē → H+









 H + H 1s H +
H + H 1s H +
• • • • l • • l
 H : N: H + H+ → H : N : H H – N – H HOH + H+ → HOH
H : N: H + H+ → H : N : H H – N – H HOH + H+ → HOH
• • донор акцептор • • l



 H H H
H H H
ион аммония ион гидроксония
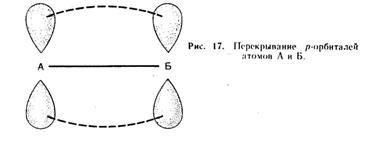
При образовании ковалентной химической связи перекрывание орбиталей может осуществляется разными способами. ( Это и определяет пространственную направленность ковалентной связи)
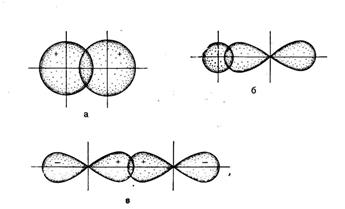
 В зависимости от способа перекрывания орбиталей и симметрии образующегося электронного облака, различают и П - связи.
В зависимости от способа перекрывания орбиталей и симметрии образующегося электронного облака, различают и П - связи.
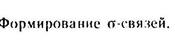
Характеристики ковалентной связи:
1. Направленность - обуславливает пространственную структуру молекулы.
(HCl- линейная, NH3 - пирамидальная, H2O - угловая)
2. Насыщаемость - способность атомов образовывать строго определенное число ковалентных связей. ( Зависит от числа неспаренных электронов в возбужденном состоянии атома).
Пример: Н-О-Н О=2 S=2 (H2S) SO2 (4) SO3 (6)
 нормальное состояние (ІІ)
нормальное состояние (ІІ)
 Валентная возможность S S* (ІV) и (VІ)
Валентная возможность S S* (ІV) и (VІ)
3. Длина связи - межъядерное расстояние между химически связанными атомами.
4. Энергия связи – та энергия, которая необходима для разрушения связи или ее образования.
Форма молекулы (пространственная структура или геометрия ), зависит от гибридизации орбиталей атома.
Гибридизация – смешение валентных орбиталей и выравнивание их по форме и энергии.
Различают sр3, sр2, sргибридизацию.
Пример:
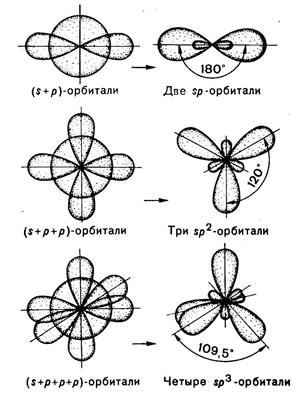
Ионная связь– химическая связь между ионами, осуществляемая электростатическим притяжением.
Ион - частица заряженная «+» или «-» (NaCl, AlCl3, CaF2,Al2 (SO4)3 -
Me-HMe)
В отличие от ковалентной связи ионная связь не обладает ни направленностью, ни насыщаемостью.
Ионная связь и ковалентная полярная – схожи, но будем считать, что ионная связь образуется, если электроотрицательность атомов элемента больше 1,7
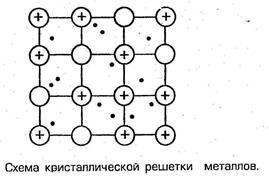
Металлическая связь – химическая связь, которая образуется между относительно свободным электроном и ионами Ме+.
Пример:
 Ме0 – ē → Ме+
Ме0 – ē → Ме+
атом ион
• - ē
 + - ион
+ - ион
 - атом
- атом
Водородная связь (межмолекулярная) - это связь, которая образуется между атомами водорода одной молекулы и атомом сильно электроотрицательного элемента (N, O, F) другой молекулы.
Типы кристаллических решеток.
В зависимости от природы составляющих частиц решетки делятся на ионные, атомные (ковалентные или металлические) и молекулярные.
Ионная решетка состоит из ионов противоположного знака (NaCl, KNO3, CaCl2) (высокая температура плавления)
Атомно-ковалентная решетка (прочность высокая температура плавления)– пример алмаз (С), SiO2 атомы С в состоянии sр3гибридизации связаны еще с четырьмя соседними атомами.
Металлическая кристаллическая решетка – атомы металлов, соединенные металлической связью. (ковкость, пластичность, электро- и теплопроводимость)
Молекулярная решетка (самая прочная) – в узлах кристаллической решетки молекулы.
N2, H2; Благородные газы Ne, Ar,CO2
| <== предыдущая лекция | | | следующая лекция ==> |
| Основные настройки фотоаппарата | | | ЛЕКЦИЯ 29. Развитие экономики. |
Дата добавления: 2016-01-20; просмотров: 4742;
