Работа в термодинамических процессах
Величина работы определяется, исходя из уравнения этого процесса j (Рu)=0 и уравнения политропы с постоянным показателем.
dw = -u×dP dl-dw=P×du+u×dP=d(Pu);
dl = P×du n=dw/dl, тогда dl(1-n)=d(Pu);
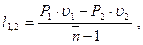 (3.50)
(3.50)
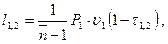 (3.51)
(3.51)
где 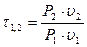 — характеристика расширения (сжатия) — величина соотношения начального и конечного значений потенциальной функции.
— характеристика расширения (сжатия) — величина соотношения начального и конечного значений потенциальной функции.
Сопоставляя уравнения процесса, потенциальной функции и уравнение состояния, имеем:
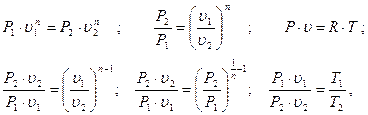
тогда получим:
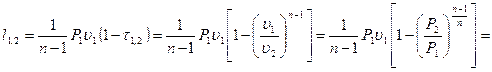
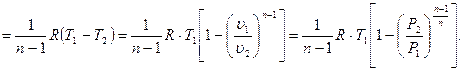 (3.52)
(3.52)
Потенциальная работа 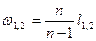 .
.
Для изотермического процесса
Соотношения между парамет
зависимости термодинами
| Наименование процесса | Уравнение процесса | Показатель политропы | Связь между параметрами | Термодинамическая работа |
| Политропный | PVn=idem | 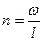
| 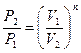
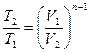
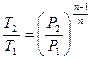
| 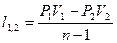 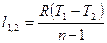
|
| Изобарный | P=idem | n = 0 | 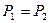
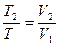
| 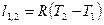
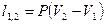
|
| Изохорный | V=idem | n = ±¥ | 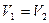
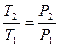
| 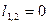
|
| Изотермический | PV=idem | n = 1 | 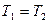
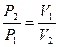
| 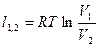
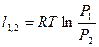
|
| Адиабатный | PVк=idem | n = к= 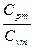
| 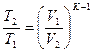
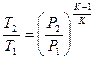
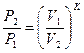
| 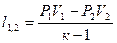 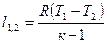
|
рами состояния, расчетные и проверочныеТаблица 3.1.
ческих величин в процессах
| Потенциальная работа | Теплоем-кость процесса | Количество тепла | Изменение энтропии |
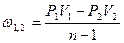
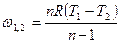
| 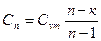
| 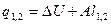
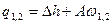
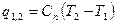
| 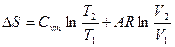
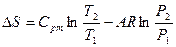
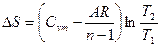
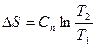
|
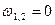
| Срm | 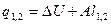
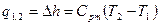
| 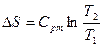
|
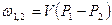
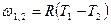
| Cvm | 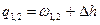
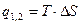 q1,2=Сvm(T2-T1)
q1,2=Сvm(T2-T1)
| 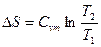
|
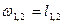
| ¥ | 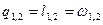
| 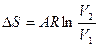
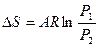
|
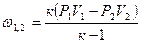
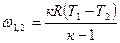
| 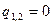
| 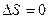
|
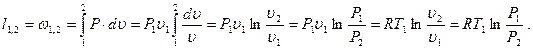 (3.53)
(3.53)
Соотношения между параметрами состояния, а также расчетные и проверочные зависимости термодинамических величин в процессах даны в табл. 3.1.
Дата добавления: 2016-01-20; просмотров: 659;
