Основные виды загрязнений природной среды
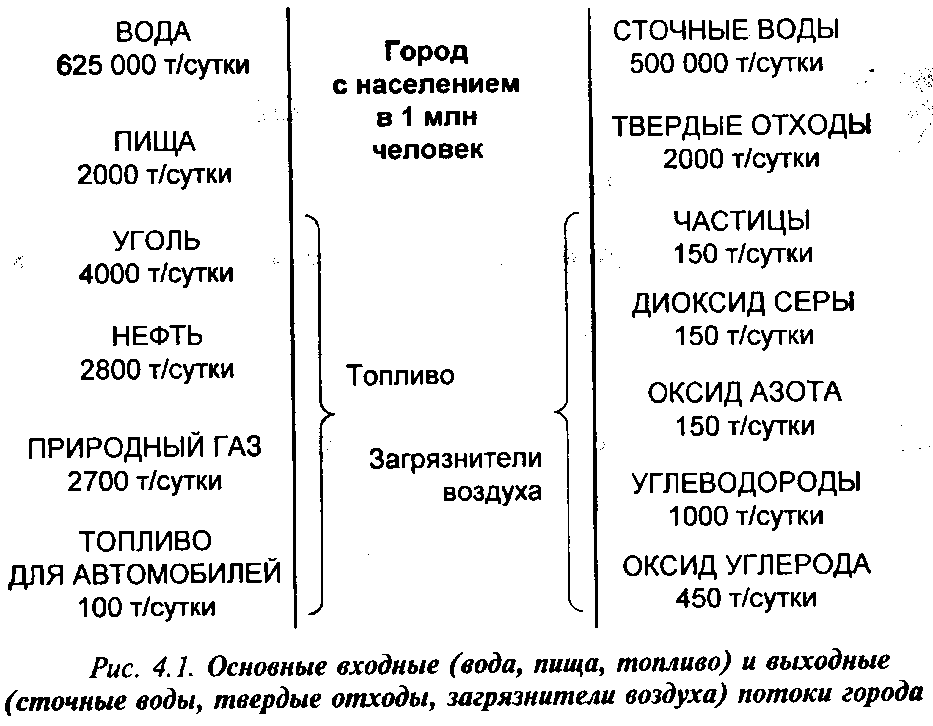
Чтобы обеспечить свое существование, человечество должно иметь пищу, воду, кров, одежду и т.д. Все это с неизбежностью предполагает образование различного рода отходов, которые поступают в окружающую среду. Во избежание ненужного, а порой и непоправимого ущерба, наносимого природной среде, такое воздействие на среду должно тщательно планироваться. При этом следует сочетать удовлетворение потребностей человека за счет природы с активной защитой природной среды от последствий человеческой деятельности. Как правило, эти цели не исключают друг друга, хотя в некоторых случаях приходится принимать компромиссные решения. Например, количество отходов, приходящихся на типичный американский город с населением 1 млн человек, является поразительным (рис. 4.1). Ежедневно в городскую канализацию поступает 80% количества воды, которое приходится на одного жителя (0,6 т); образуется 150 т сажи, зольной пыли и других загрязнителей воздуха и 2000 т твердых отходов.
Теоретически в условиях города возможно избежать загрязнения окружающей среды: получать чистую воду из сточных вод, а на иле сточных вод выращивать сельскохозяйственную продукцию. Даже СО2 и Н2О, выделяемые при дыхании, можно было бы превратить с помощью растений и водорослей в углеводы и кислород. Однако согласно законам термодинамики такое изолированное существование веществ не может продолжаться бесконечно долго.
Любая деятельность человека оказывает воздействие на суммарные ресурсы Земли. Казалось бы, в результате такой деятельности ресурсы Земли должны иссякнуть. Однако не следует забывать, что Земля постоянно получает приток новой энергии, источником которой является Солнце.
Таким образом, деятельность человека причиняет ущерб окружающей среде независимо от его добрых намерений и задача состоит в том, чтобы сделать последствия этой деятельности наименее пагубными.
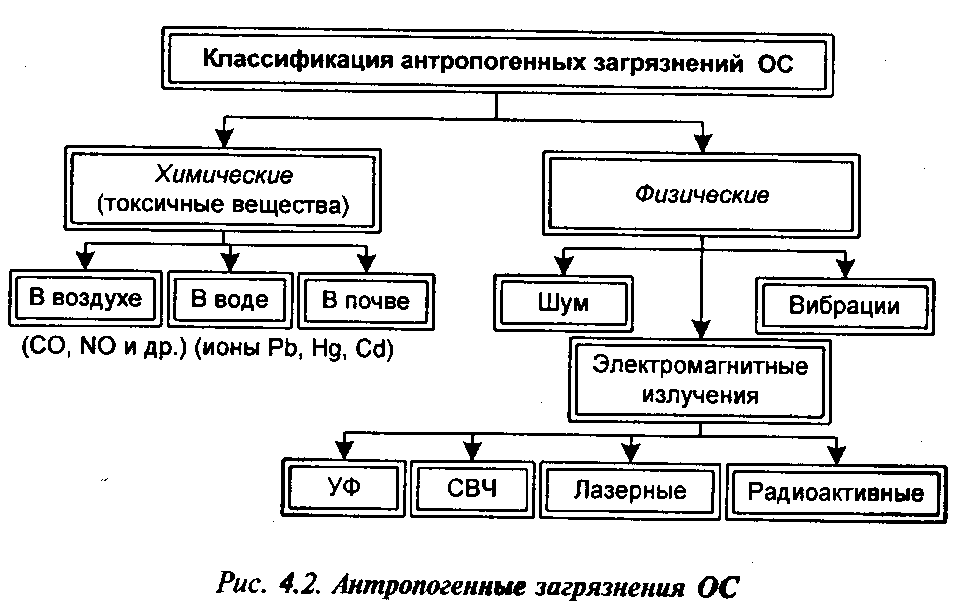
Загрязнения окружающей среды (ОС) можно классифицировать (рис. 4.2) на физические (шум, вибрации, различные виды излучений) и химические (различные вещества: в воздухе – это токсичные газы и пары, в воде и почве – ионы тяжелых металлов).
Защита атмосферы
Характеристика атмосферы и виды загрязнений. Огромное число вредных веществ находится в воздухе, которым мы дышим.
Это и твердые частицы, например частицы сажи, асбеста, свинца, и взвешенные жидкие капельки углеводородов и серной кислоты, и газы, такие, как оксид углерода, оксиды азота, диоксид серы. Все эти загрязнения, находящиеся в воздухе, оказывают биологическое воздействие на организм человека: затрудняется дыхание, осложняется и может принять опасный характер течение сердечно-сосудистых заболеваний. Под действием одних содержащихся в воздухе загрязнителей (например, диоксида серы и углерода) подвергаются коррозии различные строительные материалы, в том числе известняк и металлы. Кроме того, может измениться облик местности, поскольку растения также чувствительны к загрязнению воздуха.
Смог (от англ. smoke – дым и fog – туман), нарушающий нормальное состояние воздуха многих городов, возникает в результате реакции между содержащимися в воздухе углеводородами и оксидами азота, находящимися в выхлопных газах автомобилей.
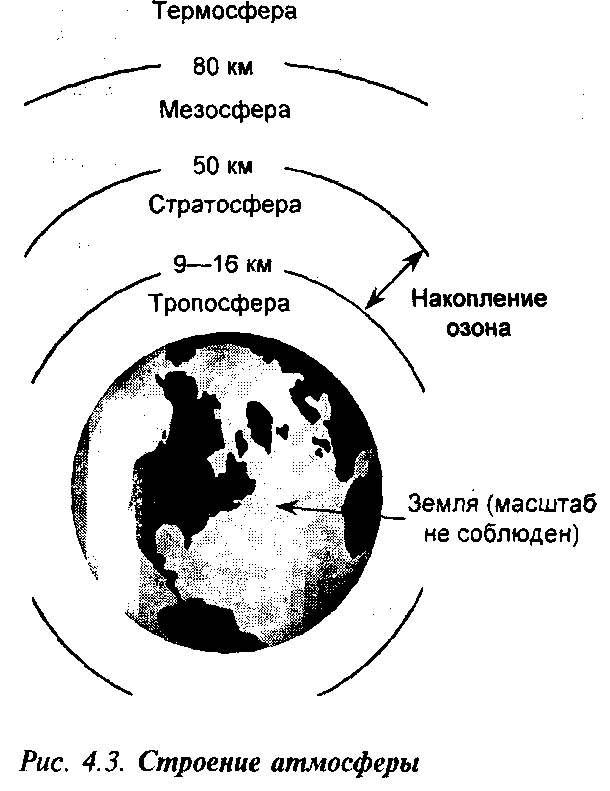
Таблица 4.1 и рис. 4.3 позволят вспомнить нормальный состав и строение атмосферы Земли.
Земная атмосфера подразделяется на слои в соответствии с их температурой. На рис. 4.3 высота слоев указана приблизительно, поскольку она меняется в зависимости от точки отсчета.

К основным загрязнителям атмосферы, которых, по данным ЮНЕП*, ежегодно выделяется до 25 млрд т, относят:
· диоксид серы и частицы пыли – 200 млн т/год;
· оксиды азота (NxOy) – 60 млн т/год;
· оксиды углерода (СО и СО2) – 8000 млн т/год;
· углеводороды (СxНу) – 80 млн т/год.
* ЮНЕП – Программа ООН по окружающей среде.
Оксид серы IV SO2. При растворении в воде образует кислотные дожди:
Н2О + SO2 = H2SO3.
Выделяется в атмосферу в основном в результате работы теплоэлектростанций (ТЭС) при сжигании бурого угля и мазута, а так же серосодержащих руд - PbS, ZnS, Cus, NiS, MnS и т.д.
При сжигании угля или нефти содержащаяся в них сера окисляется, при этом образуются два соединения - диоксид серы и триоксид серы. В процессе первоначального горения топлива до триоксида серы окисляется менее 3% серы. Кислотные дожди губят растения, закисляют почву, увеличивают кислотность озер. Большую озабоченность вызывает в России огромный трансграничный перенос серы с Запада, составляющий примерно 2 млн. т. оксидов серы – 10 млн. т. сульфатов в год, так как воздушные массы с Запада в нашу страну в связи с розой ветров в 7 – 10 раз превышают наши воздушные массы в Европу. Это в основном страны Восточной Европы и Украина, энергетика которых базируется на бурых углях.
Россия входит в конвенцию по SO2 и участвует во всех процессах, способствующих снижению выбросов окислов серы в атмосферу. В основном это строительство заводов по производству серной кислоты по схеме: диоксид серы – триоксид серы – серная кислота. Используя оксиды серы как вторичное сырье, человечество для производства такого необходимого ему во многих отраслях промышленности продукта, как серная кислота, перестанет извлекать из недр ограниченные запасы серы.
Подсчитано, что в 80-е годы человечеству было необходимо получать около 25 млн. т. серной кислоты в год (например, для получения синтетических моющих средств и других продуктов), а выброс оксидов серы в то же время составил 15,6 млн. т. в год, больше чем необходимо для производства указанного выше количества серной кислоты.
Даже при среднем содержании оксидов серы в воздухе порядка 100 мкг. на кубометр, что нередко имеет место в городах, растения приобретают желтоватый оттенок. Отмечено, что заболевания дыхательных путей, например, бронхиты, учащаются при повышении уровня оксидов серы в воздухе.
Разработано большое число методов для улавливания двуокиси серы из отходящих дымовых газов. Весьма привлекательными оказались скрубберные установки, дающие отходы в виде продуктов, имеющих спрос на рынке: один из таких скрубберов производит серу высокой чистоты, другой – разбавленную серную кислоту. Последнюю невыгодно перевозить на большие расстояния, но высокочистая сера, которая находит применение при производстве лекарственных препаратов, промышленных реагентов, удобрений в развитых странах привлекает и потребителей из-за рубежа.
Оксиды азота (NxOy). В природе оксиды азота образуются при лесных пожарах. Высокие концентрации оксидов азота в городах и окрестностях промышленных предприятий связаны с деятельностью человека. В значительном количестве оксиды азота выделяют ТЭС и двигатели внутреннего сгорания. Выделяются оксиды азота и при травлении металлов азотной кислотой. Производство взрывчатых веществ и азотной кислоты – еще два источника выбросов оксидов азота в атмосферу.
Загрязняют атмосферу:
· N2O – оксид азота I (веселящий газ), обладает наркотическими свойствами, используется при хирургических операциях;
· NO – оксид азота II, действует на нервную систему человека, вызывает паралич и судороги, связывает гемоглобин крови и вызывает кислородное голодание;
· NO2, N2O4 – оксиды азота V (N2О4= 2NО2), при взаимодействии с водой образуют азотную кислоту 4NO2 + 2Н2О + О2 = 4HNО3. Вызывают поражение дыхательных путей и отек легких.
Оксиды азота принимают участие в образовании фотохимического смога. К фотохимическим процессам относятся процессы образования пероксиацетилнитратов (ПАН). При концентрациях ПАН 0,1–0,5 мг/м3 они могут вызывать раздражение слизистой оболочки глаз и гибель растений, что характерно для южных солнечных городов.
Уровни фотохимического загрязнения воздуха тесно связаны с режимом движения автотранспорта. В период высокой интенсивности движения утром и вечером отмечается пик выбросов в атмосферу оксидов азота и углеводородов. Именно эти соединения, вступая в реакции друг с другом, обусловливают фотохимическое загрязнение воздуха.
Наблюдается большое количество заболеваний верхних дыхательных путей у населения, подвергавшегося воздействию высоких уровней оксидов азота, по сравнению с группой людей, которые находились в условиях меньшей концентрации NхOy, a концентрации других загрязнителей были такими же.
Люди с хроническими заболеваниями дыхательных путей (эмфизема легких, астма), а также страдающие сердечно-сосудистыми заболеваниями, более чувствительны к прямым воздействиям оксидов азота.
Оксид углерода II (СО).
Концентрация оксида углерода II в городском воздухе больше, чем любого другого загрязнителя. Однако поскольку этот газ не имеет ни цвета, ни запаха, ни вкуса, наши органы чувств не в состоянии обнаружить его.
Самый крупный источник оксида углерода в городах – автотранспорт. В большинстве городов свыше 90% СО попадает в воздух вследствие неполного сгорания углерода в моторном топливе по реакции: 2С+О3 = 2СО. Полное сгорание дает в качестве конечного продукта диоксид углерода: С + О2 = СО2.
Другой источник оксида углерода – табачный дым, с которым сталкиваются не только курильщики, но и их ближайшее окружение. Доказано, что курильщик поглощает вдвое больше оксида углерода по сравнению с некурящим.
Оксид углерода вдыхается вместе с воздухом или табачным дымом и поступает в кровь, где конкурирует с кислородом за молекулы гемоглобина. Оксид углерода соединяется с молекулами гемоглобина прочнее, чем кислород. Чем больше оксида углерода содержится в воздухе, тем больше гемоглобина связывается с ним и тем меньше кислорода достигает клеток. По этой причине оксид углерода при повышенных концентрациях представляет собой смертельно опасный яд.
Типичный автомобильный двигатель середины 60-х годов выбрасывал с выхлопными газами в среднем 73 г оксида углерода на каждые 1,5 км пробега. К 1981 г. выброс оксида углерода новыми автомобилями достиг уровня всего 3,4 г на 1,5 км (данные США).
Для достижения установленного стандарта выхлопные газы смешиваются с воздухом в присутствии катализатора. Дальнейшее окисление оставшегося оксида углерода происходит в каталитическом преобразователе (Pt/Pd – платина-палладий). Именно такая система в настоящее время повсеместно выбрана для уменьшения выбросов СО в атмосферу. В Москве, например, по решению мэрии не оформляют покупку автомобилей иностранных марок до 1985 г. выпуска, т. е. без установленных каталитических дожигателей на выхлопные газы. В США годовые выбросы оксида углерода постепенно уменьшались начиная с 1976 г., по мере того как новые модели автомобилей с каталитическими преобразователями выхлопных газов сменяли старые, менее эффективные модели; общий выброс СО автотранспортом США сократился с 64,3 млн т в 1976 г. до 47,7 млн т в 1983 г., т.е. на 25%. Одна из причин столь небольшого снижения связана с общей длиной пробега автомобилей, которая ежегодно возрастает из-за постоянного роста числа автомобилей на дорогах и улицах. Эффективность каталитических преобразователей со временем уменьшается и необходимо регулярно осуществлять повторные проверки выхлопных газов автомобилей на содержание СО. Борьба за качество воздуха во всех странах продолжается, поскольку пробег автомобилей непрерывно растет. Этот неограниченный рост можно было бы сократить за счет создания новых систем общественного транспорта, привлекательных для населения и способных широко развиваться, или перехода на электромобили.
Оксид углерода IV (СО2).
Влияние углекислого газа (СО2) связано с его способностью поглощать инфракрасное излучение (ИК) в диапазоне длин волн от 700 до 1400 нм. Земля, как известно, получает практически всю свою энергию от Солнца в лучах видимого участка спектра (от 400 до 700 нм), а отражает в виде длинноволнового ИК-излучения.
Механизмом вывода углекислого газа из атмосферы является поглощение его в результате фотосинтеза растений, а также связывание его в океанских водах по реакции: СО2+Н2О+Са2+ = =СаСО3+2Н+.
Пыль.
Причины основных выбросов пыли в атмосферу – это пыльные бури, эрозия почв, вулканы, морские брызги. Около 15– 20% общего количества пыли и аэрозолей в атмосфере – дело рук человека: производство стройматериалов, дробление пород в горнодобывающей промышленности, производство цемента, строительство. Например, во Франции приблизительно 3% общего объема производимого цемента выбрасывается в атмосферу (около 100 т в год). Пыль, осевшая в индустриальных городах, содержит 20% оксидов железа (Fе2О3), 15% оксида кремния (SiO2) и 5% сажи (С). Промышленная пыль часто включает также оксиды различных металлов и неметаллов, многие из которых токсичны (оксиды марганца, свинца, молибдена, ванадия, сурьмы, теллура).
Американский эколог О. Бартон так охарактеризовал проблему, связанную с запыленностью атмосферы: «Одно из двух: либо люди сделают так, что в воздухе станет меньше дыма, либо дым сделает так, что на Земле станет меньше людей».
Пыль и аэрозоли не только затрудняют дыхание, но и приводят к климатическим изменениям, поскольку отражают солнечное излучение и затрудняют отвод тепла от Земли. Например, так называемые смоги в очень населенных южных городах (Мехико – 22 млн жителей и др.) снижают прозрачность атмосферы в 2–5 раз.
Кислород (О2).
Кислород на Земле создан самой жизнью. Примерно 2 млрд лет назад содержание свободного кислорода в земной атмосфере начало возрастать. После того как из части атмосферного кислорода сформировался защитный озоновый слой, начали развиваться наземные растения и животные. С течением времени содержание кислорода в атмосфере значительно менялось, поскольку менялись уровни его образования и использования.
Главным продуцентом кислорода на Земле служат зеленые водоросли поверхности океана (60%) и тропические леса суши (30%). Тропические леса Амазонки называют легкими планеты Земля. Ранее в литературе высказывались опасения, что возможно уменьшение количества кислорода на Земле вследствие увеличения объема сжигаемого ископаемого топлива. Но расчеты показывают, что использование всех доступных человеку залежей угля, нефти и природного газа уменьшит содержание кислорода в воздухе не более чем на 0,15% (с 20,95 до 20,80%). Другая проблема – вырубка лесов, приводящая к возникновению кислородных «паразитов» – стран, которые живут за счет чужого кислорода. Например, США за счет своих растений имеет только 45% кислорода, Швейцария – 25%.
Озон (О3).
Озон образуется в верхних слоях стратосферы и в нижних слоях мезосферы в результате протекания следующих реакций:
О2 + hv (=240 нм) = О + О,
O2 + О + М,
где М – различные составляющие атмосферы, например, кислород или азот.
Озон и атомарный кислород могут реагировать в кислородной атмосфере согласно реакциям:
O3 + hv (380 нм) = О2 + О,
О3 + О = 2O2,
О + О + М = O2+М.
Эти реакции образуют так называемый цикл Чепмена. Общее содержание озона иногда выражают как число молекул, получаемое в результате суммирования по всем широтам, долготам и высотам. На сегодняшний день это количество приблизительно равно 4·1037 молекул озона. Наиболее распространенной количественной оценкой состояния озона в атмосфере является толщина озонного слоя Х – это толщина слоя озона, приведенного к нормальным условиям, которая в зависимости от сезона, широты и долготы колеблется от 2,5 до 5 относительных мм. Области с уменьшенным содержанием на 40–50% озона в атмосфере называют «озоновыми дырами».
Около 90% озона находится в стратосфере. Долгое время считалось, что основной причиной истощения озонного слоя являются полеты космических кораблей и сверхзвуковых самолетов, а также извержения вулканов и другие природные явления.
Разрушительное действие хлорфторуглеродных соединений (ХФУ) на стратосферный озон было открыто в 1974 г. американскими учеными – специалистами в области химии атмосферы Ш. Роулендом и М. Молина (в 1996 г. за открытия в этой области им присуждена Нобелевская премия). С тех пор не раз предпринимались попытки ограничить выброс ХФУ в атмосферу, и тем не менее сейчас во всем мире ежегодно производится около миллиона тонн газообразных веществ, способных разрушить озонный слой.
ХФУ, часто встречающиеся в быту и в промышленном производстве, – это пропелленты в аэрозольных упаковках, хладоагенты (фреоны) в холодильниках и кондиционерах. Они применяются и при производстве вспененного полиуретана, и при чистке электронной техники.
Постепенно ХФУ поднимаются в верхний слой атмосферы и разрушают озонный слой – щит атмосферы, спасающий от УФ-излучения. Время жизни двух самых опасных фреонов – Ф-11 и Ф-12 – от 70 до 100 лет. Этого вполне достаточно, чтобы в ближайшее время ощутить на себе последствия сегодняшней экологической неграмотности. Если, сохранятся современные темпы выброса ХФУ в атмосферу, то в ближайшие 70 лет количество стратосферного озона уменьшится на 90%. При этом весьма вероятно, что:
· рак кожи примет эпидемический характер;
· резко сократится количество планктона в океане;
· исчезнут многие виды животных, например, ракообразные;
· УФ-излучение неблагоприятно скажется на сельскохозяйственных культурах.
Все это нарушает равновесие во многих экосистемах Земли, из-за фотохимического смога ухудшится общее состояние атмосферы, усилится «парниковый эффект».
ХФУ – высокостабильные соединения и поскольку они не поглощают солнечное излучение с большой длиной волны, они не могут подвергнуться его воздействию в нижних слоях атмосферы, но, преодолев защитный слой, поднимаются вверх по атмосфере и коротковолновое излучение высвобождает из них атомы свободного хлора. Свободные атомы хлора затем вступают в реакцию с озоном:
Сl + О3 = СlO + O2,
СlO + О = Сl + O2.
Таким образом, разложение ХФУ солнечным излучением создает каталитическую цепную реакцию, согласно которой один атом хлора способен разрушить до 100 000 молекул озона. Канцерогенным является УФ-излучение с длиной волны короче 320 нм. Ожидается, что каждый процент сокращения озонного слоя повлечет за собой увеличение числа случаев заболевания раком кожи на 5–6%.
Основные санитарные требования к качеству атмосферного воздуха. Основным критерием контроля качества атмосферного воздуха является ПДК токсичных веществ. При санитарной оценке качества атмосферного воздуха принято выражать содержание загрязняющих веществ в мг на м3 воздуха. Это выражение концентрации применимо для любого агрегатного состояния примесей. За рубежом, например в США, часто пользуются другой концентрацией:
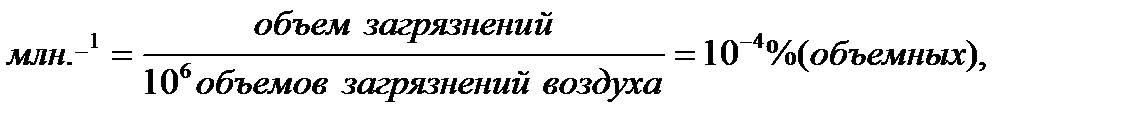
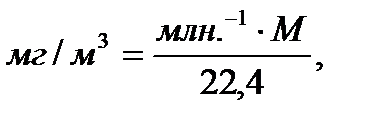
где М – молекулярная масса загрязнителя;
22,4 – объем в литрах 1 моля газа при 25°С и 760 мм рт. ст.
Критерием оценки влияния выбросов предприятий на окружающую среду является уровень практических концентраций примесей в атмосфере, полученных в результате рассеивания выбросов, по сравнению с предельно допустимыми.
Для атмосферного воздуха установлены соответствующие значения ПДК.
Концентрация вредных веществ в воздухе производственных помещений не должна превышать ПДКр.з., в воздухе для вентиляции производственных помещений – 0,3 ПДКр.з.; в атмосферном воздухе населенных пунктов – ПДК м.р.; в зоне отдыха и курортов - 0,8 ПДК м.р..
Нормы ПДК служат исходной базой для проектирования и экспертизы новых машин и механизмов, технологических линий, промышленных сооружений и предприятий, а также для расчета вентиляционных, газопылеулавливающих и кондиционирующих систем, контролирующих приборов и систем сигнализации.
Основные организации, контролирующие выбросы предприятий в атмосферный воздух, – санитарно-эпидемиологические станции (СЭС); территориальные управления Федеральной службы России по гидрометеорологии и мониторингу окружающей среды; Государственная инспекция по контролю за работой газоочистных и пылеулавливающих установок.
Для предотвращения загрязнения атмосферы введены нормативы на выбросы вредных веществ непосредственно из каждого источника (труба, шахта и т.д.). Государственным стандартом (1990 г.) установлены величины предельно допустимых выбросов (ПДВ) вредных веществ в атмосферу:
ПДВ – количество вредных веществ, выбрасываемых в единицу времени (г/с), которое в сумме с выбросами из других источников загрязнения не создает приземной концентрации примеси, превышающей значение ПДК. Это научно-технический норматив для конкретного источника загрязнения, обязательный для данного предприятия.
Если в воздухе населенных мест концентрация превышает ПДК, а величина ПДВ по объективным причинам не может быть достигнута, то фактический выброс называется временно согласованным выбросом (ВСВ).
Нормативные выбросы вредных веществ устанавливают для каждого источника загрязнения в г/с и для всего предприятия в целом (т/год). При установлении ПДВ или ВСВ необходимо учитывать фоновые концентрации, значения которых определяются для предприятия территориальными организациями Федеральной службы России по гидрометеорологии и мониторингу окружающей среды. Для городов с населением меньше 250 тыс. человек приняты следующие нормы фоновых концентраций основных токсикантов:
SО 2 – 0,1 мг/м3 СО – 1,5 мг/м
NО2 – 0,03 мг/м3 пыль – 0,2 мг/м3
Методика для расчета ПДВ основана на применении модели, которая учитывает индивидуальные свойства загрязнителя (ПДКм.р.); фоновую концентрацию Сф; геометрические размеры источника загрязнения (h – высота, м; D – диаметр устья, м); условия выхода газового потока из источника (Т – разность температур выбрасываемой смеси и окружающего воздуха, V – средняя скорость выхода смеси из устья источника, м/с); W, f – условия вертикального и горизонтального рассеивания вредного вещества в атмосферном воздухе; А, – показатель относительной агрессивности; F – коэффициент, учитывающий скорость оседания вредных веществ в воздухе; п – коэффициент, учитывающий рельеф местности.
Физико-химические методы очистки атмосферы от газообразных загрязнителей. Основное направление защиты воздушного бассейна от загрязнений вредными веществами – создание новой безотходной технологии с замкнутыми циклами производства и комплексным использованием сырья.
Многие действующие предприятия используют технологические процессы с открытыми циклами производства. В этом случае отходящие газы перед выбросом в атмосферу подвергаются очистке с помощью скрубберов, фильтров и т.д. Это дорогая технология, и только в редких случаях стоимость извлекаемых из отходящих газов веществ может покрыть расходы на строительство и эксплуатацию очистных сооружений.
Наиболее распространены при очистке газов адсорбционные, абсорбционные и каталитические методы.
Санитарная очистка промышленных газов включает в себя очистку от СО2, СО, оксидов азота, 8O2, от взвешенных частиц.
· Очистка газов от СО2.
а) Абсорбция водой. Простой и дешевый способ, однако эффективность очистки мала, так как максимальная поглотительная способность воды – 8 кг СО2 на 100 кг воды.
б) Поглощение растворами этанол-аминов по реакции:
2R – NH2 + СО2 + Н2О → (R – NH3)2СО3.
В качестве поглотителя обычно применяется моноэтаноламин.
в) Холодный метанол СН3ОН является хорошим поглотителем СО2 при -35°С.
г) Очистка цеолитами типа СаА. Молекулы СО2 очень малы (d = 3,1 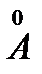 ). Для извлечения СO2 из природного газа и удаления продуктов жизнедеятельности (влаги и СО2) в современных экологически изолированных системах (космические корабли, подводные лодки и т.д.) используются молекулярные сита типа СаО.
). Для извлечения СO2 из природного газа и удаления продуктов жизнедеятельности (влаги и СО2) в современных экологически изолированных системах (космические корабли, подводные лодки и т.д.) используются молекулярные сита типа СаО.
· Очистка газов от СО.
а) Дожигание на Pt/Pd (платино-палладиевом) катализаторе:
2СО + О2 → 2СО2.
б) Конверсия (адсорбционный метод):
СО + Н2О → СО2 + H2.
· Очистка газов от оксидов азота.
В химической промышленности очистка от оксидов азота на 80% и более осуществляется в основном в результате превращений на катализаторах.
а) Окислительные методы основаны на реакции окисления оксидов азота с последующим поглощением водой и образованием НNО3:
окисление озоном в жидкой фазе по реакции:
2NO + О3 + Н2О → 2 НNО3;
окисление кислородом при высокой температуре:
2NO + О2 → 2NО2.
б) Восстановительные каталитические методы основаны на восстановлении оксидов азота до нейтральных продуктов в присутствии катализаторов или под действием высоких температур в присутствии восстановителей. Процесс восстановления можно представить в виде следующей схемы:
N2О5 → N2О4 → NО2 → NO N2 +О2.
-11°C 21,5°C 140°C 600°C 10 000°С
Разложение оксидов азота до нейтральных соединений (2NO → N2 + О2) происходит в потоке низкотемпературной плазмы (10 000°С). Этот процесс при более низких температурах в присутствии катализатора протекает в двигателях внутреннего сгорания. Присутствие восстановителей в зоне реакции (угля, графита, кокса) также понижает температуру реакции восстановления. При температуре 1000°С степень разложения N0 в реакции С + 2NO → СО2 + N2 составляет 100%.
При температуре выхлопных газов автомобиля в двигателе внутреннего сгорания возможна реакция:
2NO + 2СО → N2 + 2СО2.
в) Сорбционные методы.
Это адсорбция оксидов азота водными растворами щелочей и известью СаСО3 и адсорбция оксидов азота твердыми сорбентами (угли, торф, силикагели, цеолиты).
· Очистка газов от SO2.
ТЭС мощностью 1 млн кВт при работе на каменном угле выбрасывает в атмосферу 11 тыс. т SO2, на газе – 20% этого количества.
Очистка дымовых газов электростанций обходится сейчас приблизительно в 300–400 тыс. руб. за 1 кВт в год. Снижение доли серы в нефтепродуктах на 0,5% обходится при этом в 30 тыс. руб. на 1 т. Методы улавливания SO2 требуют больших затрат, их можно разделить на аммиачные, нейтрализации и каталитические.
Эффективность очистки зависит от множества факторов: парциальных давлений SO2 и O2 в очищаемой газовой смеси; температуры отходящих газов; наличия и свойств твердых и газообразных компонентов; объема очищаемых газов; наличия и доступности хемосорбентов; потребности в продуктах утилизации SO2; требуемой степени очистки газа.
· Очистка газов от взвешенных частиц, например, пыли.
Можно выделить несколько методов улавливания частиц пыли:
гравитационное оседание;
центрифугирование;
электростатическое оседание;
инерционное соударение;
прямой захват;
диффузия.
Все процессы очистки осуществляются с помощью специальных фильтров, скрубберов и т.д.
Защита гидросферы
Характеристика гидроресурсов и сточных вод. Гидросферой называют водную оболочку Земли. Это совокупность океанов, морей, озер, прудов, болот и подземных вод. Гидросфера – самая тонкая оболочка нашей планеты, она составляет лишь 10-3% общей массы планеты.
Роль воды во всех жизненных процессах общепризнана. Без воды человек может жить не более 8 суток, за год он потребляет около 1 т воды. Растения содержат 90% воды. Сельское хозяйство является основным потребителем пресной воды. Вода идет на мелиорацию, обслуживание животноводческих комплексов. Так, необходимо воды для выращивания
1 т пшеницы – 1500 т
1 т риса – 7000 т
1 т хлопка – 10 000 т
Вода необходима практически всем отраслям промышленности. Так, требуется воды на производство
1 т чугуна –50–150т
1 т пластмасс – 500–1000 т
1 т цемента – 4500 т
1 т бумаги – 100 000 т
На электростанциях мощностью 300 тыс. кВт расход воды составляет 300 млн т/год.
Указанные производства требуют только пресную воду. Расчеты показывают, что количество пресной воды составляет всего 2,5% всей воды на планете; 85% – морская вода, содержащая до 35 г/л солей. Запасы пресной воды распределены крайне неравномерно: 72,2% – льды; 22,4% – грунтовые воды; 0,35% – атмосфера; 5,05% – устойчивый сток рек и вода озер. На долю воды, которую мы можем использовать, приходится всего 10-2% всей пресной воды на Земле.
Хозяйственная деятельность человека привела к заметному сокращению количества воды в водоемах суши: мелеют водоемы, исчезают малые реки, высыхают колодцы, снижается уровень грунтовых вод. Сокращение уровня грунтовых вод уменьшает урожайность окрестных хозяйств.
Проблема Каспия – хищническое истребление ценнейших пород осетровых рыб при том, что разведение молоди осетровых, т. е. восстановление их популяции, ведется только рыбохозяйствами России и в небольшом объеме – Азербайджаном, а остальные страны только потребляют.
Проблема Азовского моря – увеличение концентрации солей. За послевоенные годы его засоленность увеличилась с 9 до 15,6 ррт. Организмы, питающие рыбу, погибают. Результат – снижение возможности рыболовства на Азовском море.
Проблема Байкала – воду этого ценнейшего озера используют для получения целлюлозы по финской технологии, т. е. используют воду минимальной минерализации, содержащую меньше 100 мг/л солей. Обычно в пресной воде содержание солей составляет 300–450 мг/л, в питьевой – 380 мг/л. Байкал после строительства целлюлозно-бумажного комбината в городе Байкальске стал загрязняться (60-е годы). В озере Байкал находится несколько сот эндаминореликтов – редких видов биоты, которых нет в других водоемах. С запозданием разработаны уникальные очистные сооружения, стоимость которых составила 30% стоимости основных фондов производства. Однако принимаемые меры недостаточны для защиты Байкала.
По количеству солей вода делится на: пресную (< 1 г/л солей), засоленную (до 25 г/л солей) и соленую (> 25). В океане, например, – 35 г/л; Балтийском море – 8–16 г/л; Каспийском – 11–13 г/л; Черном – 17–22 г/л.
Деградация природных вод связана в первую очередь с увеличением солесодержания. Количество минеральных солей в водах постоянно растет, даже в такой большой водной системе, как бассейн реки Волги с ее притоками Камой и Окой. В ряде небольших рек, например, в Северном Донце, вода уже не пресная, а соленая. Средняя минерализация рек Украины составляет 2–3 г/л. В настоящее время многие реки Урала не могут быть использованы как источники водоснабжения. Так, в Каму поступают промышленные стоки с минерализацией 1,5–5,0 г/л.
Основная причина засоленности вод – истребление лесов, распашка степей, выпас скота. Вода при этом не задерживается в почве, не увлажняет ее, не пополняет почвенные источники, а скатывается через реки в море. В качестве мер, принятых в последнее время для снижения засоленности рек, используется посадка лесов, предпринимаемая, например, в Саратовской области.
Громаден объем сброса дренажных вод. К 2000 г. он составит 25–35 км3. Системы орошения потребляют обычно 1–2 тыс. м3/га, их минерализация составляет до 20 г/л. Огромен вклад в минерализацию воды сброса промышленных стоков. По данным за 1996 г. в России объем промстоков был равен стоку такой большой реки, как Кубань.
Наблюдается постоянный рост водопотребления как на производственные, так и на бытовые нужды. В среднем в городах с населением 1 млн человек, по данным США, потребляется 200 л/сутки воды на человека, по другим городам, л/с. (литр/сутки):
Москва – 400 Лондон – 170
С.-Петербург – 500 Париж – 130
Берлин – 250 Брюссель – 85
Водоемы (в частности, пруды) представляют собой сложную экологическую систему, которая создавалась в течение длительного времени. В них непрерывно протекает процесс изменения состава примесей, приближающийся к состоянию равновесия. Значительные отклонения от состояния равновесия могут привести к гибели популяций водных организмов, т. е. к невозможности возврата к состоянию равновесия, а это приводит к гибели экосистемы. Процессы, связанные с возвращением экосистемы к первоначальному состоянию, называются процессами самоочищения. К важнейшим из них относятся:
· осаждение грубодисперсных и коагуляция коллоидных примесей;
· окисление (минерализация) органических примесей;
· окисление минеральных примесей кислородом;
· нейтрализация кислот и оснований за счет буферной емкости воды водоема;
· гидролиз солей тяжелых металлов, приводящий к образованию малорастворимых гидроксидов и выделению их из раствора и др.
Основные характеристики сточных вод, влияющие на состояние водоемов: температура, минералогический состав примесей, содержание кислорода, мл, рН (водородный показатель), концентрация вредных примесей. Особенно большое значение для самоочищения водоемов имеет кислородный режим. Условия спуска сточных вод в водоемы регламентируются «Правилами охраны поверхностных вод от загрязнения сточными водами». Сточные воды характеризуются следующими признаками:
· мутность воды – определяется с помощью мутномера: исследуемую воду сравнивают с эталонным раствором, который приготовлен из каолина (или из инфузорной земли) на дистиллированной воде, выражается в мг/л;
· цветность воды – определяется сравнением интенсивности окраски испытуемой воды со стандартной шкалой. Выражается в градусах цветности. В качестве стандартного раствора применяют раствор солей кобальта;
· сухой остаток – масса солей и веществ, которые остаются после выпаривания воды (мг/л);
· кислотность – измеряется в единицах рН. Природная вода обычно имеет щелочную реакцию (рН > 7);
· жесткость – зависит от содержания солей Са2+ и Mg2+. Различают три вида жесткости воды: общая, обусловленная содержанием солей кальция и магния независимо от содержания анионов; постоянная, обусловленная содержанием ионов С1- и SO 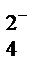 после кипячения в течение 1 ч (она не удаляется); устранимая (временная) – устраняется кипячением: Са (НСО3) 2 → СаСО3 + СО2 + Н2О. Жесткость измеряется в мг-экв/л солей магния и кальция (1 мг-экв соответствует 28 мг СаО) и в градусах (1° – количество солей кальция и магния, соответствующее 10 мг СаО в 1 л воды). 1° жесткости = 10 мг-экв = 2,8° жесткости;
после кипячения в течение 1 ч (она не удаляется); устранимая (временная) – устраняется кипячением: Са (НСО3) 2 → СаСО3 + СО2 + Н2О. Жесткость измеряется в мг-экв/л солей магния и кальция (1 мг-экв соответствует 28 мг СаО) и в градусах (1° – количество солей кальция и магния, соответствующее 10 мг СаО в 1 л воды). 1° жесткости = 10 мг-экв = 2,8° жесткости;
· растворимый кислород – зависит от температуры воды и барометрического давления, измеряется в мг/л;
· биологическая потребность в кислороде (БПК) – количество кислорода, поглощаемое микроорганизмами в сточных водах. За критерий оценки БПК принята величина уменьшения количества растворенного кислорода в воде в течение 5 или 20 суток при температуре 20°С.
В зависимости от условий образования сточные воды делятся на три группы:
· бытовые сточные воды – стоки душевых, прачечных, бань, столовых, туалетов, от мытья полов и т.д. Их количество в среднем составляет 0,5–2 л/с. с 1 га жилой застройки города, они содержат примерно 58% органических и 42% минеральных веществ;
· атмосферные сточные воды, или ливневые, их сток неравномерен: 1 раз в год – 100–150 л/с. с 1 га; 1 раз в 10 лет – 200–300 л/с. с 1 га. Особенно опасны ливневые стоки на промышленных предприятиях. Из-за их неравномерности затруднены сбор и очистка этих стоков;
· промышленные сточные воды – жидкие отходы, которые возникают при добыче и переработке сырья. Расход воды при этом исчисляют из удельного водопотребления на единицу продукции.
Самым важным условием, необходимым для того, чтобы биохимические процессы в водоеме протекали правильно и обеспечивали самоочищение воды, является наличие в ней растворенного кислорода. Если кислорода недостаточно, то высшие организмы погибают. Органические соединения вместо окисления подвергаются анаэробному разложению с выделением сероводорода, углекислого газа, метана и водорода, создающих вторичные загрязнения водоема.
По санитарным нормам (СНИП) значение БПК в зависимости от типа природных водоемов не должно превышать 3–6 мг О2/лН2О. В сточных водах БПК составляет от 200 до 3000 мг/л, поэтому при сбросе в водоемы промстоков необходимо их чистить или сильно разбавлять.
Главным критерием качества воды и атмосферы в нашей стране являются ПДК. Но они установлены далеко не для всех веществ. Спуск в водоемы новых веществ, ПДК которых не определены, в нашей стране запрещен. Кроме того, часто используют значения ПДК не для сточных вод, а для водоема. Таким образом, появляется возможность достичь установленного ПДК простым разбавлением сточных вод, чем часто пользуются. Около половины сточных вод на Земле не подвергается специальной очистке перед сбросом в водоемы. Их обезвреживание заключается лишь в разбавлении чистой водой и самоочищении водоемов. Например, сточные воды заводов по производству полиэтилена и полистирола надо разбавлять в 30 раз; сточные воды от производства синтетического каучука – в 185 раз.
В России ежегодно образуется около 21 км3 сточных вод, из них 16 км3 сливаются в Волгу или ее притоки. Выбросы Си, Zn, Сг превышают ПДК. Поэтому принято специальное постановление по защите окружающей среды в бассейнах Волги и Урала.
Сбросы сточных вод регламентируются также величиной ПДС (предельно-допустимого сброса) предприятия. В 90-х годах в мире использовали 2000–3000 км3 пресных вод, т. е. примерно 30% устойчивого мирового стока рек. Чтобы не погибнуть, чистить воду придется всем странам. Кроме того, пресная вода, удобная для использования, распределена крайне неравномерно. В Европе и Азии, где проживает 70% населения Земли, мировых запасов речных вод очень мало. Гидроресурсы нашей страны велики, однако более 80% речного стока приходится на малонаселенные районы Севера и Востока. На Европейской части России проживает около 80% населения и на них приходится всего 20% гидроресурсов.
Таким образом, влияние хозяйственной деятельности человека на кругооборот воды в природе привело к:
· сокращению количества воды в водоемах суши;
· росту водопотребления;
· исчерпанию самоочищающей способности водоемов;
· деградации природных вод.
Выход из положения – создание замкнутых водооборотных систем. Помимо перечисленных выше факторов это связано с экономическими соображениями. Стоимость очистки сточных вод даже после значительного разбавления очень велика. Так, если принять стоимость 90% очистки за 1 условную единицу (у. е.), то очистка на 99% дороже в 10 раз (10 у. е.), а очистка на 99,9%, которая требуется чаще всего, будет дороже уже в 100 раз, т. е. составит 100 у. е. В результате локальная очистка сточных вод только от характерных для данного вида стоков загрязнений для их повторного использования в том же производстве оказывается существенно дешевле их полной очистки в соответствии с требованиями санитарных органов.
Для характеристики замкнутых водооборотных систем используется критерий кратности использования воды в обороте:
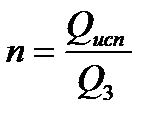
те  – общий объем воды, потребляемый предприятием (м3/ч; м3/г сырья или продукции);
– общий объем воды, потребляемый предприятием (м3/ч; м3/г сырья или продукции);
Q3 – забор потребления свежей воды.
Чем больше кратность использования, Тем совершеннее схема водоснабжения. В США в 1995 г. среднее значение кратности равнялось 7,5. В России в 1995 г. критерий кратности использования воды по отраслям составлял:
Нефтехимия – 7,00
Черная и цветная металлургия – 5,25
Пищевая промышленность – 3,00
Теплоэнергетика – 2,25
Производство стройматериалов – 1,60
Легкая промышленность – 1,30
В нашей стране планировалось довести этот показатель в ближайшие годы до 7,00 в среднем по предприятиям, а в США – до 27.
Создание экономически радикальных замкнутых систем водного хозяйства – весьма трудная задача. Сложный химический состав сточных вод, разнообразие содержащихся в них соединений делают невозможной разработку универсальной бессточной технологической схемы. Можно говорить лишь об общих принципах создания и проектирования бессточных схем.
Основные положения создания водооборотных систем:
1. Разработка научно обоснованных требований к качеству воды, используемой во всех технологических процессах и операциях. В подавляющем большинстве случаев нет необходимости в использовании воды питьевого качества.
2. Максимальное внедрение систем воздушного охлаждения вместо водного. Здесь большую роль сыграло бы внедрение агрегатов большой единичной мощности. При этом высокоэнергетическое тепло используется для технологических целей, а низкоэнергетическое – для обогрева. Так, например, в результате внедрения установок воздушного охлаждения на предприятиях нефтепереработки потребление воды в среднем сократилось на 110–160 млн м3/год (Омский нефтеперерабатывающий завод и др.).
3. Размещение на промышленных площадях комплекса производств (так называемых территориально-производственных комплексов – ТПК) должно обеспечить возможность многократного (каскадного) использования воды в технологических процессах и операциях.
4. Последовательное многократное использование воды в технологических операциях должно по возможности обеспечить получение небольшого объема максимально загрязненных сточных вод.
5. Использование воды для очистки газов от водорастворимых соединений целесообразно только тогда, когда из газов извлекают, а затем утилизируют ценные компоненты.
6. Применение воды для очистки газов от твердых частиц допустимо только в замкнутом цикле.
Методы очистки воды.
Чистые сточные воды – это воды, которые в процессе участия в технологии производства практически не загрязняются и сброс которых без очистки не вызывает нарушений нормативов качества воды водного объекта. Нормативы едины и утверждены Правилами охраны вод от загрязнения сточными водами, принятыми Минводхозом, Минздравом и Минрыбхозом в 1974 г. В 1996 г. на базе Роскомвода и Роскомнедр было создано Министерство природных ресурсов РФ. Принят ряд новых законов Российской Федерации, которые значительно меняют сложившуюся нормативно-правовую базу и систему управления и контроля в области охраны окружающей среды и рационального использования природных ресурсов.
Загрязненные сточные воды – это воды, которые в процессе использования загрязняются различными компонентами и сбрасываются без очистки, а также сточные воды, проходящие очистку, степень которой ниже норм, установленных местными органами Государственного комитета РФ по охране окружающей среды. Сброс этих вод вызывает нарушение нормативов качества воды в водном объекте.
Практически всегда очистка промышленных стоков – это комплекс методов. Наиболее широко используется комбинация механической очистки, нейтрализации промышленных стоков, или реагентной очистки, и биохимической очистки. Эти операции осуществляются практически во всех комплексах очистных сооружений, в том числе и на станциях аэрации при очистке бытовых (канализационных) стоков. Рассмотрим их подробнее.
1. Механическая очистка стоков
Сюда относятся отстой сточных вод в специальных отстойниках, в которых происходит оседание взвешенных частиц на дно отстойников; сбор нефтепродуктов и других нерастворимых в воде жидкостей с поверхности стоков устройствами типа механических рук и, наконец, фильтрация вод через слой песка примерно 1,5-метровой толщины.
2. Химическая, или реагентная, очистка
а) Один из видов обработки сточных вод – реакции нейтрализации. Нейтрализация – химическая реакция, ведущая к уничтожению кислотных свойств раствора с помощью щелочей, а щелочных свойств раствора – с помощью кислот. Поскольку химическая природа отходов может быть различной, то для нейтрализации одного вида отходов необходимо уменьшить кислотные свойства, а для другого вида отходов – щелочные свойства. О степени кислотности или щелочности раствора судят по величине водородного показателя рН. Значение величины рН растворов различных веществ колеблется от 0 до 14. Небольшие значения рН свидетельствуют о наличии кислотной среды.
Чтобы контролировать реакцию нейтрализации, надо знать, какое количество кислоты или щелочи надо добавить в раствор для получения необходимого значения рН. Для этого используют метод титрования, по объему израсходованного титранта вычисляя количество определяемого вещества.
Самую простую систему очистки на основе реакции нейтрализации можно представить в виде измельченного известняка, на который вылили раствор кислоты, а осадок собрали в отстойник.
б) Реакции окисления-восстановления. Любая реакция окисления-восстановления есть одновременное окисление одних компонентов и восстановление других. Наиболее распространенные окислители и восстановители:
Окислители Восстановители
Кислород или воздух Хлорит
Озон Сульфат Fe2+
Хлор, гипохлорит Гидросульфит
Перекись водорода Диоксид серы
Перманганат калия Сероводород
Одним из важнейших окисляющих агентов является хлор, поэтому большинство химических операций со сточными водами начинается с хлорирования, чтобы высокотоксичный хлор к концу реагентной обработки полностью удалялся из воды. Окислительно-восстановительные реакции используются для превращения токсичных веществ в безвредные.
3. Биохимическая очистка
а) Аэробная биохимическая очистка – минерализация органического вещества промышленных или бытовых стоков, происходящая в результате его окисления при содействии аэробных микроорганизмов (минерализаторов) в процессе использования ими этого вещества в качестве источника питания в условиях интенсивного потребления микроорганизмами растворенного в воде кислорода:
С6Н12О6 + 6O2 = 6СО2 + 6H2O.
Было установлено, что органические вещества омертвевших организмов разрушаются под действием бактерий, если для последних созданы соответствующие условия, т. е. своевременно подается кислород и среда-носитель оказывается благоприятной для развития микроорганизмов. В качестве среды-носителя был выбран песчаный слой толщиной 1,5 м. Доступ кислорода обеспечивается с помощью вентиляции или путем естественной тяги. Сточные воды сливаются на грунт только в течение 6 часов, а остальные 18 часов отводятся на биохимические процессы. Культура микробов развивается в верхних слоях песка.
Этот метод очистки, названный методом капельной фильтрации, впервые использован в прошлом веке (1866 г.) в Лондоне. Метод позволяет при использовании 1 га песчаной почвы очистить 1,038·106л/с. сточных вод, следовательно, Лондону в 1866г. для очистки 1,57·109л/с. сточных вод необходимо было иметь 810 га подходящих земель. Это слишком большая площадь.
Усовершенствование метода капельного фильтра – перполяционный фильтр – разбрызгивание сточных вод на пласт щебня. Наиболее широко система с перполяционным фильтром стала применяться, когда были достигнуты успехи в области получения пластмасс с заданными свойствами. В современных системах очистки накопление бактериального материала осуществляется на пластмассовых дисках, смонтированных на вращающейся оси. Диски наполовину погружены в сточные воды, по мере их вращения бактерии периодически снабжаются питательной средой и кислородом. Сейчас метод капельного фильтра используют только при условии дешевой земли и мягкого климата.
Наиболее универсальным способом обработки сточных вод является обработка активным илом. Сточные воды смешивают с илом, образовавшимся в результате предварительного окисления вод, поэтому способ и получил такое название.
Как известно, ил представляет собой огромную популяцию различных бактерий, грибков и другой флоры, добавление которой к сточным водам приводит к быстрому установлению равновесия, способствующего разложению органических веществ, в результате которого образуются СО2 и Н2О. По существу авторы нового способа обработки изменили естественный биологический цикл таким образом, что скорость потребления питательного вещества (т.е., скорость разложения органического вещества) увеличилась на несколько порядков. Дальнейшее усовершенствование этого способа связано с разработкой методов надлежащего ухода и питания используемой популяции микроорганизмов.
Активный ил представляет собой аморфный коллоид с поверхностью 100 м2/г сухого вещества, имеет вид буро-желтых мелких хлопьев размером 3–150 мкм, взвешенных в воде. B 1 г сухого ила содержится от 108до 1012 штук бактерий. При этом определенный вид бактерий способен окислять определенные вещества.
Бактерии, входящие в состав активного ила, способны перерабатывать только те сточные воды, из которых сформировался этот активный ил. Поэтому, если в состав очищаемых промышленных стоков будут введены новые вещества, например при изменении технологии производства, то потребуется время, чтобы бактерии, способные окислить именно эти вещества, размножились в достаточном количестве и смогли обеспечить наилучшую очистку.
Иногда даже приходится завозить на вновь создаваемое предприятие активный ил с другого предприятия, где очищаются аналогичные по составу воды и где в активном иле распространены нужные виды бактерий.
Обычно концентрацию активного ила поддерживают равной 2–4 г/л. В ходе очистки активный ил время от времени выводят из очистных сооружений, так как его количество растет. Часть его при этом используется в качестве ценного удобрения, если нет тяжелых металлов, часть стабилизируют, т. е. обрабатывают избытком кислорода для удаления всевозможной органики, предотвращая таким образом гниение. Часть поступает на анаэробное разложение. Аппаратура для аэробной биохимической очистки представляет собой так называемый аэротенк, или окситенк (рис. 4.5).
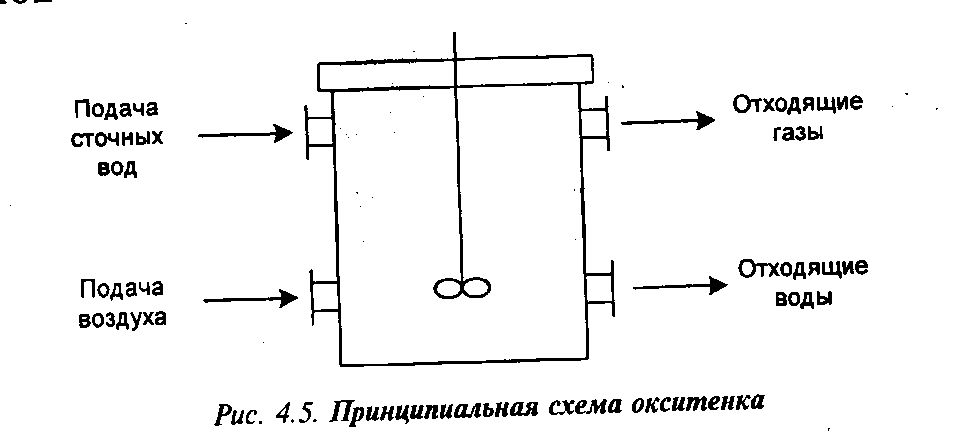
б) Анаэробная биохимическая очистка. В случае, если БПК намного выше нормы, а также для удаления избытка активного ила и отходов сельскохозяйственных продуктов применяют анаэробную биохимическую очистку в метантенках (реактор с мешалкой и теплообменником). При этом источником кислорода в воде служат группы кислородосодержащих анионов: NO  ; SО
; SО  ; CO
; CO  .
.
В основе метанового брожения лежит способность сообществ определенных микроорганизмов в ходе жизнедеятельности сначала в фазе кислого водородного брожения с помощью бактерий гидролизовать сложные органические соединения до более простых, а затем с помощью метанообразующих бактерий превращать их в метан и в угольную кислоту.
Процесс окисления–восстановления – это переход электронов от субстрата-донора к конечному акцептору. Для аэробной реакции конечным акцептором является кислород, а при ферментации (анаэробной очистке) – органическое соединение, образующееся в результате «простого перемещения» водорода из одной органической молекулы в другую:
С6Н12О6 = ЗСН3СООН + 15 ккал;
2СН3СООН = 2СН4 + 2СО2.
Образующийся газ состоит из метана (65%) и СО2 (33%) и может быть использован для нагрева до 45–55°С в самом метантенке, где происходит анаэробное брожение. Сброженный осадок имеет высокую влажность (95–98%), его уплотняют, сушат, затем используют в качестве удобрения или, если есть токсичные примеси, сжигают;
Однако не всякие сточные и природные воды могут быть очищены биохимическими методами. Нормы на содержание вредных веществ в сточных и природных водах, поступающих на биологические очистные сооружения, по некоторым металлам следующие: А13+ – 5 мг/л; Fе3+ – 5 мг/л; Сr6+ – 0,1 мг/л; Mg2+ – 1000 мг/л.
Не все органические вещества разлагаются на станциях биохимической очистки. Так, практически не разрушается бензин, красители, мазут и др. Эффективность биохимической очистки на самых современных установках составляет 90% по органическим веществам и лишь 20–40% – по неорганическим, т. е. практически не снижается солесодержание. Не могут быть очищены воды, содержащие более 1000 мг/л фенолов, 300–500 мг/л спиртов, 25 мг/л нефтепродуктов, т. е. для многих случаев эти методы не эффективны. В среднем эффективность анаэробного метода составляет около 40.
Процессы анаэробной очистки проводят в специальных метантенках при температуре 30–55°С, выделяющийся метан СН4 может быть использован для нагрева метантенка.
Например, в США при анаэробной очистке сточных вод животноводческого комплекса (500 голов свиней) за счет сжигания метана после анаэробной очистки комплекс не только обеспечивает себя электроэнергией, но иногда в летнее время может даже продавать ее. Образующиеся после анаэробной очистки сточные воды могут быть использованы для выращивания специальных одноклеточных водорослей типа хлореллы, которые в дальнейшем могут быть использованы на корм скоту. Цикл оказывается замкнутым.
Необходимо искать такие способы ликвидации отходов, которые дают возможность получать полезные продукты, например, дрожжи для выпечки хлебо-булочных изделий и для производства этилового спирта или для превращения отходов, образующихся при переработке древесной пульпы, в полезный продукт.
4. Обеззараживание воды
Последней стадией подготовки воды для питьевых и других нужд является ее обеззараживание, т. е. избавление от болезнетворных микроорганизмов, так как хорошо известно, что через воду могут распространяться такие страшные заболевания, как холера, брюшной тиф, инфекционный гепатит и др. Многие годы обеззараживание воды осуществляли с помощью обработки ее хлором. Однако стало известно, что полихлорированные бифенилы являются ядами, их находят в основном в жирах. Окисляясь, они образуют абсолютные яды – диоксины. Летальная доза диоксинов в организме для свиней, которые являются тест-объектами, – 10 мкг/кг их веса. Но эту дозу можно набрать и постепенно. Это привело ученых к выводу, что хлорирование может быть вредным. Во многих странах в 80-е годы перешли к обработке воды фторированием, но оказалось, что оно тоже вредно. Поэтому во всем мире и в России тоже отдают предпочтение обработке воды озонированием.
Биологическая очистка не может обеспечить обессоливания сточных вод. Как известно, вода питьевого качества должна содержать не более 1000 мг/л солей, из них: хлоридов – 350 мг/л, сульфатов – 500 мг/л. Необходимую в технических целях пресную воду получают методами выделения солей из сточных и природных вод.
5. Специальные методы очистки воды
Существует много специальных методов выделения солей из природных и сточных вод.
а) Дистилляция (выпаривание) – хорошо освоенный и широко применяемый метод. Мощность выпарных установок составляет 15–30 тыс. м3 в сутки. Одни из самых мощных выпарных установок располагаются на предприятиях атомной энергетики, где необходимо опреснение морской воды, например, в г. Шевченко (реактор на быстрых нейтронах). Основным недостатком этого способа является большой расход энергии – 0,020 Гкал/т. Геоопреснительные установки невелики по мощности (< 20 м3/с.), а стоимость опреснения велика.
б) Вымораживание. При медленном охлаждении соленой воды из нее в первую очередь выделяются кристаллики льда, практически не содержащие солей. По сравнению с дистилляцией вымораживание имеет энергетические, технологические, конструкционные преимущества.
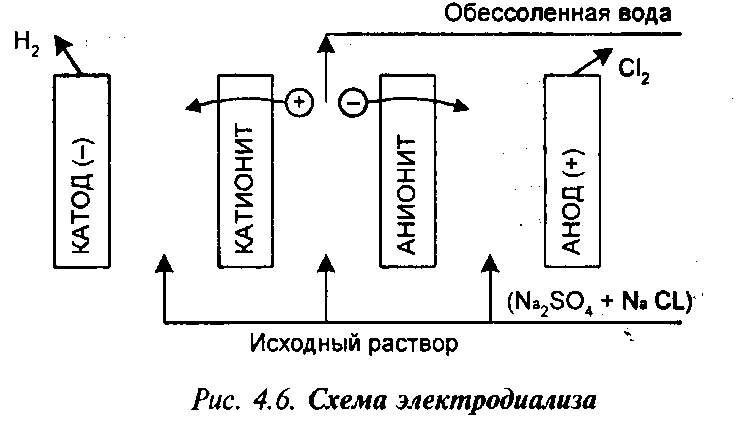
в) Мембранный метод. Это электродиализ и гиперфильтрация, или обратный осмос. Электродиализ – современный метод деминерализации и концентрирования растворов. Основан на направленном переносе ионов диссоциированных солей в поле постоянного тока через ионселективную мембрану из естественного или синтетического материала. Схема электродиализа представлена на рис. 4.6. За рубежом этот метод получил широкое распространение для обессоливания морской воды. Например, установка в Ливии на 20 тыс. м3/с., в США – на 400 тыс. м3.
Метод обратного осмоса – это процесс разделения водных растворов путем их фильтрования через полупроницаемую мембрану под действием давления выше осмотического (до 6–8 МПа).
Процесс характеризуется небольшими энергозатратами. За рубежом освоено производство установок производительностью до 1 тыс. м3/с. У нас работают установки меньшей мощности, но есть разработки и проекты на большие мощности. Основные трудности этих методов – в создании полупроницаемых мембран и давления.
г) Ионный обмен. Метод широко применяется во всех странах мира. До настоящего времени этот метод является основным для приготовления глубоко обессоленной воды для АЭС и ТЭС с котлами сверхвысокого и критического давления. Кроме того, метод ионного обмена широко используется в водооборотных циклах на предприятиях для концентрирования и извлечения из сточных вод ценных компонентов (например, тяжелых металлов).
Основной недостаток общепринятых технологических схем ионного обмена – избыток растворов солей после регенерации ионообменных фильтров. Велик расход воды на собственные нужды (20–60% от производительности). Существует необходимость удаления органических веществ, чтобы избежать отравления ионитами. Поэтому ионный обмен с большим допущением можно назвать методом обессоливания сточных вод, скорее это технологический прием получения воды высокой степени очистки.
Очень широкое применение этот метод нашел в практике умягчения воды, т. е. избавления ее от солей постоянной жесткости.
6. Удаление остаточных органических веществ
После биохимической очистки могут остаться органические вещества, плохо усваиваемые микроорганизмами. Лучший способ их удаления – адсорбция активированным углем, который затем регенерируется при нагревании.
Обычно сточные воды пропускают через колонки с активированным углем, где обеспечен контакт с ним в течение 20– 40 мин. Это весьма эффективный метод, позволяющий очистить сточные воды до БПК < 1 мгО2/л (меньше нормы по ГОСТ). Аппаратура для применения этого метода довольно простая.
Адсорбция активированным углем эффективна для большинства органических соединений и используется для очистки бытовых стоков, жидких отходов перегонки нефти, фенолов и других ароматических соединений.
С целью перехода на более рациональное потребление воды и сокращения сброса загрязнений в водные объекты разработаны оптимальные нормы и укрупнены удельные показатели водопотребления и водоотвода для различных отраслей народного хозяйства с учетом совершенствования технологических процессов.
Введены в эксплуатацию замкнутые системы водного хозяйства на Краснодарском витаминном заводе, Липецком металлургическом комбинате.
В 1996 г. в г. Москве была проверена водоохранная деятельность на территории города. Установлено, что к основным нарушениям относятся неудовлетворительная эксплуатация и состояние водоочистного оборудования, отсутствие разрешений на спецводопользование, сброс сточных вод с превышением нормативных показателей. Участились случаи аварийных и залповых выбросов загрязняющих сточных вод на рельеф местности и в водоемы. В 1996 г. в водоемы города было сброшено 1305 тыс. т загрязняющих веществ (нефтепродуктов, тяжелых металлов, нитратов, хлоридов, взвешенных веществ и др.), но это почти в 2 раза меньше, чем в 1995 г. Количество загрязняющих веществ, сброшенных в 1996 г., составляет 22 наименования (табл. 4.3). Количество воды, используемой в оборотно-повторном водоснабжении, растет недостаточно: лишь на 16 предприятиях строятся очистные сооружения, а также системы оборотного водоснабжения.
Охрана литосферы
Твердые бытовые отходы и их утилизация. Общая площадь суши Земли составляет 149,1 млн км2, из них пригодны для обитания людей 133 млн км2.
Основные виды загрязнения литосферы – твердые бытовые и промышленные отходы. На одного жителя в городе в среднем приходится в год примерно по 1 т твердых отходов, причем эта цифра ежегодно увеличивается.
В городах под складирование бытовых отходов отводятся большие территории. Удалять отходы следует в короткие сроки, чтобы не допускать размножения насекомых, грызунов, предотвращать загрязнение воздуха. Во многих городах действуют заводы по переработке бытовых отходов, причем полная переработка мусора позволяет городу с населением в 1 млн человек получать в год до 1500 т металла и почти 45 тыс. т компоста – смеси, используемой в качестве удобрения. В результате утилизации отходов город становится чище, кроме того, за счет освобождающихся площадей, занятых свалками, город получает дополнительные территории. Например, в Москве к 1990 г. было зарегистрировано 150 свалок, из них только 3 – действующие. Часть новых кварталов Москвы размещена на территории бывших свалок, и поскольку во время строительства еще не было правильно организованных технологий свалок, то в этих районах города необходим особенно тщательный контроль воздуха на присутствие токсичных веществ.
Правильно организованная технологическая свалка – это такое складирование твердых бытовых отходов, которое предусматривает постоянную, хотя и очень долговременную, переработку отходов при участии кислорода воздуха и микроорганизмов. На рис. 4.7 дана схема безопасного захоронения отходов, которая может послужить иллюстрацией к вышесказанному, хотя она относится к промышленным отходам, но принцип складирования отходов, представленный на этой схеме, надежно обеспечивает охрану территории ОС.

На рисунке представлен разрез безопасного хранилища, построенного фирмой «Olin Chemical» для размещения о
Дата добавления: 2016-01-20; просмотров: 1555;
