Окислительно-восстановительные потенциалы. Механизм их возникновения, биологическое значение. Нормальный водородный электрод
Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh илиEh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода: Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представитьуравнением:
Aox + n·e− → Ared,то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей)реагирующих веществ выражается уравнением Нернста. Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией[2] и выражают в милливольтах (мВ) относительно стандартного водородного электрода встандартных условиях.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ, равновесная разность гальвани-потенциалов (см.Межфазные скачки потенциала)между электролитом (р-ром, расплавом, твердым электролитом) и металлом(или др. электронным проводником), при к-рой с равной скоростью протекают р-ции окисления ивосстановления.
Простейший пример возникновения окислительно-восстановительного потенциала представляет система, в к-рой устанавливается равновесие между атомами металла и соответствующими катионами р-ра, напр.: Zn 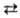 Zn2+ + 2е, Сu
Zn2+ + 2е, Сu 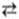 Cu2+ + 2е и т.п. В таких системах окислительно-восстановительный потенциал зависит от природы металла и термодинамич. активности окисленной формы (Zn2+, Cu2+).
Cu2+ + 2е и т.п. В таких системах окислительно-восстановительный потенциал зависит от природы металла и термодинамич. активности окисленной формы (Zn2+, Cu2+).
Если индифферентный электрод погружен в электролит, содержащий окислит.-восстановит. (редокс-) систему, то в такой системе протекает два электродных процесса, или две окислит.-восстановит. полуреакции, сопровождающиеся переходом электронов между участвующими в р-ции молекулами или (и) ионами. В общем виде этот процесс м.б. изображен: Ох + ne 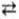 Red (Ox и Red - окисленная и восстановленная формы частицы или частиц, п - число электронов, участвующих в р-ции). Окислительно-восстановительный потенциал, возникающий в таких системах, зависит от природы редокс-реакции и от активностей (фугитивностей) обоих электроактивных соед., а также др. возможных участников процесса (напр., Н+, ОН- и т.д.) и не зависит от материала электрода.
Red (Ox и Red - окисленная и восстановленная формы частицы или частиц, п - число электронов, участвующих в р-ции). Окислительно-восстановительный потенциал, возникающий в таких системах, зависит от природы редокс-реакции и от активностей (фугитивностей) обоих электроактивных соед., а также др. возможных участников процесса (напр., Н+, ОН- и т.д.) и не зависит от материала электрода.
На практике для определения окислительно-восстановительного потенциала строят электрохим. цепи из нек-рого стандартного электрода и электрода, на к-ром протекает соответствующий редокс-процесс. В водных р-рах в качестве стандартного используют водородный электрод. В такой цепи эдс приравнивается к значению окислительно-восстановительного потенциала и выражается Нернста уравнением:
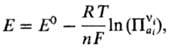
где ai;-активности участников редокс-процесса, vi - их стехио-метрич. коэффициенты, R-универсальнаягазовая постоянная, T - абс. т-ра, F- число Фарадея, причем для исходных в-в принимается vi < 0, а для продуктов р-ции vi > 0. Стандартный потенциал Е0 равен окислительно-восстановительному потенциалу приактивностях (или/и фугитивностях) компонентов, равных единице, и зависит от природы редокс-процесса и от т-ры. В указанной цепи протекает суммарная р-ция Ох + Н2 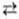 Red + 2Н+ и Е0 = = -
Red + 2Н+ и Е0 = = - 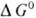 /nF, где
/nF, где 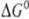 -стандартное изменение своб. энергии Гиббса для этой р-ции. Т. обр., окислительно-восстановительный потенциал можно рассматривать как меру стандартной своб. энергии редокс-процесса. В связи с этим Е0м.б. также вычислены из термодинамич. данных и констант равновесия соответствующих процессов и сами могут служить для их нахождения. Величины Е0 сведены в таблицы и с их помощью можно решать вопрос о направлении и полноте протекания тех или иных редокс-процессов.
-стандартное изменение своб. энергии Гиббса для этой р-ции. Т. обр., окислительно-восстановительный потенциал можно рассматривать как меру стандартной своб. энергии редокс-процесса. В связи с этим Е0м.б. также вычислены из термодинамич. данных и констант равновесия соответствующих процессов и сами могут служить для их нахождения. Величины Е0 сведены в таблицы и с их помощью можно решать вопрос о направлении и полноте протекания тех или иных редокс-процессов.
Вместо термина "окислительно-восстановительный потенциал" рекомендуется употреблять термины "обратимый потенциал", "потенциал окислит.-восстановит. полуреакции" или "стандартный потенциалокислит.-восстановит. полуреакции", к-рые более адекватно отражают физ. смысл явления образования скачка потенциала.Стан-й водородный потенциал: 2H++2e-=H20 Ст.электр.потенциал Ме:Электродный потенциал, измеренный относительно стандартного водородного потенциала при условии, что концентрация свободных гидратированных ионов Ме равна 1 моль/л раствора электролита.
Дата добавления: 2016-01-16; просмотров: 3460;
