Вывод уравнения Нернста
Нернст изучал поведение электролитов при пропускании электрического тока и открыл закон. Закон устанавливает зависимость между электродвижущей силой ( разностью потенциалов ) и ионной концентрацией. Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура. Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов. 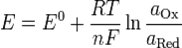 ,
,
где
· 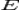 — электродный потенциал,
— электродный потенциал, 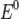 — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
· 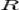 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
·  — абсолютная температура;
— абсолютная температура;
· 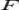 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
· 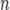 — число молей электронов, участвующих в процессе;
— число молей электронов, участвующих в процессе;
· 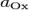 и
и 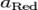 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант 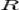 и
и 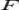 и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при 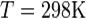 получим
получим
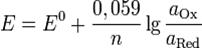
Ионоселективным электродом называется индикаторный или измерительный электрод с относительно высокой специфичностью к отдельному иону или типу ионов.
Ионселективные электроды имеют следующие достоинства: они не оказывают воздействия на исследуемый раствор; портативны; пригодны как для прямых определений, так и в качестве индикаторов в титриметрии.
В зависимости от типа мембраны ионселективные электроды можно разделить на следующие группы:
· твердые электроды - гомогенные, гетерогенные, на основе ионообменных смол, стекол, осадков, моно- и поликристаллов;
· жидкостные электроды на основе жидких ионитов хелатов - нейтральные переносчики, биологически активных веществ;
· газовые и энзимные электроды Стеклянные электроды — вид аналитического оборудования для определения концентрации ионов в растворе. Важная часть приборов химического анализа и физико-химических исследований. В современной практике широко применяются мембранные ионоселективные электроды (ИСЭ, в том числе и стеклянные), являющиеся частью гальванического элемента. Электрический потенциал электродной системы в растворе чувствителен к изменению содержания определённого вида ионов, что выражается и в зависимости электродвижущей силы (ЭДС) гальванического элемента от концентрации этих ионов.
Дата добавления: 2016-01-16; просмотров: 5398;
