VII.1. Биологическое окисление. Окислительное фосфорилирование
Небиологические системы могут совершать работу за счет тепловой энергии. Биологические системы функционируют в изотермическом режиме и для осуществления процессов жизнедеятельности используют химическую энергию. Каждое органическое соединение, поступающее в организм извне, или входящее в состав живой материи, обладает определенным запасом внутренней энергии (E). Часть этой внутренней энергии может быть использована для совершения полезной работы. Такую энергию называют свободной энергией (G). Уменьшение свободной энергии (ΔG имеет отрицательное значение) происходит в результате самопроизвольно протекающих реакций (с возрастанием энтропии). Такие реакции называют экзергоническими. Если при этом абсолютное значение G велико, реакция идет практически до конца, и ее можно рассматривать как необратимую. Рост свободной энергии (ΔG имеет положительное значение) возможен только при ее поступлении извне (снижение энтропии). Такие реакции называются эндергоническими.
Классическим примером эндергонической реакции служит образование глюкозо-6-фосфата из глюкозы (Авдеева Л.В., Павлова Н.А., Рубцова Г.В., 2005):
1. Глюкоза + Н3РО4 → глюкозо-6-фосфат + Н2О
(ΔG = + 13,8 кДж/моль)
Очевидно, что для обеспечения такой реакции требуется дополнительная свободная энергия, которая может высвобождаться в результате экзергонической реакции гидролиза АТФ.
2. АТФ → АДФ + Н3РО4
(ΔG = - 30,5 кДж/моль)
При сопряжении этих реакций фосфорилирование глюкозы под влиянием гексокиназы протекает в физиологических условиях. Равновесие реакций сдвинуто вправо и она практически необратима:
3. Глюкоза + АТФ → глюкозо-6-фосфат + АДФ
(ΔG = - 16,7 кДж/моль)
Таким образом АТФ, подвергаясь экзергоническому распаду, высвобождает свободную энергию, необходимую для осуществления эндергонического процесса.
В биологических системах именно АТФ – главный непосредственно используемый донор свободной энергии.Однако, использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ.Именно цикл АТФ-АДФ (рис. 18) – основной механизм обмена энергией в биологических системах, а АТФ – «универсальная энергетическая валюта» (Авдеева Л.В., Павлова Н.А., Рубцова Г.В., 2005). При этом, если АТФ служит источником (донором) свободной энергии, то для его синтеза из АДФ свободная энергия должна потребляться. Ее источником служит энергия окисления органических соединений.

Рис. 18. Цикл АТФ – АДФ
Под окислением понимают отщепление электронов, а под восстановлением - присоединение электронов.В любой окислительно-восстановительной реакции участвуют окислитель (акцептор электронов) и восстановитель (донор электронов). Одно и то же соединение может находиться в окисленной (отдав электроны) и восстановленной (присоединив электроны) формах. Такие окисленные и восстановленные формы одного и того же вещества (НАД/НАДH; Fe3+/Fe2+) называют сопряженной парой или редокс-парой. Разные редокс-пары обладают различным сродством к электрону. Те, у кого оно меньше, отдают электрон тем, у кого оно больше. Мерой сродства редокс-пары к электрону служит окислительно-восстановительный потенциал, или редокс-потенциал (Е0`), величина которого выражается в вольтах. Чем она меньше (электроотрицательнее), тем меньше сродство вещества к электрону. Чем выше это сродство, тем больше восстановительный (присоединяющий) потенциал.
Величина редокс-потенциала непосредственно связана с изменением свободной энергии уравнением Нернста:
ΔG` = - nFΔЕ0`,
Где n – число перенесенных в реакции электронов; F – постоянная Фарадея; ΔЕ0` - разность редокс-потенциалов электрон-донорской и электрон-акцепторной пар.
Отсюда следует, что чем больше будет разность редокс-потенциалов при переносе электронов от доноров с низким редокс-потенциалом к акцептору с высоким редокс-потенциалом, и чем больше электронов будет подвергаться этому переносу, тем более отрицательное значение будет иметь ΔG`, т.е., тем больше будет высвобождаться свободной энергии.
Высвобождение энергии в процессе ферментативного окисления метаболитов происходит при участии специфических дегидрогеназ. В этих реакциях дегидрирования электроны и протоны переходят от органических субстратов на коферменты НАД- и ФАД-зависимых дегидрогеназ. Далее электроны, обладающие высоким энергетическим потенциалом, передаются от восстановленных НАДH и ФАДН к кислороду через цепь переносчиков, локализованных во внутренней мембране митохондрий. В результате происходит восстановление кислорода, молекула которого присоединяет 4 электрона.
О2 + 4е → 2Н2О
(при каждом присоединении 2 электронов к молекуле кислорода из матрикса митохондрий поглощаются 2 протона, в результате чего образуется молекула Н2О).
Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называется тканевым дыханием.
Цепь переноса электронов от окисляемых органических субстратов к кислороду, называется дыхательной цепью (рис. 19).
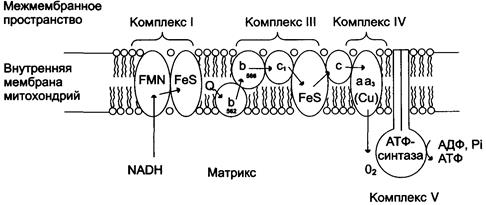
Рис. 19.Митохондриальная цепь переноса электронов.Комплекс I содержит FMN и не менее пяти железо-серных белков(FeS). Комплекс III включает две разные формы цитохрома b (с максимумами поглощения 562 и 566, один FeS-белок и цитохром с. Комплекс IV содержит цитохромы а1 и а3 и два иона меди. Комплекс II (сукцинатдегидрогеназа) на рисунке не показан. Комплекс V - АТФ-синтаза (Авдеева Л.В., Павлова Н.А., Рубцова Г.В., 2005)
Перенос электронов от окисляемых субстратов к кислороду происходит в несколько этапов. В нем участвует большое количество промежуточных переносчиков, каждый из которых способен присоединять электроны от предыдущего компонента и передавать следующему. За исключением убихинона (кофермент Q) и цитохрома С промежуточные переносчики кислорода – сложные белковые комплексы. Основные переносчики электронов встроены во внутреннюю мембрану митохондрий и организованы в 4 комплекса, расположенных в определенной последовательности (векторность). Среди них: НАДH-дегидрогеназа (НАДH-Q-редуктаза) – комплекс I; QH2-дегидрогеназа (коэнзим Q-цитохром с-редуктаза) – комплекс III; цитохромоксидаза – комплекс IV; АТФ-синтаза – комплекс V. Каждое из этих звеньев дыхательной цепи специфично в отношении донора и акцептора электронов. В этой последовательности окислительно-восстановительные потенциалы по мере приближения к кислороду становятся все более положительными.
Таким образом, электроны, поступающие в дыхательную цепь, по мере передвижения от одного переносчика к другому по возрастающему редокс-потенциалу, теряют (высвобождают) свободную энергию. Часть этой энергии рассеивается в виде тепла, а часть (40-45%) аккумулируется в молекулах АТФ.
Снижение свободной энергии происходит на каждом этапе цепи переноса электронов, т.е. энергия высвобождается порциями. Принципиальное положение заключается в том, что процесс переноса электронов в дыхательной цепи и синтез АТФ энергетически сопряжены. При этом перенос электронов на кислород сопровождается высвобождением свободной энергии (экзергонический процесс), а фосфорилирование АДФ (синтез АТФ) – запасанием (притоком) свободной энергии (эндергонический процесс). Синтез АТФ из АДФ и Н3РО4, осуществляемый за счет энергии переноса электронов, называется окислительным фосфорилированием. Этот процесс протекает во внутренней мембране митохондрий.
Механизм сопряжения транспорта электронов в дыхательной цепи и окислительного фосфорилирования сегодня обосновывается с позиций хемиосмотической гипотезы (Митчелл, 1961). В соответствии с этой гипотезой часть энергии, высвобождаемой при транспорте электронов, расходуется на выкачивание протонов из матрикса митохондрий в межмембранное пространство. В результате между двумя сторонами внутренней митохондриальной мембраны (непроницаемой для протонов) создается концентрационный и электрический градиенты, обусловленные их скоплением на внешней поверхности внутренней мембраны. В совокупности эти градиенты формируют электрохимический потенциал ΔµН+.
Наиболее активный транспорт протонов в межмембранное пространство, необходимый для формирования ΔµН+ происходит на участках дыхательной цепи, соответствующих расположению комплексов I, III и IV. Эти участки называют пунктами сопряжения дыхания и фосфорилирования. Механизм транспорта протонов в пунктах сопряжения через митохондриальную мембрану недостаточно ясен, однако важная роль в этом процессе отводится коэнзиму Q. Предполагается, что когда ионы Н+ возвращаются из цитозоля межмембранного простанства в матрикс, проходя через ионные каналы АТФ-синтазы, именно этот градиент служит движущей силой для синтеза АТФ.
Эффективность синтеза молекул АТФ оценивается коэффициентом окислительного фосфорилирования, представляющего собой отношение количества фосфорной кислоты, использованной на фосфорилирование АДФ, к атому кислорода, поглощенного в процессе дыхания (Р/О).Для НАДН теоретический минимум Р/О равен 3; для сукцината – 2. Фактически эти величины ниже.
Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в дыхательной цепи. Если АТФ не используется и его концентрация в клетке возрастает, поток электронов к кислороду прекращается. Рост АДФ, наоборот, увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называется дыхательным контролем. Этот контроль обеспечивает соответствие скорости синтеза АТФ к потребности клетки в энергии. Благодаря такому контролю относительная концентрация АТФ/АДФ в клетке изменяется в узких пределах, тогда как потребление клеткой энергии, т.е. скорость оборота АТФ/АДФ может меняться в десятки раз. За сутки у человека синтезируется 40-60 кг АТФ и столько же распадается. Продолжительность жизни каждой молекулы АТФ составляет около 1 минуты. Общее содержание АТФ в организме – 40-50 г.
VII.2. Патогенез
Как отмечалось выше,основу (центральное звено патогенеза) тканевой гипоксии составляют два основных механизма, а именно: 1) нарушение способности клеток утилизировать кислород в ходе биологического окисления; 2) снижение эффективности биологического окисления в результате разобщения тканевого дыхания с окислительным фосфорилированием.
Первый их этих патогенетических механизмов может быть индуцирован:
А)Наследственными дефектами ферментов цепи передачи электронов и цитратного цикла.
Б) Нарушением синтеза дыхательных ферментов (дефицит компонентов, необходимых для их образования: витаминов В1, В3 (РР), никотиновой кислоты).
В) Ингибированием дыхательных ферментов, которое может реализовываться по следующим основным путям (Лосев Н.И., 1992):
1) специфическим связыванием активных центров ферментов: НАДН-дегидрогеназы (ротенон – высокотоксичное вещество, содержащееся в некоторых водорослях); QH2-дегидрогеназы (антимицин А – токсичный антибиотик из Streptomyces); цитохромоксидазы (СО, Н2S, цианид). Наиболее токсичным для человека является цианид, который, присоединяясь к Fe3+ цитохромоксидазы, блокирует перенос электронов к кислороду;
2) связыванием функциональных групп белковой части молекулы фермента (ионы тяжелых металлов, алкилирующие агенты);
3) конкурентным торможением путем блокады активного центра ферментов «псевдосубстратами». Например, ингибирование сукцинатдегидрогеназы малоновой и другими дикарбоновыми кислотами;
4) снижением активности ферментов вследствие отклонений физико-химических параметров клеток ткани (рН, электролиты и др.), возникающих при разнообразных заболеваниях и патологических процессах.
Г) Дезинтеграцией (повреждением) клеточных мембран (свободнорадикальные процессы, радиация, токсические метаболиты при уремии, кахексии, тяжелой инфекции). Практически почти любое тяжелое состояние организма содержит элемент тканевой гипоксии такого рода.
Второй патогенетический механизм тканевой гипоксии – «гипоксии разобщения»(Д)возникает при резко выраженном уменьшении сопряженности окисления и фосфорилирования в дыхательной цепи. Такое уменьшение может быть обусловлено:
· Присутствием химических веществ (ионофоров), способных переносить протоны из межмембранного пространства в матрикс митохондрий, минуя протонные каналы АТФ-синтазы. В числе этих веществ – анионы жирных кислот, 2,4-динитрофенол и др. Присоединяя протон на внешней стороне мембраны митохондрии, они в таком виде пересекают мембрану и диссоциируют на ее внутренней стороне, отдавая Н+ в матрикс. Тем самым снижается необходимый для синтеза АТФ из АДФ протонный градиент. Образовавшийся анион вновь возвращается на наружную сторону мембраны с помощью АТФ/АДФ-антипортера. Таким образом, свободные жирные кислоты служат не только субстратом окисления, но и важнейшим регулятором разобщения дыхания и фосфорилирования. Соответственно, стимуляция липолиза под влиянием катехоламинов, тироксина, сопровождающаяся увеличением концентрации свободных жирных кислот, будет приводить к калоригенному эффекту (тиреотоксикоз; стадия компенсации при гипотермии) за счет ограничения аккумуляции свободной энергии в молекулах АТФ. В качестве разобщителя могут выступать ионы Са2+ (связывание неорганического фосфата), Н+-ионы, некоторые лекарства (дикумарин, грамицидин), микробные токсины и метаболиты (билирубин). Действие последних реализуется при их высокой концентрации.
· Наследственными дефектами белков, участвующих в окислительном фосфорилировании. Примерно 13 из 100 этих белков кодируются митохондриальной ДНК, остальные – ядерные. Нарушения окислительного фосфорилирования, в основном, связаны с мутациями в митохондриальной ДНК, которые случаются в 10 раз чаще, чем в ядерной. Эти дефекты наследуются по материнской линии, т.к. митохондрии сперматозоидов не проникают в оплодотворенную яйцеклетку. Реализация мутаций митохондриальной ДНК высока не только в силу большей частоты самих мутаций, но и вследствие отсутствия в митохондриях столь же эффективной системы репарации, как в ядре клетки. С возрастом такие соматические мутации накапливаются и возможность клеток синтеза АТФ снижается (Авдеева Л.В., Павлова Н.А., Рубцова Г.В., 2005).
Дата добавления: 2015-12-29; просмотров: 4853;
