Диффузия в растворах. Осмос и осмотическое давление. Закон Вант-Гоффа.
Диффузия — это процесс, ведущий к равномерному распределению молекул растворенного вещества и растворителя. Как всякое движение, диффузия требует энергии. Диффузия всегда направлена от большей концентрации данного вещества к меньшей, от системы, обладающей большей свободной энергией, к системе с меньшей свободной энергией. Скорость диффузии зависит от температуры, природы вещества и разности концентраций. Чем выше концентрация данного вещества, тем выше его активность и его химический потенциал. Диффузионное передвижение вещества всегда идет от большего к меньшему химическому потенциалу. Наибольший химический потенциал у чистой воды. Добавление к воде молекул растворенного вещества приводит к возникновению связи между молекулами воды и растворенного вещества, что уменьшает ее активность, ее свободную энергию, ее химический потенциал. В том случае, если диффундирующие вещества встречают на своем пути мембрану, движение замедляется, а в некоторых случаях прекращается. Диффузия воды по направлению от своего большего к меньшему химическому потенциалу через мембрану носит название осмоса. Иначе говоря, осмос — это диффузия воды или другого растворителя через полупроницаемую перепонку, вызванная разностью концентраций или разностью химических потенциалов.
Осмос— результат неравенства химических потенциалов воды по разные стороны мембраны. Идеальная полупроницаемая мембрана пропускает молекулы воды и не пропускает молекулы растворенного вещества.
Закон Вант-Гоффа.Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора. 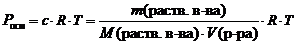 ,
,
где Росм – осмотическое давление, кПа;
с – молярная концентрация растворенного вещества, моль/л;
R – универсальная газовая постоянная, 8,314 Дж/(моль×К);
Т – абсолютная температура, К;
V(р-ра) – объем раствора, л.
Осмос – односторонняя диффузия вещества через полупроницаемую мембрану.
Осмотическое давление – сила, обуславливающая осмос. Оно равно внешнему давлению, при котором осмос видимо прекращается.
Указанные законы справедливы для разбавленных растворов неэлектролитов. Их можно применять и к растворам электролитов, но в этом случае необходимо вводить изотонический коэффициент Вант-Гоффа (i). Это поправочный коэффициент, который учитывает увеличение числа частиц в растворе электролита из-за диссоциации на ионы. 
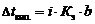
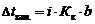
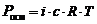
Значение изотонического коэффициента Вант-Гоффа рассчитывают как частное от деления экспериментальных и теоретических значений осмотического давления, изменения температур кипения и замерзания растворов и понижения давления растворителя над раствором: 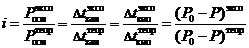
Дата добавления: 2016-01-16; просмотров: 3592;
