БУФЕРНЫЕ СИСТЕМЫ. КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ
Буферными называют растворы, способные сохранять значение рН при разбавлении или добавлении небольших количеств кислоты или щелочи.К таким растворам относят:
1) Растворы, содержащие слабую кислоту и соль этой кислоты и сильного основания (СН3СООН + СН3СООNa);
2) Растворы, содержащие слабое основание и соль этого основания и сильной кислоты (NH4OH + NH4Cl);
3)Растворы, содержащие соли многоосновных кислот (Na2HPO4 + NaH2PO4).
Расчет рН буферного раствора
Расчета рН буферных растворов осуществляется по уравнению Гендерсона – Гассельбаха:
– для кислотного буфера уравнение имеет вид
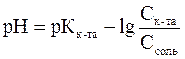 .
.
– для основного буфера
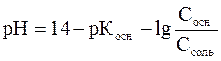
Уравнения показывают, что рН буферного раствора данного состава определяется отношением концентраций кислоты и соли или основания и соли, поэтому не зависит от разбавления. При изменении объема раствора концентрация каждого компонента изменяется в одинаковое число раз.
Буферная емкость
Способность буферных растворов сохранять постоянство рН ограничена. Т.е. прибавлять кислоту или щелочь, существенно не меняя рН буферного раствора, можно лишь в ограниченных количествах.
Величину, характеризующую способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочи, называют буферной ёмкостью раствора (В).
Буферная ёмкость измеряется количеством молей эквивалентов сильной кислоты или щелочи, добавление которой к 1 л буферного раствора изменяет рН на единицу.
Математически буферная ёмкость определяется следующим образом:
В по кислоте (моль/л ил ммоль/л):
 ,
,
где n(1/z HA) – количество моль эквивалентов кислоты, рН0 и рН – рН буферного раствора до и после добавления кислоты, VБ – объем буферного раствора.
В по щелочи (моль/л или ммоль/л):
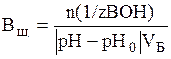 ,
,
где n (1/z ВОН) – количество моль эквивалентов щелочи, остальные обозначения те же.
Буферная ёмкость зависит от ряда факторов:
1. От природы добавляемых веществ и компонентов буферного раствора. Т.к. некоторые вещества могут образовывать нерастворимые соединения или комплексы или давать другие нежелательные реакции с компонентами буферной системы, тогда понятие буферной ёмкости теряет смысл.
2. От исходной концентрации компонентов буферной системы.
Чем больше количества компонентов кислотно-основной пары в растворе, тем больше буферная ёмкость этого раствора.
Предел соотношения концентраций компонентов буферного раствора, при котором система все еще сохраняет свои свойства. Интервал рН = рК ± 1, называется зоной буферного действия системы. Это соответствует интервалу соотношения Ссоли/Ск-ты от 1/10 до 10/1.
Вк (крови) = 0,05моль/л; Вк (плазмы) = 0,03 моль/л; Вк (сыв.крови) = 0,025 моль/л
Дата добавления: 2016-01-09; просмотров: 2382;
